COMUNICACIÓN CORTA
Biotecnología
Vegetal Vol. 15, No. 1: 59 - 62, enero - marzo, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto de 6-BAP en la multiplicación in vitro
de Spathiphyllum wallisii Regel
Effect of 6-BAP on in vitro multiplication of Spathiphyllum wallisii Regel
Lourdes R. García*, Marta Pérez, Dámaris Torres. *Autora para correspondencia
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: lourdes@ibp.co.cu
RESUMEN
Spathiphyllum ocupa un lugar primordial dentro de las plantas ornamentales por la belleza tanto de su follaje como de la inflorescencia que emite. El presente trabajo se realizó con el objetivo determinar el efecto del 6-BAP en el incremento del número de brotes in vitro. Los resultados mostraron que el mayor número de brotes por explante se logró cuando se utilizaron 4 mg l-1 de 6-BAP en el medio de cultivo en los tres subcultivos de multiplicación que se realizaron.
Palabras clave: citoquinina, micropropagación, yemas adventicias
ABSTRACT
Spathiphyllum occupies a central place within ornamental plants both for the beauty of its foliage and the inflorescence issued. The present study was conducted to determine the effect of 6-BAP in the increased number of in vitro shoots. The results showed that the greatest number of shoots per explant was achieved when used 4 mg l-1 6-BAP in the culture medium in the three multiplication subcultures performed.
Keywords: adventitious buds citoquinine, micropropagation
INTRODUCCIÓN
En Cuba, durante el transcurso de los años, se han experimentado numerosos cambios en el comercio de semillas de plantas ornamentales y en la estructura y sentido de los grandes jardines públicos y privados. Ello ha influido notablemente en la reducción de las especies ornamentales en uso (Álvarez, 2008).
La producción de plantas ornamentales y flores está limitada, principalmente, por la falta de protocolos eficientes para su propagación en gran escala, lo que condiciona la falta de material vegetal de calidad y la poca diversidad existente en el país. Esta es una de las causas de la necesidad de la importación de varias especies para poder satisfacer la demanda creciente de estas plantas en el mercado (Hernández et al., 2009).
Spathiphyllum es un género de plantas con flores pertenecientes a la familia Araceae. La especie S. wallisii Regel (2n=2x=30) está compuesta por plantas monocotiledóneas perennes, herbáceas con hojas grandes, ovaladas de color verde oscuro, brillantes, con ápice muy destacado, que nacen directamente del suelo. La inflorescencia consiste en un espádice cerrado por una espata, son muy atractivas y persistentes y se emiten en primavera y verano. Es una de las pocas plantas de interior que conjuga el atractivo de sus hojas con elegantes flores. Son muy utilizadas en hogares y oficinas, no sólo por su belleza y adaptación a bajas intensidades luminosas, sino que es una de las plantas que más purifica el aire (Jietang et al., 2012; Lakshmanan et al., 2013).
El uso comercial del espatifilo es diverso desde plantas en macetas, decoración de peceras como planta acuática, y arreglos florales por la persistencia de la flor. La propagación de estas especies principalmente es vegetativa, por separación de los vástagos que se desarrollan. La propagación por semillas es muy difícil y limitada.
Los métodos de propagación in vitro son usados para la propagación a gran escala de plantas ornamentales. En este género se han desarrollado numerosas investigaciones que han abarcado diferentes campos dentro del cultivo de tejidos: organogénesis (Teixeira et al., 2006; Hasson et al., 2007; Hernández et al., 2009), cultivo de óvulos y anteras, (Lakshmanan et al., 2013), cultivo de protoplastos (Duquenne et al., 2007), propagación utilizando bioreactores (Bewir et al., 2006; Hasson et al., 2007), florecimiento in vitro (Hassan et al., 2007), inducción de poliploidía (Vanstechelman et al., 2010, Katrijn et al., 2011), efecto del magnetismo en la propagación in vitro (Thanh et al., 2012), embriogénesis somática (Jietang, et al., 2012) y el efecto de aplicaciones foliares de reguladores del crecimiento sobre las plantas (Rahbarian et al., 2014).
Sin embargo, en la mayoría de los artículos científicos consultados sobre la propagación in vitro de esta especie, se han utilizado medios de cultivo con bajas concentraciones de 6-BAP, lo que se traduce en limitados coeficientes de multiplicación o en subcultivos alargados para obtener el material vegetal necesario.
En Cuba, a pesar del incremento de la demanda comercial de esta planta todavía se hace insuficiente la oferta por la carencia de material vegetal de calidad para abastecer el mercado. En este trabajo se persiguió el objetivo de determinar la influencia del 6-BAP en la multiplicación in vitro de Spathiphyllum.
MATERIALES Y MÉTODOS
Material vegetal
El material vegetal fue obtenido a partir de plantas madre mantenidas en macetas en casas de cultivo libres de plagas y enfermedades.
A estas plantas se le eliminaron las hojas. La parte basal de aproximadamente 7 cm que contenía el meristemo apical fue lavada con agua corriente y detergente. Estos segmentos fueron sumergidos durante 20 minutos en frascos estériles que contenían una solución compuesta por agua estéril e Hipoclorito de Sodio (NaOCl) al 3% y se enjuagaron tres veces con agua destilada estéril. Luego el material vegetal fue cortado nuevamente hasta aproximadamente 3 cm. El proceso de desinfección se repitió nuevamente como se explicó anteriormente.
Ya en la cabina de flujo laminar se procedió al establecimiento de los ápices meristemáticos. Nuevamente se redujo el tamaño hasta 1 cm de longitud. Luego, se procedió a colocarlos en tubos de cultivo que contenían 10 ml de medio de cultivo líquido compuesto por las sales y vitaminas MS (Murashige y Skoog, 1962) con 6-Bencilaminopurina (6- BAP) (2.0 mg l-1) y AIB (0.02 mg l-1). Este material vegetal fue ubicado en cámara de crecimiento de luz solar a 27± 2°C y un fotoperíodo de 13/11h de luz/oscuridad con un rango de intensidad luminosa aproximada entre 23.2 y 44.5 µmol m-2 s-1 durante 21 días.
Posteriormente, con el objetivo de multiplicar los brotes se desarrolló un experimento con diferentes concentraciones de 6-BAP (2.0, 4.0, 6.0 mg l-1). El medio de cultivo estaba compuesto por las sales y vitaminas MS, 0.05 mg l-1 de ácido indolacético (AIA) y 30 g l-1 de sacarosa. Se emplearon recipientes de cultivo de 500 ml de capacidad con 70 ml de medio de cultivo y 20 explantes en cada uno. Los recipientes se colocaron en cámara de crecimiento de luz solar a 27± 2°C y un fotoperíodo de 13/11h de luz/oscuridad con un rango de intensidad luminosa aproximada entre 23.2 y 44.5 µmol m-2 s-1 durante 21 días.
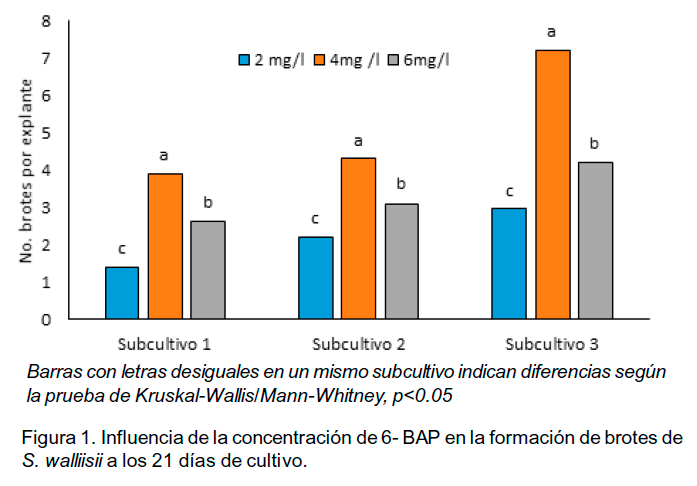
A los 21 días de cultivo se cuantificó el número de brotes por explante, momento en el cual el material vegetal fue subcultivado por separación de los brotes individualmente. Estos fueron colocados en el mismo medio de cultivo del cual procedían. Se realizaron tres subcultivos en las mismas condiciones.
RESULTADOS Y DISCUSIÓN
En este experimento se hizo evidente la influencia que ejerce el regulador del crecimiento en el número de brotes obtenidos en cada subcultivo y a medida que aumenta el número de subcultivos. En el tercer subcultivo se obtuvieron 7.2 brotes por explante tan solo a los 21 días de cultivo. Das et al. (2000) emplearon en el medio de cultivo concentraciones de 6-BAP inferiores (1mg l-1) y obtuvieron siete brotes por explante pero en el transcurso de 45 días.
La disminución del tiempo y la obtención de alto coeficiente de multiplicación es un factor muy importante a la hora de programar un proceso de producción para la propagación in vitro en esta especie.
En cada subcultivo a los 21 días de cultivo la mayoría de los brotes obtenidos alcanzaron 2.0 cm de longitud.
Bewir et al. (2006) estudiaron el efecto de varias citoquininas y concentraciones en la obtención de brotes en la fase de multiplicación en Spathiphyllum cannifolium y encontraron que los mejores resultados fueron con el empleo del 6-BAP, con diferencias significativamente con las restantes citoquininas estudiadas en concentraciones de 3 mg l-1.
REFERENCIAS
Álvarez A Z (2008) Plantas ornamentales en Cuba: usos, diversidad y amenazas. Revista del Jardín Botánico Nacional 29: 83-100
Bewir YH, Chakrabarty D, Hahn, EJ, K Y Paek (2006) A simple Method for mass propagation of Spathiphyllum cannifolium using an airlift bioreactor. In vitro Cell Dev. Biol.-Plant 42:291-297
Das A, Paul A K, Chaudhuri S (2000) Micropropagation of Spathiphyllum wallisii - an important ornamental plant. Horticultural Journal 13 (2): 71-75
Duquenne B, Eeckhaut T, S Werbrouck (2007) Effect of enzyme concentrations on protoplast isolation and protoplast culture of Spathiphyllum and Anthurium. Plant Cell Tissue and Organ Culture 91:165-173
Hassan YD, Chakrabarty D, Babar MA, Singh NE, Hahn J, Yowp KP (2007) Influence of GA3 , sucrose and solid medium/bioreactor culture on in vitro flowering of Spathiphyllum and association of glutathione metabolism. Plant Cell Tissue and Organ Culture 90: 225-235
Hernández MM, Suarez LS, M Valcárcel (2009) Empleo del Pectimorf en la micropropagación de Spathiphyllum sp. Cultivos Tropicales 30 (3): 56-58
Jietang Zhao, Jin Cui, Juanxu Liu-Feixiong Liao, Richard J Henny, Jianjun Chen (2012) Direct somatic embryogenesis from leaf and petiole explants of Spathiphyllum `Supreme' and analysis of regenerants using flow cytometry. Plant Cell Tissue and Organ Culture 110: 239-249.
Katrijn Van Laere, Soraya C Franga, Hein Vansteenkiste, Johan Van Huylenbroeck, Kathy Steppe, Marie C Van Labeke (2011) Influence of ploidy level on morphology growth and drought susceptibility in Spathiphyllum wallissi . Acta Physiologiae Plantarum 33: 1149-1156
Lakshmanan PS, Eeckhaut TJ, Van Huylenbroçck E, Van Bockstaele (2013) Micronucleation by mitosis inhibitors in developing microspores of Spathiphyllum wallissi Regel. Plant Cell Rep. 32(3): 379-388
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco cultures. Physiol. Plant. 15: 473-497
Rahbarian Parviz, Ali Salehi Sardoei, Afshar Fallah Imani (2014) Stimulatory effect of benzyladenine and gibberellic acid on growth and photosynthetic pigments of Spathiphyllum wallisii Regel plants. International Journal of Advanced Biological and Biomedical Research 2 (1): 230-237
Teixeira JA Da Silva, Giang DDT, M Tamaka (2006) Photoautotrophic micropropagation of Spathiphyllum. Photosynthetica 44 (1): 53-61
Thanh P Van Jaime, Teixeira JA Da Silva, Le Huy Ham, MichioTanaka. (2012) Effects of permanent magnetic fields on in vitro growth of Cymbidium and Spathiphyllum shoots. In vitro Cell Dev. Biol-Plant 48: 225-232
Vanstechelman I, Eeckhaut T, J.Van Huylenbroeck (2010) Histogenic analysis of chemically induced mixoploids in of Spathiphyllum wallissi. Euphytica 174 (1): 61-72
Recibido: 11-06-2014
Aceptado:
07-10-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.