ARTICULO ORIGINAL
Regeneración de esporofitos de Platycerium bifurcatum (Cav.) C.Chr. a partir de esporas germinadas in vitro
Sporophyte regeneration of Platycerium bifurcatum (Cav.) C.Chr. from in vitro germinated spores
Lourdes R. García*, Damaris Torres, Carlos Romero.*Autora para correspondencia.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: lourdes@ibp.co.cu
RESUMEN
En Cuba uno de los helechos más demandados, como planta ornamental, es el cuerno de alce (Platicerium bifurcatum) pero su propagación vegetativa es muy lenta lo que hace insuficiente la oferta de esta planta en el mercado. Además, no se cuenta con una metodología para la propagación in vitro de esta especie. El presente trabajo se desarrolló con el objetivo de obtener esporofitos de Platycerium bifurcatum a partir de esporas germinadas en medios de cultivo. Las esporas se obtuvieron desde frondas fértiles de plantas madre de P. bifurcatum. Estas fueron desinfectadas con diferentes concentraciones de hipoclorito de sodio (1, 2, 3%) durante 15 minutos. Se cuantificó el número de explantes contaminados con microorganismos y la germinación de las esporas. Adicionalmente, se estudió la concentración de las sales MS para la multiplicación de los prótalos obtenidos (0, 25, 50, 75, 100%) y se cuantificó el número de esporofitos formados por explante. Se investigó además el efecto del estado físico del medio de cultivo para el crecimiento y la multiplicación de los esporofitos. Con los resultados obtenidos se definió que con 2 % de hipoclorito de sodio y 15 minutos de exposición se logró disminuir la contaminación microbiana y no se afectó la germinación de las esporas. La mayor multiplicación de los gametofitos se logró con el medio de cultivo que contenía 50% de las sales MS, 1mg l-1 de tiamina, 2% de sacarosa. El estado físico del medio de cultivo no influyó en el crecimiento y la multiplicación de los esporofitos, lo que posibilitó seleccionar el medio de cultivo líquido para su multiplicación.
Palabras clave: helecho cuerno de alce, cultivo de tejidos en helechos, gametofitos.
ABSTRACT
In Cuba one of the most popular ferns, as an ornamental plant, is elkhorn (Platicerium bifurcatum) but its vegetative propagation is very slow so it is insufficient supply of this plant on the market. Besides, there is not in vitro propagation methodology for this species. This work was developed with the aim of obtaining Platycerium bifurcatum sporophytes from germinated spores in culture media. Spores were obtained from mother plants fertile fronds of P. bifurcatum. These were disinfected with different concentrations of sodium hypochlorite (1, 2, 3%) for 15 minutes. We evaluated the contamination percentage and spore germination. Additionally, we studied the MS salts concentration for the prothallus multiplication (0, 25, 50, 75, 100%) and we quantified sporophytes number by explant. Also we investigated the effect of the physical state of the culture medium for growth and sporophytes multiplication. With the results obtained it was defined that with 2% sodium hypochlorite and 15 minutes of exposure was reduced the percentages of contamination and was not affected spore germination. Most gametophytes multiplication achieved with the culture medium containing 50% MS salts, 1mg l-1 thiamine and 2% sucrose. The physical state of the culture medium did not influence the growth and multiplication of the sporophytes, which allowed select the liquid culture medium for their growth.
Keywords: fern elkhorn, gametophytes, tissue culture in fern.
INTRODUCCIÓN
El género Platycerium Desv. pertenece a la familia Polypodiaceae. Es epifito de distribución tropical integrado por 15 a 18 especies cultivadas en todo el mundo por su apariencia única (Camloh y Ambrozic-Dolinsek, 2011). La especie Platycerium bifurcatum (Cav.) C.Chr.(cuerno de alce) es una de las más demandadas en el mercado internacional por su majestuosidad y belleza. Este helecho se ha destacado por su importancia florística y paisajista en muchos países (Chen et al., 2001) y se cotiza a altos precios en el mercado (Darnaedi y Praptosuwiryo, 2006; Chen y Henny, 2008).
Es una planta epífita de frondes grandes y de crecimiento lento. Algunos de los frondes modificados se adaptan para hacer el soporte de la planta. Se suelen cultivar adheridos a troncos de forma lateral o en pequeñas cavidades a los lados de un eje, lo que resalta su valor ornamental.
La reproducción sexual depende de la producción de esporas que al germinar en un medio adecuado desarrollan una planta libre haploide denominada gametofito, generadora de gametos masculinos (móviles) y gametos femeninos (sésiles), las cuales al unirse producen la forma conocida del helecho, el esporofito (Hartman y Kester, 1994).
En esta especie las esporas tienen dificultades para germinar en condiciones naturales por lo que la propagación se centra en la separación de los hijuelos que se desarrollan, lo que hace extremadamente lenta su multiplicación (Amoroso y Amoroso, 2003).
Para solucionar este problema se han desarrollado numerosas investigaciones para lograr la germinación in vivo de las esporas. Para ello, se han utilizado diferentes sustratos y contenedores (Gómez Llaca y Páez de Casares, 2013). En esta vía, el ataque de agentes fitopatógenos es una de las principales limitantes.
Por otra parte,
se han realizado numerosos intentos para desarrollar protocolos de propagación
in vitro a partir de esporas, aunque en algunos casos no se logró
la formación de esporofitos en condiciones in vitro (Camloh et
al., 1994; Camloh, 1999; Evangelista et al., 2001). En otras investigaciones,
la propagación in vitro, en algunas especies de Platycerium,
se ha desarrollado mediante la regeneración directa de esporofitos a
partir de brotes (Hennen y Sheehan, 1978), de homogenizado de tejidos de hojas
(Teng y Teng, 1997), de explantes de hojas (Camloh et al., 1994; Ambrozic-Dolinsek
et al., 2002, Evangelista et al, 2003), de rizomas ( Wee et
al., 1992), de yemas (Ambrozic-Dolinsek y Camloh, 1997), de callos esporófitos
(Kwa et al., 1997) y de cuerpos globulares verdes (Huang, 2004; Liao
y Wu, 2011). En estos trabajos las principales limitaciones se concentran en
la formación de los esporofitos y la aclimatización de las plantas
en condiciones naturales. En las plantas obtenidas por esta vía no se
han observado
variaciones genéticas (Gómez Llaca y Páez de Casares, 2013).
El cultivo de plantas ornamentales en Cuba tanto con fines exportables como para la satisfacción de la demanda interna, se ha incrementado en los últimos años. Uno de los helechos más demandados es el cuerno de alce por lo que resulta insuficiente la oferta de esta planta en el mercado. En Cuba no se cuenta con una metodología para la propagación in vitro de esta especie. El presente trabajo se desarrolló con el objetivo de obtener esporofitos de Platycerium bifurcatum a partir de esporas germinadas en medios de cultivo.
MATERIALES Y MÉTODOS
Material vegetal
Las esporas se obtuvieron de frondas fértiles de plantas madre de P. bifurcatum. Las frondas fueron cortadas cuando las esporas presentaron un grado óptimo de maduración evidenciado por su color madera fornida (#DEB887); según el código hexadecimal de colores (http://www.cwp.linet.edu/cwis/cwp.html).
Germinación in vitro de esporas
Se seccionaron los extremos de los frondes que contenían los esporangios y se lavaron con agua y detergente comercial. Luego fueron enjuagados tres veces con agua corriente y se colocaron en frascos de cultivo de 250 ml que contenían hipoclorito de sodio (NaClO) en tres concentraciones (1, 2, 3%). El tiempo de desinfección fue de 15 minutos.
Una vez concluida la desinfección, los frondes fueron enjuagados tres veces con agua destilada estéril en cabina de flujo laminar y se prosiguió a colocar las esporas sobre el medio de cultivo. Para esto con la ayuda de una pinza se mantuvo el fronde en forma vertical y se realizó un raspado con un bisturí en el área donde se encontraban los soros. De esta forma se depositaron homogéneamente las esporas en un medio de cultivo propuesto por Somer et al. (2010).
A los 10 días se cuantificó el número de frascos libres de contaminantes microbianos visibles (hongos, levaduras y bacterias) y se calculó el porcentaje de contaminación microbiana.
La germinación de las esporas fue evaluada a los 90 días a través del Índice de Germinación de las esporas (IG). Este se obtuvo de manera indirecta de acuerdo con el grado de cobertura de los gametofitos, usando una estimación porcentual subjetiva, adaptación de la escala de abundancia-cobertura de Braun-Blanquet (Mermoz y Martín, 1993 modificada por Ramírez et al., 2000); la cual considera la cobertura de los gametofitos desarrollados, como un indicativo de germinación de las esporas.
La escala fue la siguiente:
0= Sin germinación.
1= Numerosos gametofitos cubrieron 5% de la superficie del medio de cultivo.
2= Cualquier número de gametofitos con cobertura entre 5 y 25%.
3= Cualquier número de gametofitos con cobertura entre 25 y 50%.
4= Cualquier número de gametofitos con cobertura entre 50 y 75%.
5= Cualquier número de gametofitos con cobertura mayor de 75%.
Formación de gametofitos secundarios
De los gametofitos formados (prótalos) se seccionaron pequeños segmentos de 0.5 cm de diámetro y se colocaron en medios de cultivo que contenían diferentes concentraciones de las sales MS (0, 25, 50, 75, 100%), tiamina 1mg l-1 y sacarosa 2%.
A los 60 días de cultivo se determinóla masa fresca (g) de los explantes. Estos se subcultivaron de la misma forma que se explicó inicialmente durante cuatro subcultivos cada 60 días en el medio de cultivo seleccionado anteriormente. A los 240 días de cultivo se cuantificó el número de esporofitos formados por explante.
Se utilizaron 10 frascos por tratamiento y en cada frasco de cultivo se colocaron diez explantes.
Multiplicación de esporofitos
Con el objetivo
de determinar el efecto del estado físico del medio sobre el
crecimiento y la multiplicación de los esporfitos, estos fueron separados en grupos de dos o tres y se colocaron
en tubos de ensayo en un medio de cultivo compuesto por las sales MS al 50%,
tiamina 2mg l-1 y sacarosa 2%. Se determinó el efecto del estado físico
del medio sobre el crecimiento y la multiplicación de los esporfitos.
Los explantes
fueron colocados en medio de cultivo líquido con soporte de papel de
filtro y en medio de cultivo semisólido. Como agente gelificante se utilizó
agar BioCen a razón de 7.0 g l-1. Los explantes fueron colocados en cámara de crecimiento
de luz solar a 27± 2°C y un fotoperíodo de aproximadamente
13/11h de luz/oscuridad con un rango de intensidad luminosa entre 23.2 y 44.5
µmol.m-2.s-1 medido con un luxómetro EXTECH
Light meter 401 025.
A los 45 días de cultivo se cuantificó el número de esporofitos formados por explante y se midióla longitud de las frondas (cm).
Para analizar los datos experimentales se realizaron pruebas paramétricas y no paramétricas previa comprobación de los supuestos de normalidad, utilizando el paquete estadístico SPSS versión 18.0 sobre Windows. Las pruebas realizadas se especifican en los resultados de cada experimento. Se emplearon 20 tubos de cultivo por tratamiento.
RESULTADOS Y DISCUSIÓN
Germinación in vitro de esporas
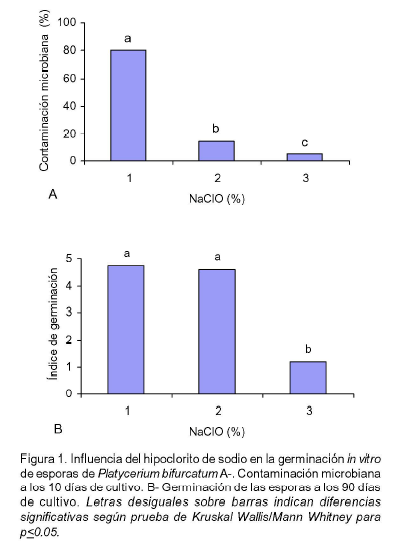
La concentración de hipoclorito de sodio influyó significativamente sobre el porcentaje de contaminación microbiana del material vegetal. Los valores fueron superiores cuando se utilizó la concentración más baja (1%) del desinfectante (Figura 1A).
Para lograr la desinfección de las esporas en los helechos se ha utilizado principalmente hipoclorito de sodio a diferentes concentraciones desde el 0.875% al 2% de cloro activo, con tiempos de exposición de 3 a 30 minutos. Además, se ha combinado con el uso de etanol, Tween 20, Tween 80, Tritón X-100®, estreptomicina y algunos fungicidas (Cox et al., 2003; Naour, 2004; Díaz, 2007). En el presente trabajo solo con el empleo del hipoclorito de sodio se logró la desinfección del material vegetal.
A los 60 días de estar las esporas dispersas en el medio de cultivo (Figura 2A) se comenzó a observar su germinación y ya a los 90 días existía abundante tejido gametofítico (Figura 2B). La concentración de desinfectante empleada tuvo influencia en la variable germinación de las esporas. Con 3% disminuyó el índice de germinación de las esporas (Figura 1B). Similares resultados obtuvieron Evangelista et al. (2001).

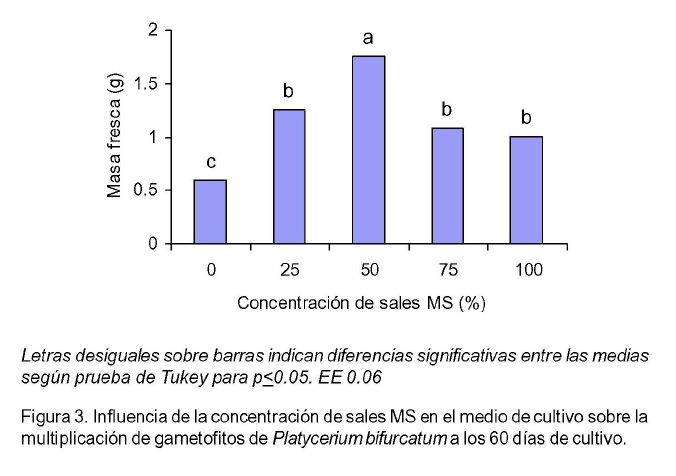
A los 60 días de cultivo se evidenció en los explantes abundante tejido gametofítico (Figura 2 C). El contenido de sales MS en los medios de cultivo influyó significativamente en la obtención de la gametogénesis secundaria. Cuando fue añadido al medio de cultivo el 50% de las sales MS se observó una mayor masa fresca de los explantes como un índice de la multiplicación de los prótalos y se comprobaron diferencias significativas con el resto de los tratamientos (Figura 3).
La consistencia crasa de los tejidos y en cierta forma el hábito epifito y ambiente pobre en nutrimentos donde crece la especie en forma natural puede ser el motivo de que en los tratamientos con menor concentración de sales MS se generara el mayor número de prótalos.
Indistintamente en la literatura científica se ha utilizado para la multiplicación in vitro de plantas de helechos de diferentes géneros el medio de cultivo MS con el 100% de sales o menos (Juntadach, 1996; Cox et al., 2003; Fernández y Revilla, 2003).
Contrario a estos resultados Díaz (2007) no observó germinación de las esporas de Adiantum y Asplenium (otros géneros de helechos) cuando utilizó hipoclorito de sodio y sí con el tratamiento que contenía etanol al 70%. Este autor refiere que conjuntamente con la solución de hipoclorito se utilizaron en cada tratamiento diferentes manejos como raspados y maceración de los esporangios, centrifugación de las esporas, pretratamiento con altas temperaturas, lo que pudo haber influido en los resultados. El manejo de los explantes realizado durante la desinfección de las esporas en este trabajo fue muy simple y pudo haber influido en el índice de germinación obtenido.
En el presente estudio se definió que con 2% de hipoclorito de sodio y 15 minutos de exposición se logró disminuir la contaminación microbiana (15%) y no se afectó la germinación de las esporas.
Formación de gametofitos secundarios
El crecimiento
lento de los explantes en condiciones in vitro fue muy similar al manifestado
por la especie en condiciones naturales. En los primeros 30 días de cultivo
los explantes se tornaron de una coloración verde oscuro y no se observaron
indicios de crecimiento, ni multiplicación. Más tarde, los explantes comenzaron a multiplicarse y se observó
un crecimiento siempre en forma circular y con una invaginación en la
parte inferior donde estaba en contacto con el medio de cultivo. Similares resultados
obtuvo Aspira (2010) en P. coronarium y P. grande donde la formación
de gametofitos secundarios se evidenció a los 42 y 49 días de
cultivo, respectivamente.
Díaz (2007)
encontró que el mejor tratamiento para la obtención de los prótalos
fue el medio de cultivo MS con el 50% de la concentración de las sales y sin suplemento de
carbohidratos. En cuanto a la coloración describió que en este
medio de cultivo se obtuvieron los gametofitos más verdes y concluyó
que estas condiciones posiblemente fueron ideales para que los gametofitos realizaran
una eficiente fotosíntesis para producir su fuente de carbono. En el
presente trabajo la coloración verde intensa se observó en todos
los tratamientos ensayados y se definió como verde bosque (#228B22) según
el código hexadecimal de colores (http://www. cwp.linet.edu/cwis/cwp.html).
A los 180 días de estar los prótalos multiplicándose en el medio de cultivo MS con el 50% de las sales se comenzaron a formar los esporofitos. Ya a los 240 días todos los explantes habían formado como promedio 27.6 esporofitos (Figura 2 D). Similares resultados en número de esporofitos pero a partir de un explante inicial diferente fueron obtenidos por Liao y Wu (2011) en esta especie. Estos autores cuantificaron como promedio 25 esporofitos a partir de una yema adventicia formada a partir de hojas. Por el contrario, Rosna et al. (2011) solo lograron la regeneración de esporofitos en un medio de cultivo que contenía ácido giberélico (1-15 mg l-1).
Por otra parte, Aspiras (2010) en P. coronarium y P. grande no lograron formar esporofitos cuando utilizaron el medio de cultivo Knudson C, mientras que cuando los gametofitos fueron transferidos a macetas con una mezcla de suelo de jardín y raíces cortadas de Cyathea spp. se lograron altos porcentajes de formación de esporofitos. Estos se comenzaron a formar a los 60 días de haberlos colocado en el sustrato.
Juntadach (1996) informó que desde que las esporas germinaron hasta la formación de los esporofitos jóvenes se tardó 440 días. Sin embargo, Pérez et al. (2010) refirieron que 300 días después que las esporas fueron colocadas en el medio de cultivo no se habían desarrollado los esporofitos. En el presente trabajo ya a los 270 días de cultivo se comenzaron a formar los primeros esporofitos.
Multiplicación de esporofitos
A los 45 días de cultivo los esporofitos se habían multiplicado y se tornaban de una coloración verde intensa (Figura 2 E).
Se encontró que no existieron diferencias significativas para el número de esporofitos formados y para la longitud de las frondas en los dos tratamientos (medio de cultivo semisólido y líquido). Este resultado posibilita seleccionar el medio de cultivo líquido para la multiplicación de los esporofitos, lo que conlleva a una disminución de los costos del medio de cultivo por no utilizar agente gelificante. Similares resultados fueron obtenidos por Teng y Teng (2000) al estudiar pulsos de antibióticos en la regeneración in vitro de esporofitos en esta especie.
CONCLUSIONES
Se logró la formación de esporofitos de P. bifurcatum a partir de esporas germinadas in vitro. El NaClO influyó en la desinfección y germinación de las esporas. La concentración de las sales MS fue un factor determinante en la formación de gametofitos secundarios y esporofitos. El estado físico del medio de cultivo no influenció la formación de los esporofitos, estos se formaron en similar cuantía en medios de cultivos líquido y semisólido.
REFERENCIAS
Ambrozic-Dolinsek, JM, Camloh B, Bohanec B, Zel I (2002) Apospory in leaf culture of staghorn fern (Platycerium bifurcatum). Plant Cell Report 20: 791-796
Ambrozic-Dolinsek, JM, Camloh M (1997) Gametophytic and sporophytic regeneration from bud scales of the fern Platycerium bifurcatum (Cav.) C.Chr. in vitro. Annals of Botany 80: 23-28
Amoroso, CB, Amoroso VB (2003) Plantlet production of the Philippine giant staghorn fern (Platycerium grande (Fee) C. Presl.) through spore culture. En: Chandra, S, Srivastara H (Eds) Pteridology in the New Millennium, pp. 491-495. Kluwer Academic Publishers. Dordrecht
Aspiras, RA (2010) Sporophyte and gametophyte development of Platycerium coronarium (Koenig) Desv. and P. grande (Fee) C.Presl. (Polypodiaceae) through in vitro propagation. Saudi Journal of Biological Sciences 17: 13-22
Camloh, M (1999) Spore age and sterilization affects germination and early gametophyte development of Platycerium bifurcatum. Annual Fern Journal 89: 124-132
Camloh, M, Gogala N, Rode J (1994) Plant regeneration from leaf explants of the fern Platycerium bifurcatum in vitro. Science Horticulturae 56:257-266
Camloh, M, Ambrozic-Dolinsek J (2011) In vitro regeneration systems of Platycerium. En: Fernández H (Ed). Working with Ferns. Issues and Applications, pp. 111-127. Springer Science. New York
Chen, J, Henny RJ, McConnell DB, Nell TA (2001) Cultivar differences in interior performances of acclimatized foliage plants. Acta Horticulturae 543:135-140
Chen, J, Henny RJ (2008) Role of micropropagation in the development of ornamental foliage plant industry. En: Teixeira da Silva, JA (Ed.) Floriculture, Ornamental and Plant Biotechnology, Volume V, pp. 206-218. Global Science Books, London
Cox, J, Bhatia P, Ashwath N (2003) In vitro spore germination of the fern Schizaea dichotoma. Scientia Horticulturae 97: 369-378
Darnaedi, D, Praptosuwiryo, TN (2006) Platycerium bifurcatum. En: Kreier H, Schneider H (Eds). Phylogeny and Biogeography of the Staghorn Fern Genus Platycerium (Polypodiaceae, Polypodiidae). American Journal of Botany 93 (2): 217-218
Díaz, JA (2007) Estudio exploratorio para el establecimiento del cultivo in vitro de especies de helechos silvestres con potencial ornamental. Tesis para obtener el grado de Maestro en Ciencias en Desarrollo de Productos Bióticos. Instituto Politécnico Nacional Yautepec, Morelos México p. 81
Evangelista, S, Escobar S, Trejo G, Jiménez A (2001) Propagación in vitro de Platycerium bifurcatum. Memorias del IX Congreso Nacional de Biotecnología y Bioingeniería, XIII Congreso Nacional de Ingeniería Bioquímica y II Congreso Internacional de Ingeniería Bioquímica. 10-14 de Septiembre del 2001. Veracruz. México
Evangelista, S, Escobar S, Del Villar M, Jiménez A (2003) Propagación in vitro en forma apospórica de Platycerium bifurcatum.Proc.Interamer. Soc. Trop. Hort. 47:7-8
Fernández, H, Revilla MA (2003) In vitro culture of ornamental ferns. Plant Cell Tissue and Organ Culture 73: 1-13
Gómez Llaca, J, Páez de Casares J (2013) Obtención de gametófitos y esporófitos del helecho Cacho de venado (Platycerium bifurcatum (Cav.)C. Chr.) a partir de esporas. ERNSTIA 23 (1): 1-13
Hartman, H, Kester D (1994) Propagación de plantas, principios y prácticas. Tercera reimpresión de la segunda edición. Editorial Continental. México. 759 p.
Hennen, GR, Sheehan TJ (1978) In vitro propagation of Platycerium stemaria (Beauvois) Desv. Hort Science 13: 245
Huang, ZY (2004) Study on tissue culture of Platycerium bifurcatum Journal Biology 21: 22-24
Juntadach, S (1996) Studies on spore culture of fern (Platycerium coronarium and Asplenium nidus) in agar medium. Sonklana Karin Journal of Science and Technology 18(3): 275-286
Kwa, SH, Wee YC, Lim TM y Kumar PP (1997) Morphogenetic plasticity of callus reinitiation from cell suspension cultures of the fern Platycerium coronarium. Plant Cell Tissue and Organ Culture 48:37-44
Liao, YK, Wu YH (2011) In vitro propagation of Platycerium bifurcatum (Cav.) C. Chr. Via green globular body initiation. Botanical Studies 52: 455-463
Pérez, BG, Mondoza-Ruiz A, Espinosa-Matias S, Gómez-Pignataron ( 2010) Gametophyte morphology of Platycerium andinum Baker and Platycerium wandae Raoif. Micron 41(7): 806-813
Ramírez, MR, Pérez GB, Riba R (2000) El suelo, un banco natural de esporas y helechos. Contacto S 36: 15-18
Rosna, M, Noorma WH, Sharifah NW (2011) Morphological and Tissue Culture Studies of Platycerium coronarium, a rare ornamental Fern Species from Malaysia. American Fern Journal 101 (4): 241-251
Somer, M, Abresu R, Menendez V, Revilla M (2010) Sporophyte induction Studies in ferns in vitro. Euphytica 171: 203-210
Teng, WL, Teng MC (1997) In vitro regeneration patterns of Platycerium bifurcatum leaf cell suspension culture. Plant Cell Report 16: 820-824
Teng, WL, Teng MC (2000) The impact a pulse treatment of penicillin-G and streptomycin sulfate on sporophyte regeneration of Platycerium bifurcatum. Plant Cell Reports 19: 345-350
Wee, YC Kwa SH, Loh CS (1992) Production of sporophytes from Platycerium coronarium and P. Ridleyi frond strips and rhizome pieces cultured in vitro. American Fern Journal 82: 75-79
Recibido: 19-2-2013
Aceptado: 28-3-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
