ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN
1609-1841, RNPS: 0397 (Versión impresa)
Formación de embriones somáticos en Hyeronima alchorneoides Allemao a partir de embriones cigóticos
Somatic embryos formation in Hyeronima alchorneoides Allemao from zygotic embryos
Lissete Valverde-Cerdas, Alejandra Rojas-Vargas, Ana Hine-Gómez, José Azofeifa-Bolaños
Instituto de Investigación y Servicios Forestales, Universidad Nacional, Apartado postal 86-3000, Heredia, Costa Rica. E-mail: alejandra.rojas.vargas@una.cr
RESUMEN
En Costa Rica, Hyeronima alchorneoides (pilón) es considerada una especie forestal de rápido crecimiento y con un alto valor ecológico y económico. Sin embargo, presenta problemas de almacenamiento por poseer semilla recalcitrante y es atacada por una avispa (Erytoma sp.) que se alimenta del embrión, lo que disminuye considerablemente la producción de semilla viable. La embriogénesis somática puede ser una alternativa para solucionar estas problemáticas. El objetivo de la investigación fue formar embriones somáticos de pilón a partir de embriones cigóticos. Se empleó como material vegetal embriones cigóticos aislados de semillas de pilón. Para la formación de callos, los embriones fueron colocados en frascos con medio de cultivo MS que contenía 6-BAP, ANA y 2,4-D en diferentes concentraciones y combinaciones y un control libre de reguladores de crecimiento. Se logró la mejor respuesta en la formación de embriones somáticos después de 60 días de cultivo en el medio de cultivo MS con 2.68 ìM ANA y la combinación de 9.05 ìM de 2,4-D y 1.34 ìM ANA. La maduración, germinación y conversión de los embriones somáticos se obtuvo en un medio de cultivo MS libre de reguladores de crecimiento en condición de luz.
Palabras clave: callo, histología, pilón
ABSTRACT
In Costa Rica, Hyeronima alchorneoides (Pilon) is considered a fast-growing tree species with high ecological and economic value. However, it presents problems have recalcitrant seed storage and is attacked by a wasp (Erytoma sp.) That feeds the embryo, which significantly decreases the production of viable seed. Somatic embryogenesis can be an alternative to solve these problems. The objective of the research was to form pylon somatic embryos from zygotic embryos. It was used pylon zygotic embryos isolated from seeds as plant material. For callus formation, embryos were placed in flasks with culture medium MS containing 6-BAP, NAA and 2,4-D in different concentrations and combinations, and a control free of growth regulators. The best response was achieved in the formation of somatic embryos after 60 days of culture in the culture medium MS with 2.68 ìM ANA and the combination of 9.05 ìM 2,4-D and 1.34 ìM NAA, which after 120 days of culture. Maturation, germination and conversion of somatic embryos were obtained on a MS medium free of growth regulators in light condition.
Key words: callus, histology, pilon
INTRODUCCIÓN
El pilón (Hyeronima alchorneoides Allemao) pertenece a la familia Euphorbiaceae. Se distribuye naturalmente desde el sur de México y Belice por la costa del Atlántico hasta Panamá, y se extiende a las islas del Caribe y en Suramérica desde Colombia hasta Brasil y Perú. Es un árbol abundante en el bosque húmedo tropical y muy húmedo. En Costa Rica se le puede encontrar en las dos vertientes, específicamente en los bosques lluviosos de las zonas bajas del Norte y del Atlántico, a altitudes de 0 a 800 msnm, con precipitaciones de 2000 a 5000 mm año-1 y 24 a 32ºC. Experiencias de reforestación indican que se adapta bien a las zonas del Pacífico Central y Sur (Montero et al., 2007).
La madera madura de pilón es de gran valor y tiene alta demanda debido a su versatilidad, densidad y durabilidad. Se utiliza para la elaboración de productos de ebanistería, construcción, puentes, pisos, carrocerías, soportes, postes, barriles para sólidos, durmientes de ferrocarril y barcos (OFI y CATIE, 2003; Montero et al., 2007).
En Costa Rica, el pilón ha tomado mucha importancia como una especie forestal nativa de rápido crecimiento y con un alto valor ecológico y económico. Por lo anterior, se han desarrollado investigaciones sobre la localización de árboles semilleros que han sido empleados en estudios sobre material genético para el establecimiento de plantaciones (Vásquez et al., 2005; Montero et al., 2007).
El árbol de pilón produce semilla que se caracteriza por su sensibilidad a la deshidratación (recalcitrante). Experiencias previas han demostrado que una semana después de su cosecha, este material vegetal pierde hasta 50% de viabilidad cuando se almacena a 5ºC y aún más en condiciones ambientales. Además, las semillas se ven afectadas seriamente por el ataque de la larva de una avispa de la familia Eurytomidae, la cual se introduce dentro de la semilla y se alimenta del tejido del embrión, en consecuencia afecta seriamente las cosechas e imposibilita la obtención de semilla viable (Valverde, 2000; Abdelnour et al., 2007).
Por lo anterior, y con el fin de brindar una solución a la poca disponibilidad de semilla, se presenta la embriogénesis somática como una alternativa de propagación de la especie. Es considerada como el mejor método para la propagación vegetativa de especies leñosas, debido a la naturaleza bipolar del embrión somático, la facilidad con que se puede automatizar el proceso productivo, los altos coeficientes de multiplicación en períodos cortos de tiempo y por la posibilidad de encapsular éstas estructuras y obtener semilla artificial (Kosky, 1998; Carneros et al., 2009).
El objetivo de este trabajo fue formar embriones somáticos de Hyeronima alchorneoides a partir de embriones cigóticos.
MATERIALES Y MÉTODOS
La presente investigación se llevó a cabo en el Laboratorio de Cultivo de Tejidos Vegetales del Instituto de Investigación y Servicios Forestales (INISEFOR) de la Universidad Nacional, Costa Rica.
Material vegetal
El material experimental consistió de embriones cigóticos aislados de semillas extraídas de frutos de pilón donados por la empresa Semillas Forestales del Sur, las cuales fueron colectadas de árboles de 20 a 25 m de altura en los alrededores de Volcán de Buenos Aires, Puntarenas, entre 600 y 700 msnm (Figura 1A).
Embriogénesis somática
Para la desinfección de las semillas se utilizó la metodología descrita por Valverde (2000) y Abdelnour et al. (2011) que se describe brevemente. En cámara de flujo laminar se extrajeron los embriones con ayuda de un estereoscopio (Figura 1B). Para la formación de callos, los embriones fueron colocados en frascos con medio de cultivo propuesto por Murashige y Skoog (MS) (Murashige y Skoog, 1962) complementado con 3% de sacarosa y solidificado con 2.7g l-1 de PhytagelTM que contenía 6-Bencilaminopurina (6-BAP), ácido á-naftalenacético (ANA) y ácido 2,4- diclorofenoxiacético (2,4-D) en diferentes concentraciones y combinaciones para un total de 20 tratamientos y un control libre de reguladores de crecimiento (Tabla 1). El medio de cultivo se distribuyó en un diseño completamente al azar. El pH del medio de cultivo se ajustó a 5.7 antes de la esterilización por autoclave (21 ºC, 15 m-1 kg s-2 de presión, 25 minutos). Cada unidad experimental consistió de cinco embriones cigóticos cultivados en 20 ml de medio de cultivo, contenido en frascos de cultivo (tipo alimento para bebé de 100 ml de capacidad). Cada tratamiento contó con 25 repeticiones.
Para la formación de callo con estructuras embriogénicas, los embriones cigóticos se mantuvieron a 28 ± 2°C en oscuridad. Después de 60 días de cultivo, los callos de cada tratamiento se cultivaron en un medio de cultivo MS sin reguladores de crecimiento, con el fin de lograr la maduración y germinación de los embriones somáticos (ES). Finalmente, los ES se separaron del callo en estadios de corazón y torpedo y se colocaron en el cuarto de crecimiento a un fotoperíodo de 16 horas luz y 24. 2 µmol m-2s-1 de intensidad lumínica.


Las variables evaluadas cada 30 días de cultivo y durante 120 días
fueron: formación de callo (FC) (%) [(número de explante con callo
/total de explantes)*100]; formación de callo con estructuras embriogénicas
(FCE) (%) [(número de explante con callo/total de explantes)*100] y número
de embriones somáticos por callo (#ES).
Los datos obtenidos fueron sometidos a un análisis de varianza y analizados con el programa estadístico Infostat (Di Rienzo et al., 2008), y para evaluar la significancia estadística (p<0.05), se aplicó la Prueba de Tukey de diferencia entre medias.
Histología
Se realizaron cortes histológicos a callos embriogénicos inducidos en oscuridad (4.52 µM de 2,4-D; tratamiento 10) y a callos embriogénicos del mismo tratamiento bajo condiciones de luz; en la cual se estaba dando la diferenciación de los embriones somáticos. Se realizó el análisis histológico en este tratamiento porque fue donde mayor número de callos embriogénicos se obtuvieron.
Para la fijación y procesamiento del tejido, los callos se sumergieron en una solución de formaldehído al 10 y 4% durante 24 horas y 1 hora, respectivamente. Posteriormente, la muestra se deshidrató sumergiendo el tejido en concentraciones de alcohol etílico (95 y 100% sucesivamente, cada tres horas) y en xilol por 1 hora.
Se utilizó el método de inclusión en parafina para la etapa de seccionamiento serial. El material vegetal enclaustrado en la solución de inclusión se cortó en secciones de aproximadamente 5 ìM de grosor con un micrótomo (American Optical Corporation). Estas secciones se colocaron en un baño maría a 50ºC, luego los cortes se montaron sobre la superficie de un portaobjetos y se incubaron en un horno a 50ºC durante 25 minutos para fijar la muestra al portaobjetos. Posteriormente, los tejidos se rehidrataron de la siguiente manera: dos series de xilol durante 3 minutos, dos series de alcohol 100% durante 2 minutos y dos series de alcohol 95% durante 2 minutos.
Seguidamente, los tejidos se lavaron con agua de grifo. Una vez realizado este proceso, los cortes se tiñeron con la técnica de hematoxilina alumínica de Harris por 11 minutos. Luego, se expusieron por unos segundos al alcohol ácido (alcohol 70% y ácido sulfúrico concentrado) y durante 5 segundos en carbonato de litio. Después de cada proceso los cortes se lavaron suavemente con agua del grifo.
Seguidamente, los cortes se expusieron 5 minutos en eosina y se lavaron con agua del grifo suavemente. Finalmente, el proceso llevado a cabo consistió en la exposición de los cortes a dos series de alcohol 95 y 100% por 5 segundos, respectivamente y tres series de xilol por 3 minutos. Los cortes se sellaron con un cubreobjetos y como resina se utilizó barniz para uñas. Se observaron los cortes histológicos en un microscopio Olympus BX50 y las imágenes se digitalizaron a 100x con una cámara Nikon DS-Fi1 adaptada al microscopio.
RESULTADOS Y DISCUSIÓN
Por lo general, en la mayoría de los tratamientos establecidos después de 22 días de cultivo se iniciaron cambios en los cotiledones del embrión cigótico. Los cotiledones se abrieron, se hidrataron y se tornaron de una tonalidad amarillenta. Además, se observó la formación de una fina capa de células que presentó un color blanco traslúcido, sobre el borde externo de los cotiledones. Entre los 40 y 60 días de cultivo se observó la formación de callo embriogénico en algunos de los tratamientos con embriones somáticos (ES) en diferentes etapas de desarrollo dentro del mismo callo (Figura 2).
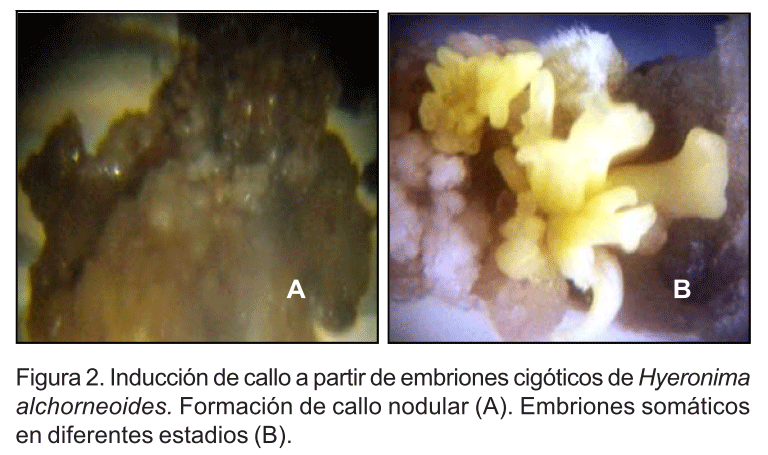
En los tratamientos 1, 2, 4, 6 ,7 8, los cuales consistían del empleo de ANA solo o la combinación de ANA/BAP, solo fue posible la formación de callo nodular (Figura 2A). En la mayoría de los casos, este callo presentaba un color café claro y con textura mucilaginosa (Figura 2A). Sin embargo, en el tratamiento 3, el cual utilizó solo una concentración de ANA (2.68 µM ANA) se logró un 12% de callo con estructuras embriogénicas (Figura 2B) con 254 ES, luego de 120 días de cultivo. Por otro lado, los tratamientos que emplearon la combinación ANA/BAP, solamente el tratamiento 5 (11.09 µM BAP + 1.34 µM ANA) formó callo con estructuras embriogénicas y embriones somáticos. En este tratamiento se obtuvo después de los 120 días de cultivo 8% de formación de callo con estructuras embriogénicas y un número de 15 ES.
Por otro lado, en la mayoría de los tratamientos donde se empleó 2,4-D solo o la combinación de 2,4-D/ANA (tratamientos 9, 10, 11, 12, 13, 14, 15 16, 17 y 20), fue posible inducir la formación de callo y formación de embriones somáticos. Los resultados obtenidos en pilón (Tabla 2) confirman la utilidad del 2,4-D para la inducción de ES en una especie leñosa al utilizar embriones cigóticos como explante inicial. Estos resultados concuerdan con los encontrados en otras especies vegetales, entre estas: Rosa bourboniana (Kaur et al., 2006), Hardwickia binata (Chand y Singh, 2001), Kalopanax pictus (Moon et al., 2005) y Bixa orellana (Paiva et al., 2003). Yeung y Thorpe (2005), confirmaron que el 2,4-D es un regulador de crecimiento ampliamente utilizado para la inducción de la embriogénesis somática.
Por otro lado, en los tratamientos 18 y 19 no hubo respuesta en la inducción de callo, ni formación de ES, lo cual se podría inferir a partir de las conclusiones de Fehér et al. (2003), el cual definió que el 2,4-D por encima de cierta concentración tiene un doble efecto, bien sea que actúe como auxina de forma directa o indirectamente a través del metabolismo endógeno del Ácido Indol Acético (AIA) o como un factor de estrés debido a su actividad fitotóxica como herbicida. Aún así, su efecto adverso no podría atribuirse simplemente a una sobredosis auxínica, pues se ha sugerido que su acción afecta patrones eléctricos, permeabilidad de la membrana, unión de AIA a ciertas proteínas de unión auxínica y la interacción en la síntesis de etileno y ácido abscísico, incrementando los niveles celulares de estas hormonas (Fehér et al., 2003).
A los a 60 días de cultivo en oscuridad, los ES no mostraron sincronía en el desarrollo, dentro de un mismo callo y un mismo tratamiento (Figura 3A). Por lo anterior, fue necesaria su transferencia a condiciones de luz para la maduración y germinación (Figura 3B). A diferencia de otros cultivos, los embriones somáticos de pilón no requirieron de un medio de cultivo específico para la maduración, ya que esta fue posible en el medio de cultivo MS sin reguladores de crecimiento (Figura 3C). De acuerdo con Thorpe (1995), el medio de cultivo MS es el más utilizado para tal fin y cuando se utiliza con una cantidad menor del regulador de crecimiento que el utilizado para la formación de callo embriogénico, o sin regulador, se favorece el desarrollo y maduración de los ES; como lo observado en este trabajo.


Estadísticamente no fue posible determinar cuál de los tratamientos fue el mejor, pues no se obtuvieron diferencias estadísticas significativas entre ellos. Desde el punto de vista numérico el tratamiento 3 (2.68 µM ANA) presentó el mayor número de ES formados, seguido del tratamiento 14 (9.05 µM 2,4-D + 1.34 µM ANA).
Los resultados de esta investigación confirman la utilidad de estas auxinas en la inducción de embriogénesis somática en dicotiledóneas leñosas (Jiménez, 2005). Con estos resultados se evidencia el efecto positivo de 2,4-D y el ANA en la formación de ES de pilón (Tabla 2). Además, la presencia de 2,4-D inhibe el crecimiento del tejido y provoca el crecimiento del callo (Kosky, 1998), lo cual según Taiz y Zeiger (2006) y George (2008), se debe a que las auxinas inducen la división celular al estimular la síntesis de la proteína kinasa dependiente de la ciclinas (CDK), encargadas de regular las diferentes fases del ciclo celular.
Además, la formación de ES es un proceso afectado por diversos factores, entre estos: el genotipo, las condiciones de cultivo, los reguladores de crecimiento y demás componentes del medio de cultivo, así como, el tipo y estado fisiológico del explante (Freire, 2003). Es probable que dichos factores afectaron la inducción de ES en pilón, a pesar de haber utilizado los reguladores de crecimiento sugeridos por la literatura científica para la formación de tejido embriogénico en otras especies forestales tropicales (Anjaneyulu et al., 2004).
Los resultados en la formación de ES pudieron ser favorecidos por el tipo de explante utilizado. El embrión cigótico de una semilla madura o inmadura es un explante muy juvenil y el más usual para la generación de tejido embriogénico; por su eficiencia embriogénica (Thorpe, 1995; Lara et al., 2003; Yeung y Thorpe, 2005). La formación de embriones somáticos a partir de embriones cigóticos en especies leñosas y forestales se han logrado con éxito en Persea americana Mill var. `Catalina' (Fajardo et al., 2005), Swietenia macrophylla King (Collado et al., 2006), Psidium guajava L. (Vilchez et al., 2002), Cedrela odorata L. (Peña et al., 2010). Sin embargo, el empleo de este tipo de explante tiene la desventaja de la heterogeneidad que resulta del cruce de la polinización, lo cual puede conducir a que en las nuevas generaciones se puedan presentar características inferiores a la de los árboles parentales (Maladabi y Van Staden, 2005).
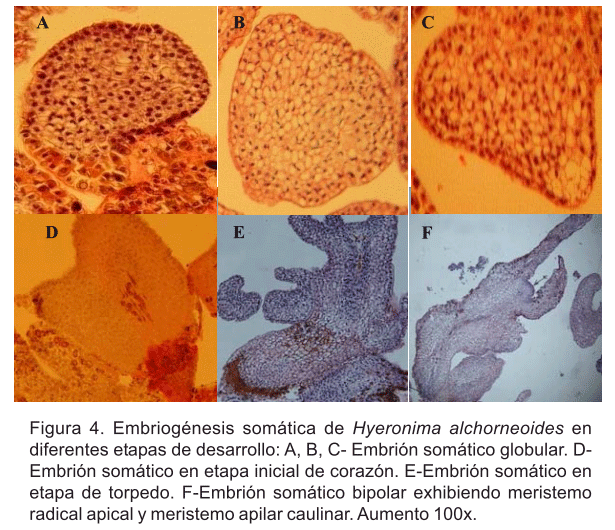
Por otra parte, los estudios histológicos revelaron que las primeras etapas de la formación de embriones somáticos en las condiciones descritas estuvieron asociadas con división celular en la superficie de la epidermis de los cotiledones. Esta actividad meristemática originó el desarrollo de estructuras globulares compuestas de pequeñas células en división con densos citoplasmas y núcleos prominentes (Figura 4A). Se observó la formación de estructuras globulares sin conexión vascular entre el embrión emergente y el tejido madre, lo anterior se evidenció aún más conforme aumentaron las divisiones celulares y ruptura del suspensor (Figura 4B y 4C).
Finalmente, se observó que en etapa globular los ES tendían a aplanarse y formar una concavidad en uno de sus lados, lo cual conducía a la etapa de corazón (Figura 4D). Posteriormente, los embriones pasaban a la etapa torpedo (Figura 4E) y finalmente a formar un embrión con su parte meristemática apical y hojas cotiledonales (Figura 4F). Lo anterior, concuerda con lo informado por Lara et al. (2003) y Thorpe (2005), los cuales mencionan que en las especies dicotiledóneas el embrión somático pasa por las mismas etapas de desarrollo de un embrión cigótico: globular, corazón y torpedo (Figura 4).
CONCLUSIONES
Se logró la formación de embriones somáticos en H. alchorneoides y es la primera vez que se informa. Esto podría ser la base para desarrollar una estrategia de propagación masiva, por ejemplo en laboratorios comerciales. Sin embargo, se requiere más investigación para realizar el proceso de escalado productivo, así como la evaluación de la estabilidad genética de las plantas que provienen de embriogénesis somática.
REFERENCIAS
Abdelnour, EA, Rojas G, Alfaro U (2007) Estudios preliminares para la crioconservación de especies forestales arbóreas. Tecnología en Marcha 20(1): 98-103
Abdelnour, A, Aguilar M, Valverde L (2011) Micropropagación de Hyeronima alchorneoides. Agronomía Costarricense 35(2): 9-19
Anjaneyulu, C, Shyankumar B, Giri C (2004) Somatic embryogenesis from callus cultures of Terminalia chebula Retz: an importan medicinal tree. Trees 18:547-552
Carneros, E, Celestino E, Klimaszewska E (2009) Plant regeneration in Stone pine (Pinus pinea L.) by somatic embryogenesis. Plant Cell Tissue Organ Culture 98: 165_178
Chand, S, Singh K (2001) Direct somatic embryogenesis from zygotic embryos of a timber-yielding leguminous tree. Hardwickia binata. Current Science 80(7): 882_887
Collado, R, Agramonte D, Jiménez F, Pérez M, Gutiérrez O (2006) Embriogénesis somática directa en Swietenia macrophylla King. Biotecnología Vegetal 6(2): 67_71
Di Rienzo, JA, Casanoves F, Balzarini MG, Gonzalez L, Tablada M, Robledo CW (2008) Infostat, Versión 2008, Grupo Infostat, Universidad Nacional de Córdoba, Argentina
Fajardo, L, Freire M, García Y, Argentel L (2005) Formación de embriones somáticos en Persea americana Mill var. Catalina a partir de embriones cigóticos inmaduros. Biotecnología Vegetal 5(2) 103-107
Fehér, A, Pasternak TP, Dudits D (2003) Transition of somatic plant cells to an embryogenic state. Plant Cell Tissue and Organ Culture 74(3): 201_228
Freire, M (2003) Aspectos básicos de la embriogénesis somática. Biotecnología Vegetal 3 (4): 195-210
George, EF, Hall MA, De Klerk G (2008) Plant Propagation by Tissue Culture. 3ra Ed. p 335-354. Springer. Berlin
Jiménez, VM (2005) Involvement of Plant Hormones and Plant Growth Regulators on in vitro somatic embryogenesis. Plant Growth Regular 47(2-3): 91_110
Kaur, N, Kumar Pati P, Sharma M, Ahuja PS (2006) Somatic embryogenesis from immature Zygotic Embryos of Rosa bourboniana Desp. In Vitro Cellular & Developmental Biology - Plant 42(2): 124_127
Kosky, RG (1998) Embriogénesis somática. En: Pérez, J N (Ed.). Propagación y mejora genética de plantas por biotecnología. pp. 57-79. IBP, Santa Clara
Lara, A, Valverde R, Gómez L (2003) Histología de embriones somáticos y brotes adventicios inducidos en hojas de Psychotria acuminata. Agronomía Costarricense 27(1): 37-48
Malabadi, R, Van Staden J (2005) Somatic embryogenesis from vegetative shoot apices mature tres of Pinus patula. Tree Physiology 25: 11-16
Moon, HK, Kim YW,
Lee JS, Choi YE (2005) Micropropagation of Kalopanax pictus tree via
somatic
embryogenesis. In Vitro Cellular & Developmental Biology Plant 41(3):
303_306
Montero, M, De los Santos H, Kanninen M (2007) Hyeronima alchorneoides: ecología y silvicultura en Costa Rica. Turrialba, CR, CATIE. 50 p.
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497
OFI (Oxford Forestry Institute, UK)/CATIE (Centro Agronómico Tropical de Investigación y Enseñanza, CR) (2003) Árboles de Centroamérica: un manual para extensionistas. UK
Paiva Neto, VB, Botelho MN, Aguiar R, Silva EAM, Otoni WC (2003) Somatic embryogenesis from immature zygotic embryos of annatto (Bixa orellana L.). In Vitro Cellular & Developmental Biology Plant 39(6): 629_634
Peña, Y, García I, Hernández A, Domínguez A, Barredo F, González J, Robert M (2011) Induction of somatic embryogenesis and plant regeneration in the tropical timber tree Spanish red cedar [Cedrela odorata L. (Meliaceae)]. Plant Cell, Tissue and Organ Culture 105 (2): 203_209
Thorpe, T (1995) In vitro embryogenesis in plants. Kluwer Academic Publishers. Dordrecht
Valverde, L (2000) Propagación in vitro del pilón (Hyeronima alchorneoides). UNICIENCIA 17:35-38
Vásquez, W, Salazar R, Thomsen KA (2005) Drying and storing Hyeronima alchorneoides fruits. En: M Sacandé, D Jøker; ME Dulloo, KA Thomsen (Eds.) Comparative storage biology of tropical tree seeds, pp. 295-301. Editorial Rome, International Plant Genetic Resources Institute (IPGRI). Rome
Vilchez, JP, Albany NR, Gómez R, García L (2002) Inducción de embriogénesis somática en Psidium guajava L a partir de embriones cigóticos. Rev. Fac. Agron 19(4): 284_293
Yeung, E, Thorpe T (2005) Somatic embryogenesis in Picea glauca. En: Jain S, Grupta P (Eds.). Protocol for somatic embryogenesis in woody plants, pp. 47-58. Springer. Berlin
Taiz, L, Zeiger, E (2006) Plant Physiology. 4th ed. Massachusetts, US, Sinauer Associates. Inc. 705p.
Recibido: 20-09-2013
Aceptado: 04-10-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
