ARTÍCULO ORIGINAL
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN
1609-1841, RNPS: 0397 (Versión impresa)
Empleo de microtubérculos de papa cv. `Andinita' obtenidos
en Sistemas de Inmersión temporal para producir minitubérculos
en casa de cultivo
Use of potato microtubers cv. `Andinita' obtained in temporary immersion systems to produce minitubers at greenhouse
Janet Igarza1,Manuel de Feria2, Yelenys Alvarado-Capó2, Tatiana Pugh3, Miguel Pérez4, Mario San Roman4, Daniel Agramonte2
1Laboratorio
de Biotecnología Vegetal (CITMA), Holguín, Cuba
2Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las
Villas. Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara. Cuba.
CP 54 830
3Escuela
Socialista de Agricultura Tropical (INIA), Maracay, Venezuela
4Laboratorio
Cultivo de Tejidos y el Campo Experimental de Mucuchíes (INIA). Mérida,
Venezuela. e-mail: mdeferia@ibp.co.cu
RESUMEN
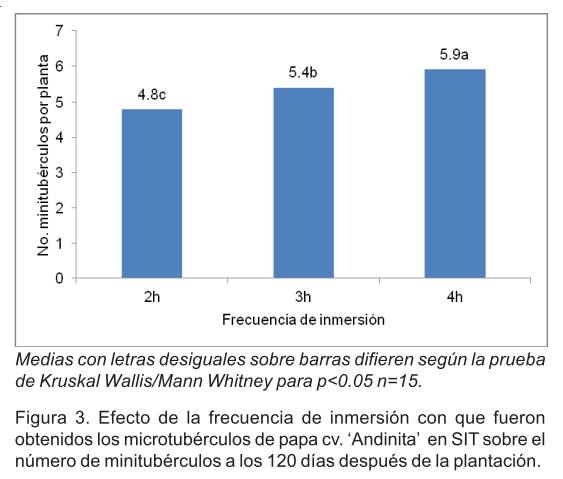
La papa (Solanum tuberosum L.), es uno de los cultivos más importantes a nivel mundial. La producción de microtubérculos en sistemas de inmersión temporal representa un salto cualitativo en la obtención de material vegetal de plantación. El presente trabajo tuvo como objetivo determinar la factibilidad del uso de microtubérculos de papa obtenidos en SIT para producir minitubérculos en casa de cultivo. Se plantaron 100 microtubérculos por tratamiento a una distancia de 5.0 x 10 cm. A los 15 días se cuantificó el número de plantas vivas, mientras que, a los 70 y 120 días de cultivo se seleccionaron 15 plantas por tratamiento y se determinó la masa fresca y seca tanto al follaje como a las raíces. Además, se evaluaron otras variables morfológicas a los 120 días. La supervivencia osciló entre 84 y 86%. Los resultados demostraron que microtubérculos de cv. `Andinita' obtenidos en SIT pueden emplearse en casa de cultivo para producir minitubérculos. La frecuencia de inmersión con que fueron obtenidos influyó sobre el número de minitubérculos por planta así como en su contenido de masa seca. Los mejores resultados se alcanzaron con los sometidos a inmersiones cada 4h. Con estos se obtuvieron 5.9 tubérculos por planta y el 70.3% se encontraba en la categoría de 10.0 a 40.0 g.
Palabras clave: minitubérculos, papa, semilla
ABSTRACT
The potato (Solanum tuberosum L.) is one of the most important crops worldwide. Production of microtubers in temporary immersion systems represents a qualitative advance in obtaining planting material. This study aimed to determine the feasibility of using potato microtubers obtained in SIT to produce minitubers in greenhouse. One hundred microtubers were planted per treatment at a distance of 5.0 x 10 cm. After 15 days, the number of live plants was quantified, while, at 70 and 120 days of culture 15 plants were selected for treatment and fresh and dry mass of foliage and root was determined. In addition, other morphological variables at 120 days were evaluated. Survival ranged between 84 and 86%. The results showed that microtubers of cv. `Andinita' obtained in SIT can be used at greenhouse to produce minitubers. The immersion frequency with which they were obtained influenced the number of minitubers per plant as well as its content of dry mass. The best results were achieved with immersion every 4h. In this treatment 5.9 minituber were obtained per plant and 70.3% of these were in the category of 10.0 to 40.0g.
Key words: minitubers, potato, seed
INTRODUCCIÓN
Mediante el cultivo in vitro de plantas de papa (Solanum tuberosum L.) se pueden obtener microtubérculos cuando estas se colocan en condiciones adecuadas (Jiménez et al., 1999; Pérez-Alonso et al., 2001). Se conoce que el diámetro y la masa fresca de los microtubérculos es importante y puede determinar su respuesta en casa de cultivo y campo (valores mínimos: > 4.0 mm, 0.5 g de masa fresca; Alvard y Teisson, 1999). Además, autores como Jiménez et al. (1999) y Pérez-Alonso et al. (2001), han informado del empleo sistemas de inmersión temporal (SIT) constituidos por dos recipientes de 10 l de capacidad (Nalgene ®) (uno para el crecimiento y tuberización de las plantas in vitro y otro como reservorio de medio de cultivo) para obtener microtubérculos de papa en los cultivares `Atlantic' y `Desirée' (Solanum tuberosum). Ellos documentaron la factibilidad de este sistema de cultivo para producir microtubérculos con características que permiten su plantación directamente en campo para obtener minitubérculos. No obstante, en aquellos trabajos que tratan la producción de microtubérculos en SIT no se encontraron referencias a su utilización para obtener minitubérculos en casa de cultivo.
La subespecie objeto de estudio Solanum tuberosum subsp. andigenum cv. `Andinita' se ha propagado in vitro (Salas, 1995) y se han obtenido microtubérculos en medio de cultivo semisólido (Mogollón et al., 2000; Lugo et al., 2009) tanto con fines investigativos como productivos. Sin embargo, el número de microtubérculos por planta ha sido bajo (1.0-1.62), así como su masa fresca (0.38 _ 0.68 g). Más adelante, Igarza et al. (2011) refirieron el uso de Sistemas de Inmersión Temporal (SIT) con tres frecuencias de inmersión, para la producción de microtubérculos de este mismo cultivar. Los resultados fueron superiores con respecto a los obtenidos previamente en medio de cultivo semisólido con un promedio entre cinco y siete microtubérculos por planta (aproximadamente 600 microtubérculos por recipiente de cultivo), con diámetros entre 4 y 16 mm y masa fresca promedio de 3g. Sin embargo, no se informó de la influencia de este sistema de cultivo en la producción de minitubérculos en casa de cultivo.
A partir de los
antecedentes mencionados, el presente estudio tuvo como objetivo determinar
la factibilidad del uso de microtubérculos de papa obtenidos en SIT
para producir minitubérculos en casa de cultivo.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon microtubérculos de papa cv. `Andinita' obtenidos en SIT de acuerdo con lo descrito por Igarza et al. (2011).
Según el procedimiento establecido en el Campo Experimental Mucuchíes para microtubérculos obtenidos en medio de cultivo semisólido (Salas, 1995), los obtenidos en SIT fueron secados al aire libre durante una semana, luego fueron sumergidos en una solución de ácido giberélico (1.0 mg l-1 de solución comercial Activol) y durante tres semanas se mantuvieron a 28°C para estimular la brotación. Al momento de la siembra todos los microtubérculos mostraron brotes de hasta 2.0 mm de longitud.
Condiciones de cultivo
La casa de cultivo estuvo ubicada en áreas exteriores del Laboratorio de Cultivo de Tejidos en el Campo Experimental Mucuchíes a 3100 msnm. Contaba con canteros de paredes de concreto de 14 m de largo, 1.0 m de ancho y 40 cm de alto (Fig. 1) y estaba cubierta con malla antiáfidos. La temperatura máxima promedio en el período fue de 17.7°C y la mínima promedio fue de 5.4°C.
Se plantaron 100 microtubérculos de cada tratamiento de forma manual a una profundidad de aproximadamente 3.0 cm (Gallardo et al., 1997). La distancia de plantación fue de 5.0 cm x 10 cm, 20 microtubérculos por surco.
El sustrato utilizado estuvo compuesto por tierra, arena y concha de arroz (2:1:1/2). El riego se realizó de forma manual por aspersión. La frecuencia de riego fue diario de noviembre a enero y cada 3 días de febrero a marzo, siempre con una duración de 20 minutos.
La fertilización y la aplicación de fungicidas se realizaron de acuerdo con el procedimiento establecido en el Campo Experimental de Mucuchíes para este tipo de cultivo.

En el caso de la fertilización esta se realizó con fórmula NPK (12:24:12) a voleo en la preparación del sustrato antes y al momento de la siembra. Durante el desarrollo vegetativo del cultivo, se aplicaron fertilizantes ricos en fósforo [HACHE UNO 2000, Butil 2 (3-5 trifluorometil-2- piridiloxi-fexoxi) propinato] y herbicida [Triazina, (4 amino-6 tert-butil-4,5 dihidro-3 metitio-1,2,4 triazin 5-ona], con una dosis de 1.0 l ha-1. La segunda aplicación de fertilizantes se realizó al momento del aporque y a los 30 días, con fertilizantes foliares (Carbovit, Hit de desarrollo).
Para el control fitosanitario se realizaron aplicaciones de fungicidas e insecticidas cada 15 días de forma preventiva según la dosis del fabricante.
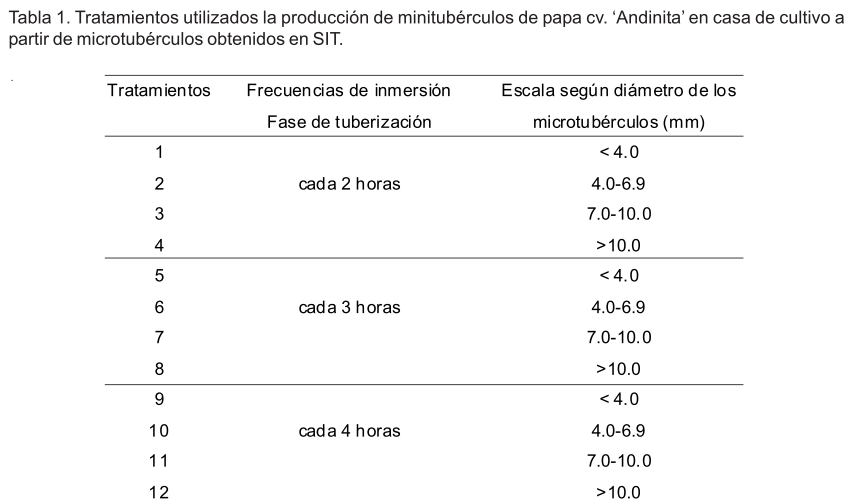
Los tratamientos se conformaron a partir de combinar las tres frecuencias de inmersión con las cuales se obtuvieron los microtubérculos en los SIT y los cuatro rangos de diámetro (calibre) utilizados para clasificar los microtubérculos (Tabla 1) para un total de 12 tratamientos.
A los 15 días de la plantación se cuantificó el número de plantas vivas y se calculó el porcentaje de supervivencia. Posteriormente, a los 70 días después de plantados los microtubérculos en casa de cultivo, se seleccionaron 15 plantas por tratamiento y se determinó la masa fresca (g), masa seca (g) y se calculó el contenido de masa seca (%), tanto a la parte aérea (follaje) como a las raíces.
Finalmente, a los 120 días se cortó el follaje de forma manual y la cosecha de los minitubérculos se realizó 14 días después (134 días). A 15 plantas por tratamiento se les midió la altura (cm), ancho y largo del tercer foliolo (cm) (del ápice hacia abajo), se determinó la masa fresca (g), masa seca (g) y el contenido de materia seca (%), tanto a la parte aérea (follaje) como a los minitubérculos.
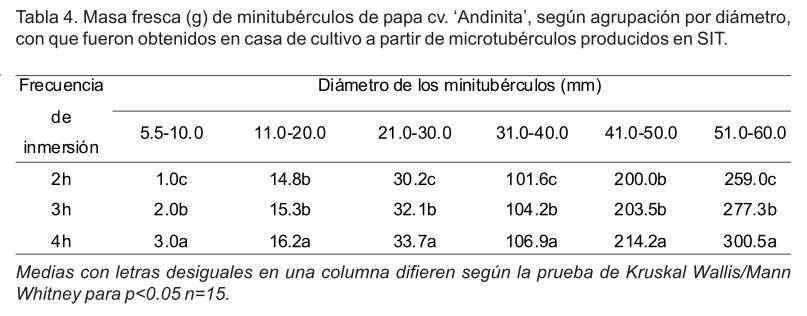
Además, se cuantificó el número de minitubérculos por planta y se midió su diámetro (cm). En base a su diámetro los minitubérculos se clasificaron en seis grupos: entre 5.0-10 mm, 11-20 mm, 21-30 mm, 31-40 mm, 41-50 mm y 51-60 mm y se determinó su masa fresca (g).
Para la determinación de masa seca las muestras se colocaron en estufa a 60°C durante tres días hasta peso constante. El contenido de masa seca se calculó mediante la fórmula:
Contenido de masa seca (%) = [masa seca (g)/masa fresca (g)] x 100.
Los datos se registraron en planillas de evaluación y luego se elaboraron bases de datos en Microsoft Excel. Para su procesamiento estadístico se empleó el paquete estadístico PASW Statistics 17 y se sometieron a pruebas de normalidad y homogeneidad de varianzas. Los datos relativos al porcentaje de supervivencia de los microtubérculos, altura de las plantas, número y masa fresca de los minitubérculos por planta se analizaron estadísticamente mediante la prueba de Kruskal Wallis. Las medias entre los tratamientos se compararon mediante la prueba de Mann Whitney.
RESULTADOS
A los 15 días de plantados los microtubérculos en la casa de cultivo no se constataron diferencias significativas en el porcentaje supervivencia entre los tratamientos y este osciló entre 84.0 _ 86.0%.
Las plantas en la casa de cultivo mostraron características morfológicas similares a las descritas in vitro en cuanto a color y presencia de los foliolos laterales secundarios en las hojas así como color y características del tallo. No se observaron plantas fuera de tipo.
Después de 70 días de realizada la plantación, no se encontraron diferencias significativas para las variables evaluadas en los tratamientos dentro de una misma frecuencia de inmersión con que fueron obtenidos los microtubérculos en SIT (diámetro de los microtubérculos), por esta razón se agruparon, analizaron y se compararon los resultados entre frecuencias.
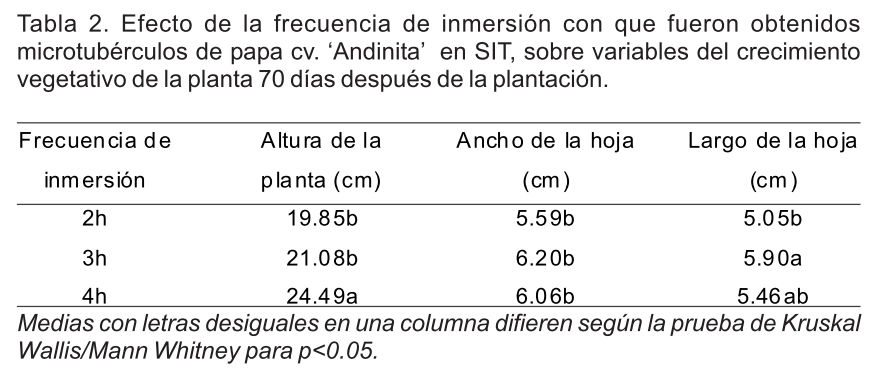
La frecuencia de inmersión con que fueron obtenidos los microtubérculos en los SIT influyó sobre la altura de las plantas y el largo de las hojas, no así en el ancho de estas (Tabla 2). En el tratamiento procedente de inmersiones cada 4h (seis inmersiones por día) se obtuvieron las plantas de mayor altura, con diferencias significativas con el resto de los tratamientos.
En todos los tratamientos se produjeron minitubérculos. Cuando se realizó la cosecha se comprobó que estos tenían características similares a las descritas por otros autores para este cultivar y, no se observaron minitubérculos con deformaciones morfológicas (Figura 2).
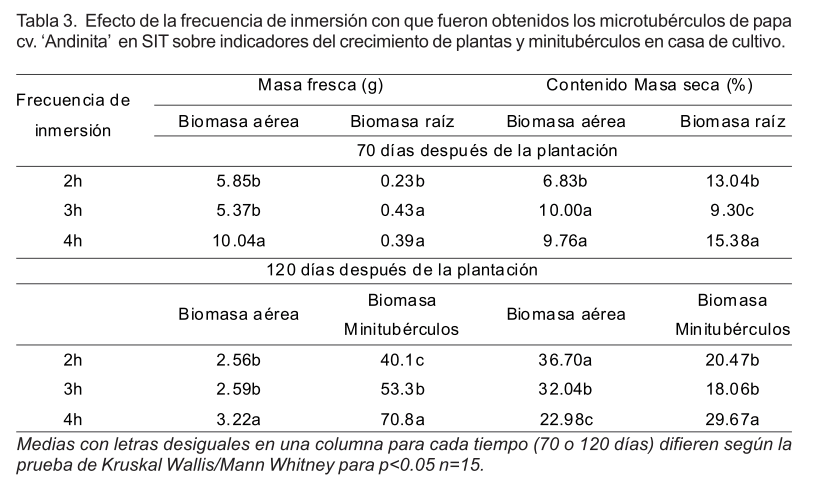
Tanto la masa fresca como el contenido de masa seca de la biomasa aérea, de las raíces y minitubérculos fueron afectados por la frecuencia de inmersión con que se obtuvieron los microtubérculos en SIT. A los 70 días después de plantados, la masa fresca de la biomasa aérea de las plantas era significativamente mayor en aquellas que se originaron de microtubérculos producidos con inmersiones cada 4h. Sin embargo, la masa fresca de la biomasa de la raíz no tuvo diferencias significativas para los obtenidos con 3h y 4h. Igualmente, el contenido de masa seca de la biomasa aérea fue superior en estos dos tratamientos. La biomasa de la zona radical fue superior en el tratamiento de inmersiones cada 4h (Tabla 3).
Después de 120 días de la plantación, tanto la masa fresca de la biomasa aérea como la de los minitubérculos fue significativamente superior en el tratamiento donde los microtubérculos fueron obtenidos con inmersiones cada 4h (etapas de crecimiento y tuberización in vitro). Sin embargo, el contenido de masa seca en la biomasa aérea fue significativamente inferior (Tabla 3).

El número de minitubérculos por planta varió significativamente entre los tratamientos. Se obtuvieron entre 3 y 12 minitubérculos por planta en casa de cultivo. Los mayores valores promedio se correspondieron con el tratamientos donde se obtuvieron microtubérculos con 4h de inmersión (5.9 minitubérculos por planta) (Figura 3).
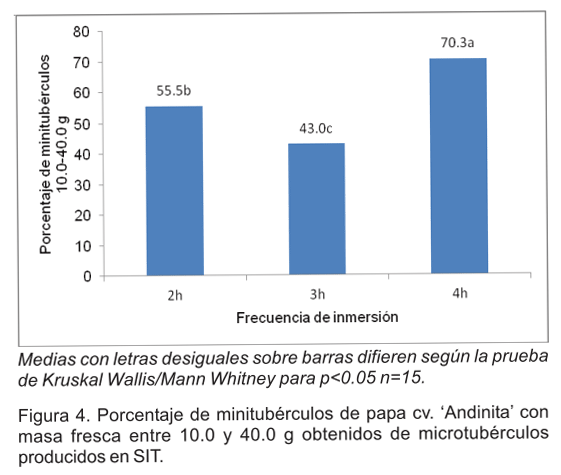
Tampoco, para la masa fresca promedio de los minitubérculos agrupados por diámetro, se encontraron diferencias significativas entre los tratamientos dentro de una misma frecuencia de inmersión. Por ello, se agruparon y analizaron en conjunto. La tabla 4 muestra los resultados donde se constató que en todos los grupos los minitubérculos obtenidos con inmersiones cada 4h alcanzaron valores de masa fresca significativamente superiores. El mayor porcentaje de minitubérculos con masa fresca entre 10.0 y 40.0 g se obtuvo en este mismo tratamiento (Figura 4).
La distribución de materia seca en la planta de papa, es un indicador de la dinámica de asignación de asimilatos a cada uno de los órganos de la planta (Ñústez et al., 2009). En este estudio, a los 70 días después de la plantación, las plantas procedentes de microtubérculos obtenidos con 4h de frecuencia de inmersión tenían ya un mayor contenido de materia seca de la raíz que de la biomasa aérea y este comportamiento se mantuvo a los 120 días después de plantados. En la primera evaluación, el contenido de materia seca en las raíces sobrepasaba el 15.0% y a los 120 días se había duplicado, con diferencias significativas con respecto a los otros dos tratamientos. Sin embargo, en las plantas procedentes de microtubérculos obtenidos con 2h y 3h el contenido de materia seca a los 120 días era mayor en la biomasa aérea que en los minitubérculos. Esta respuesta evidenció que la frecuencia de inmersión con que fueron obtenidos los microtubérculos en SIT tuvo influencia sobre la translocación de asimilatos desde la parte aérea de la planta a los tubérculos durante el proceso de tuberización (medida como contenido de materia seca).
Los microtubérculos obtenidos con una frecuencia de inmersión cada 4h fueron los que mostraron mejores características el final de la etapa de tuberización.
Según Cacace et al. (1994) valores de masa seca superiores al 20.0% son elevados. Esta variable representa una característica de calidad importante para la agroindustria de la papa, y está directamente determinada por la condición genética. Rodríguez et al. (2009) en evaluaciones de campo comprobaron que tubérculos del cv. `Andinita' presentaron valores de materia seca de 20.2% y Ojeda et al. (2010) de 18.7%. En este caso los minitubérculos alcanzaron valores medios superiores (29.67%) (4h).
La frecuencia de
inmersión con que se obtuvieron los microtubérculos en SIT también
afectó el número de minitubérculos por planta y su composición,
según el diámetro. El mayor porcentaje en la categoría
que se recomienda para utilizar como semilla (10.0 _ 40.0 g) (Gallardo et
al., 1997) se alcanzó en los microtubérculos obtenidos con
inmersiones cada 4h. En este tratamiento se obtuvo un 14.8% más que en
el de 2h y un 27.3% más que en el de 3h. Los autores citados anteriormente
informaron que microtubérculos de papa cv. `Andinita' obtenidos en medio
de cultivo semisólido (Salas, 1995) produjeron minitubérculos
y el mayor porcentaje (53.0%) fue de los comprendidos de 10.0 a 40.0 g. Con
los microtubérculos obtenidos en SIT este valor fue superior (70.3%).
DISCUSIÓN
Los resultados demostraron que la respuesta de plantas obtenidas de microtubérculos con diferente diámetro y masa fresca, fue similar a partir de 15 días de ser plantados (cuando se realizó la primera evaluación). Se comprobó que la frecuencia de inmersión tuvo influencia en el crecimiento y desarrollo de las plantas en casa de cultivo.
Autores como Kawakami et al. (2003), encontraron diferencias en los primeros días de crecimiento en casa de cultivo de plantas de papa (S. tuberosum subsp. tuberosum) originadas de microtubérculos de diferente masa fresca pero posteriormente el crecimiento se uniformó. Las condiciones de las casas de cultivo de mayor homogeneidad y calidad del sustrato, protección ambiental y las atenciones culturales sobre las plantas posibilitan que después de la emergencia de los microtubérculos, aún los de menores dimensiones y masa den lugar a plantas que produzcan minitubérculos.
Se ha demostrado que la calidad de las plantas in vitro tiene influencia sobre el desarrollo de las plantas ex vitro. La mayor calidad de los microtubérculos que procedían del tratamiento con inmersiones cada 4h se reflejó también en las variables evaluadas en casa de cultivo.
Aparentemente una condición fisiológica favorable de las plantas en las fases de cultivo in vitro repercutirá en las fases posteriores del proceso de producción de semilla en casa de cultivo y campo (Kowalski et al., 2006). Así, Hazarika (2006) refirió la influencia del estado de desarrollo de las plantas in vitro en su aclimatización. En sus investigaciones, las plantas de mayor altura alcanzaron mayor supervivencia y tuvieron un crecimiento significativamente superior en la casa de cultivo.
El crecimiento vegetativo de las plantas depende de la capacidad de producir, almacenar y emplear las fuentes carbonadas y de nitrógeno. El tamaño final de las hojas requiere de la acción de dos procesos: la división y la expansión celular (González et al., 2010). Las dimensiones de las hojas de las plantas cuyo origen fueron microtubérculos obtenidos con la frecuencia de inmersión más elevada (cada 2h) fueron significativamente menores, como reflejo de que las condiciones de cultivo in vitro también repercutieron en estas variables.
Mediante el uso de minitubérculos en un programa de producción de semilla, el número de multiplicaciones en campo puede ser reducido. Esto contribuye a incrementar la flexibilidad de la producción comercial y reducir el tiempo requerido para obtener volúmenes adecuados de semilla de cultivares de interés (Agramonte, 1999).
La utilización de casas de cultivo para obtener minitubérculos ha resultado una alternativa estratégica para solucionar los problemas de pérdidas de las plantas cultivadas in vitro en el traslado hasta el campo, el alto requerimiento tecnológico para la plantación y la baja uniformidad de las poblaciones (Jiménez-Terry et al., 2001).
La introducción de microtubérculos en la producción de semilla prebásica de papa cv. `Andinita' en sustitución de las plantas in vitro fue propuesta por Gallardo et al. (1997) apoyados en ventajas tales como: facilidad de manejo en el momento de plantar, pueden producirse y almacenarse por un tiempo más prolongado, transportarse con menor riesgo de sufrir deterioro y utilizarse fácilmente como fuente de germoplasma. Así mismo, esta es otra vía para producir minitubérculos, los cuales permiten reducir el número de multiplicaciones en campo para la producción de semilla (Ranalli et al., 1994). Estos autores informaron, además, que microtubérculos obtenidos en medio de cultivo semisólido para la plantación en casas de cultivo con malla antiáfidos podía ser una alternativa viable en el proceso de producción de semilla prebásica de papa en el cv. `Andinita'.
En este contexto, la producción de semilla de papa con el empleo de métodos biotecnológicos adquiere gran importancia. Especialmente, el empleo de SIT, luego de adquirido el equipamiento permite la introducción rápida de un cultivar en la producción.
CONCLUSIONES
Los resultados demostraron que microtubérculos de cv. `Andinita' obtenidos en SIT pueden emplearse en casa de cultivo para producir minitubérculos. La frecuencia de inmersión con que fueron obtenidos los microtubérculos en los SIT influyó sobre el número de minitubérculos por planta así como en su contenido de masa seca. Los mejores resultados se alcanzaron con los sometidos a inmersiones cada 4h. Con estos se obtuvieron 5.9 tubérculos por planta y el 70.3% de estos se encontraba en la categoría de 10.0 a 40.0 g que ha sido referida como adecuada para semilla. Se demostró que los resultados a nivel de casa de cultivo también dependen de las condiciones de cultivo que dieron lugar a los microtubérculos que se utilizaron como material vegetal de plantación.
REFERENCIAS
Agramonte, D (1999) Métodos biotecnológicos para la producción de semilla original de papa (Solanum tuberosum L.). Tesis para aspirar al Grado Científico de Doctor en Ciencias Agrícolas. Universidad Central Marta Abreu de Las Villas, Instituto de Biotecnología de las Plantas. Cuba
Cacace, JE, Huarte MA, Monti MC (1994) Evaluation of potato cooking quality in Argentina. American Journal of Potato Research 71: 145-153
Gallardo, M, Mogollón N, Piñero Z, Hernández N (1997) Densidad de plantas en la producción de tubérculos semillas de papa (Solanum tuberosum L.) a partir de microtubérculos en invernáculos. Annual Meeting. Guatemala
González, N, De Bodt S, Sulpice R, Jikumaru Y, Chae E, Dhondt S, Van Daele T, De Milde L, Weigel D, Kamiya Y, Stitt M, Beemster G, Inze D (2010) Increased leaf size: different means to an End. Plant Physiology 153: 1261_1279
Hazarika, BN (2006) Morpho-physiological disorders in vitro culture of plants. ICAR Research Complex. Meghalaya
Igarza Castro Janet, Daniel Agramonte, Manuel de Feria, Juan Jaime, Miguel Pérez, Mario San Román (2011) Obtención de microtubérculos de papa cv.`Andinita' en Sistemas de Inmersión Temporal. Biotecnología Vegetal 11 (1): 59 -62
Jiménez, E, Pérez N, de Feria M, Barbón R, Capote A, Chávez M, Quiala E, Pérez J (1999) Improved production of potato microtubers using a temporary immersion system. Plant Cell, Tissue and Organ Culture 59: 19-23
Jiménez-Terry, F, Agramonte D, Pérez Ponce JN, Ramírez D, Gutiérrez O, Pérez M (2001) Aclimatización de plantas in vitro de Solanum tuberosum (L.) variedad `Desirée'. Biotecnología Vegetal 2: 103-108
Kawakami, J, Iwamak T, Hasegawa T, Jitsuyama Y (2003) Growth and yield of potato plants grown from microtubers in fields. American Journal of Potato Research 80: 371-378
Kowalski, B, Jiménez-Terry F, Herrera L, Agramonte D (2006) Application of soluble chitosan in vitro and in the greenhouse to increase yield and seed stability and seed quality of potato minitubers. Potato Research 49: 167-176
Lugo, JG, Mogollón N, Rodríguez ZF, Díaz JG (2009) Efecto del intercambio gaseoso sobre el crecimiento y tuberización de vitroplantas de papa. Revista de la Facultad de Agronomía 26: 3
Mogollón, N, Gallardo M, Hernández N (2000) Effects of benzylaminopurine, sucrose and culture method on microtuberization of potatoes (Solanum tuberosum L.) cv. `Andinita'. Annual Meeting Interamerican Society for Tropical Agriculture 42: 451-455
Ñústez,
CE, Santos M, Segura M (2009) Acumulación y distribución de materia
seca de cuatro variedades de papa (Solanum tuberosum
L.) en Zipaquirá, Cundinamarca (Colombia). Revista Facultad Nacional
de Agronomía Medellín 62: 4823-4834
Ojeda, M, Pérez de Camacaro M, Rodríguez D, Gallardo M, Valera R (2010) Evaluación hortícola, producción y calidad postcosecha de clones avanzados de papa en la localidad de Duaca, estado Lara, Venezuela. Bioagro 22: 17-28
Pérez-Alonso, N, de Feria M, Jimenez E, Capote A, Chávez M, Quiala E (2001) Empleo de Sistemas de Inmersión Temporal para la producción a gran escala de tubérculos in vitro de Solanum tuberosum L. var. Atlantic y estudio de su comportamiento en campo. Biotecnología Vegetal 1: 17-21
Ranalli, P, Bassi F. Ruaro G, Mandolino G (1994) Microtuber and minituber production and field performance compared with normal tubers. Potato Research 37: 383-391
Rodríguez, D, Ojeda M, Pérez de Camacaro M, Gallardo M, Valera R, Bittara F (2009) Producción, incidencia de la sarna polvorienta y calidad de clones avanzados de papa. Revista de la Facultad de Agronomía 26: 5
Salas, RJ (1995) Producción de semilla pre-básica de Papa. FONAIAP Divulga 48
Teisson, C, Alvard D (1999) In vitro production of potato microtubers in liquid medium using temporary immersion. Potato Research 42: 499_504
Recibido: 3-6-2013
Aceptado: 4-7-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
