ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN
1609-1841, RNPS: 0397 (Versión impresa)
Establecimiento in vitro de Heliconia rostrata Ruiz
& Pavón y Heliconia wagnerina Petersen
In vitro establishment of Heliconia rostrata Ruiz & Pavón and Heliconia wagnerina Petersen
Flora Margarita Sosa Rodríguez, Alexander Díaz López, Yanelis Puerta González, Enrique Casanovas Cosío, Roberto Suarez Surí, Odalmys Pérez Espinosa, Marilín Fontes Leandro
1Centro
de Estudios para la Transformación Agraria Sostenible (CETAS)/Universidad
de Cienfuegos. Carretera Cuatro Caminos, km 2. Cienfuegos. Cuba. e-mail: fmsosa@ucf.edu.cu
2Ministerio
de la Agricultura. Cienfuegos
3Biofábrica
de Cienfuegos. Empresa de Semillas Varias
RESUMEN
Las heliconias tienen gran atractivo como plantas ornamentales y por su importancia medioambiental. Las especies Heliconia rostrata y H. wagneriana se encuentran en el Jardín Botánico de Cienfuegos, Cuba. El objetivo de este trabajo fue establecer in vitro explantes de estas especies para iniciar su propagación por métodos biotecnológicos. Se partió de rizomas como explantes iniciales que se desinfectaron con hipoclorito de sodio. En H. rostrata se ensayaron dos concentraciones de hipoclorito de sodio (v/v) (2% y 5%) durante 5 y 10 min y en H. wagneriana 3% y 5% por 15 y 25 min. Se cuantificó el número de explantes contaminados con microorganismos, el número de explantes vivos y brotados. Las pérdidas por contaminación microbiana afectaron la supervivencia de los explantes. Con el empleo de hipoclorito de sodio al 5% se obtuvieron los mejores resultados. Mediante el procedimiento empleado se logró el establecimiento in vitro de explantes de ambas especies de heliconias.
Palabras clave: micropropagación, rizomas, Zingiberales
ABSTRACT
The heliconia have wide appeal as ornamental plants and their environmental significance. The species Heliconia rostrata and H. wagneriana are planted in the Botanical Garden of Cienfuegos, Cuba. The aim of this study was to in vitro establish explants of these species to initiate propagation through biotechnological methods. Rhizomes were used as initial explants and were disinfected with sodium hypochlorite. In H. rostrata two concentrations of sodium hypochlorite (v/v) (2% and 5%) were tested for 5 and 10 min. In H. wagneriana two concentrations were tested (3% and 5%) for 15 and 25 min. The numbers of explants contaminated with microorganisms, the number of live explants and sprouted were quantified. Microbial contamination losses affected the explants survival. With the use of 5% sodium hypochlorite better results was obtained. Through the use of these procedures it was possible the in vitro establishment of both species of heliconia.
Key words: micropropagation, rhizomes, Zingiberales
El género Heliconia, se encuentran dentro de la familia Heliconiaceae del orden Zingiberales. Es el único género dentro de esta familia, y agrupa más 250 especies en el mundo. Son originarias de Suramérica, Centroamérica, las islas del Pacífico e Indonesia (Instituto Alexander von Humboldt, 2003; Henao y Ospina, 2008). Se ubican entre las especies tropicales más populares en cultivo como plantas ornamentales. Protegen las fuentes de agua y se consideran imprescindibles en la reforestación (Vargas, 2002). Además, actúan recíprocamente con un alto número de organismos y son polinizadas por los colibríes y murciélagos (Berry y Kress, 1991). Tales interacciones biológicas demuestran el valor ecológico de estas especies, sobre todo en las comunidades tropicales (Santos et al., 2009). Además, son de gran importancia ecológica, ya que debido a su crecimiento rizomatoso son aptas para contrarrestar los movimientos de tierra en las laderas erosionadas de barrancos y pendientes.
Las potencialidades de las diversas especies de heliconias han sido poco reconocidas, sin embargo, mercados de Estados Unidos, Asia y Alemania presentan una demanda creciente de este tipo de flores. El escaso conocimiento técnico y científico acerca del cultivo de estas especies, aunado a su lento desarrollo en campo, hacen que se dificulte su producción a gran escala (Aterhortúa y Valencia, 2002). De acuerdo con Marulanda e Isaza (2004) la biotecnología constituye una herramienta fundamental para ayudar a satisfacer las necesidades de los productores, a través del desarrollo de métodos de propagación in vitro que permiten obtener explantes de interés económico y calidad en las cantidades requeridas.
Heliconia rostrata Ruiz & Pavón y Heliconia wagnerina Petersen son dos especies de gran atractivo florístico que se encuentran en el Jardín Botánico de Cienfuegos, Cuba. Sin embargo, no se cuenta con material vegetal para su propagación comercial ni se dispone de protocolos para su propagación in vitro. H. rostrata alcanza una altura entre 2 y 6 m y posee un hábito de crecimiento musoide. La inflorescencia tiene orientación pendular y contiene de 9-24 brácteas en arreglo dístico. La mayor parte de la bráctea es roja con el borde inferior amarillo y verde. Esta especie florece todo el año. Por otra parte, H. wagnerina tiene plantas de 3 a 5 m de altura con similar hábito de crecimiento que H. rostrata, sin embargo, la inflorescencia es erecta con arreglo dístico y de 9 -12 brácteas de color verde, amarillo y rojo en el centro. El objetivo del trabajo fue establecer in vitro explantes de estas especies para iniciar su propagación por métodos biotecnológicos.
Como material vegetal de partida se utilizaron rizomas de plantas donantes de ambas especies los cuales fueron colectados en el Jardín Botánico de Cienfuegos (JBC) (200 07N 800 20´ W).
Los rizomas de cada especie fueron plantados en macetas. Se empleó un sustrato constituido por una mezcla de suelo (50%), estiércol vacuno con dos años de descomposición (30%) y zeolita (10%), previamente desinfectado con vapor durante 30 minutos. El riego se efectuó cada tercer día de forma localizada.
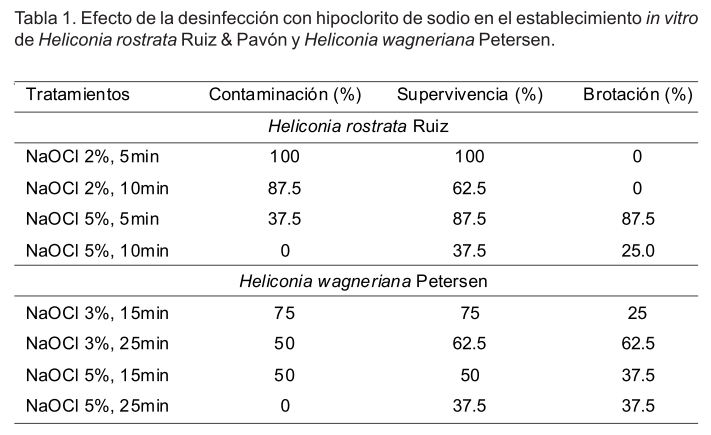
Para el establecimiento in vitro se tomaron 32 rizomas por especie y se lavaron con agua y detergente. Posteriormente se cortaron hasta reducir su tamaño (aproximadamente 1cm desde la base del ápice meristemático) y se desinfectaron con hipoclorito de sodio. En H. rostrata se ensayaron dos concentraciones de hipoclorito de sodio (v/v) (2% y 5%) durante 5 y 10 y en H. wagneriana 3% y 5% por 15 y 25 min. Se utilizaron ocho explantes en cada tratamiento.
Se colocó un explante por frasco de cultivo (250ml de capacidad) con 25 ml de medio de cultivo compuesto por sales MS (Murashige y Skoog, 1962) al 70%, 30 g l-¹ de sacarosa, 2.0 ml l-¹ de tiamina, 0.5 mg l-1 de 6- bencilaminopurina (6-BAP) y 0.13 mg l-1 de ácido acético (AIA). El pH de medio de cultivo fue ajustado entre 5.6-5.8 previo a la esterilización en autoclave. Los frascos fueron incubados en cámaras con luz solar, a 28 ±2°C y aproximadamente 11 horas luz por día.
A los 30 días de cultivo se cuantificó el número de explantes contaminados con microorganismos, el número de explantes vivos y brotados. Con estos datos se calculó el porcentaje de contaminación, supervivencia y brotación por tratamiento.
Mediante el procedimiento empleado se logró el establecimiento in vitro de explantes de ambas especies de heliconias (Figura 1).
En el caso de H. rostrata el porcentaje de contaminación microbiana disminuyó con el incremento en la concentración de hipoclorito de sodio y el tiempo de exposición del material vegetal (Tabla1). La presencia de microorganismos contaminantes afectó el porcentaje de supervivencia y solo se lograron establecer explantes en los tratamientos sometidos a desinfección con hipoclorito de sodio al 5%.
En el establecimiento in vitro de H. wagneriana la contaminación microbiana también disminuyó con el incremento de la concentración de hipoclorito de sodio y el tiempo de exposición de los explantes. No obstante, los porcentajes de supervivencia y brotación fueron superiores (Tabla1) y se logró el establecimiento de explantes procedentes de rizomas en todos los tratamientos.

Las pérdidas por contaminación microbiana se refieren como uno de los factores limitantes en el establecimiento in vitro de heliconias a partir de rizomas (Díaz y Rodrígues, 2001; Marulanda e Isaza, 2004). Se requieren otros estudios que permitan disminuir la incidencia de bacterias y hongos filamentosos en esta fase de cultivo de H. rostrata y H. wagneriana teniendo en cuenta la poca disponibilidad de explantes iniciales y la factibilidad del uso de técnicas biotecnológicas para propagar estas especies.
REFERENCIAS
Aterhortúa L, Valencia, C (2002) Bioconversión de embriones somáticos de Heliconia stricta Huber utilizando los sistemas de inmersión temporal RITA. Actualidades Biológicas 24 76: 23-29
Berry, F, Kress JW (1991) Heliconia and identification guide. Smithsonian Institute Press. Washington and London
Días, M A S, Rodrigues P H V (2001) Fontes de explantes e contaminantes isolados em cultivo in vitro de Heliconia bihai (Heliconiaceae). Rev. Bras. Hortic. Ornam. 7:165 - 168
Henao, E, Ospina, A (2008) Insectos benéficos asociados a cultivos de heliconias en el eje cafetalero colombiano. Boletín Científico. Museo de Historia Natural 12: 157-166
Instituto Alexander von Humboldt (2003) Análisis de desarrollo empresarial para la producción de Heliconias y follajes tropicales en las veredas Canaan y La Palmera ubicadas en el municipio de Salento, Quindío
Marulanda, ML, Isaza VL (2004) Establecimiento in vitro de Heliconias con fines de propagación masiva. Sci. Tech. 10 (26)
Murashige, T, Skoog F (1962) A revised medium for rapid growth and biossays with tobaco tissue culture. Plant Physiology15: 473-479
Santos, AB, Lombera R, Benitez JM (2009) New records of heliconia (Heliconiaceae) for the region of
Chajul, Southern Mexico, and their potential use in biodiversity-friendly cropping systems. Revista Mexicana de Biodiversidad 80: 857-860
Vargas, W (2002) Guía ilustrada de las plantas de las montañas del Quindío y los Andes Centrales, Centro editorial: Universidad de Caldas. Manizales
Recibido: 06-02-2013
Aceptado: 10-07-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
