ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 15, No. 2: 97 - 103, abril - junio, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Respuesta histoquímica de plantas de banano cv. `Grande
naine' inoculadas con Mycosphaerella fijiensis y filtrado de cultivo
de Bacillus pumilus CCIBP-C5
Histochemical response of `Grande naine' plants inoculated with M. fijiensis and Bacillus pumilus CCIBP-C5 cell free filtrate
Eilyn Mena*, Mileidy Cruz-Martín, Mayra Acosta-Suárez, Berkis Roque, Tatiana Pichardo, Yelenys Alvarado-Capó. *Autora para correspondencia
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: eilyn@ibp.co.cu
RESUMEN
En los últimos años, ha ganado interés el biocontrol de Mycosphaerella fijiensis con el empleo de microorganismos o sus productos. Sin embargo, el conocimiento de los eventos bioquímicos involucrados en la interacción Musa-M. fijiensis-microorganismo, es aún limitado. El objetivo del trabajo fue determinar la respuesta histoquímica de plantas de `Grande naine' (Musa AAA) inoculadas o no con el patógeno, en presencia de filtrado de cultivo de Bacillus pumilus CCIBP-C5. Para esto, se emplearon técnicas que permitieran la visualización de calosa, anión superóxido, lignina y compuestos fenólicos en los primeros días posteriores a la inoculación (dpi). Como resultado, a los 6 dpi se observaron deposiciones de calosa dentro de los estomas en plantas donde se aplicó el filtrado de cultivo, independientemente de la presencia o no del patógeno. Además, se observó un halo azul, alrededor de estomas, indicativo de la presencia de anión superóxido. Con la técnica empleada no fue posible detectar lignina o acumulación de compuestos fenólicos. Se demostró la acumulación de compuestos bioquímicos relacionados con la respuesta de defensa de plantas de `Grande naine' ante la infección del patógeno. Además, que con el empleo de filtrados de cultivo bacterianos la planta responde en los primeros días de la infección. Estos resultados evidencian el posible mecanismo de inducción de la respuesta de defensa en plantas de Musa spp. en presencia de filtrado de cultivo bacteriano.
Palabras clave: anión superóxido, calosa, fenoles, lignina, Sigatoka negra
ABSTRACT
In recent years, interest has won biocontrol Mycosphaerella fijiensis with the use of microorganisms or their products. Nevertheless, the knowledge of the biochemical events involved in Musa- M. fijiensis-microorganism interaction, is still limited. The objective was to determine the histochemical response of `Grande naine' (Musa AAA) plants inoculated or not with the pathogen in the presence of culture filtrate of Bacillus pumilus CCIBP-C5. For this, techniques that allow visualization of callose, superoxide anion, lignin and phenolic compounds in the early days post inoculation (dpi) were used. As a result, at 6 dpi callose deposition were observed within the stomata in plants where the culture filtrate was applied regardless of the presence or absence of the pathogen. Furthermore, a blue halo was observed around stomas, indicative of the presence of superoxide anion. It was not possible to detect accumulation of lignin or phenolic compounds with the technique used. It was demonstrated the accumulation of biochemical compounds related to defense response of `Grande naine' plants to pathogen infection. Furthermore, it was shown that the plant responds in early infection with the use of bacterial culture filtrates. These results demonstrate the possible mechanism of induction of defense response in plants of Musa sp. in the presence of bacterial culture filtrate.
Key words: Black Sigatoka, callose, lignin, phenols, superoxide anion
INTRODUCCIÓN
El control biológico en el manejo de plagas y enfermedades ha ganado aceptación en los últimos años. El uso de microorganismos beneficiosos es considerado uno de los métodos más promisorios para las prácticas seguras y racionales de manejo de cultivos (Fravel, 2005). En el caso particular de la Sigatoka negra (Mycosphaerella fijiensis Morelet), enfermedad que afecta a plátanos y bananos, se han venido investigando especies bacterianas productoras de compuestos antifúngicos. Estudios al respecto realizados por varios autores incluyen bacterias del género Bacillus y en los últimos años se ha comenzado a analizar la integración entre los compuestos antagónicos y la inducción de resistencia (González et al., 1996; Ceballos et al., 2012).
Aunque se ha avanzado en el estudio de los eventos genómicos y bioquímicos de la interacción Musa-M. fijiensis para cultivares susceptibles y resistentes (Sánchez-García et al., 2010; Cavalcante et al., 2011; Torres et al., 2012), los resultados son escasos en la inserción de otros factores extrínsecos como es el caso de los microorganismos antagonistas.
Según Ferreira et al. (2007) con el empleo de técnicas histoquímicas es posible detectar cambios estructurales y fisiológicos en las células que rodean el sitio de penetración del patógeno. En general, estas técnicas permiten, de forma rápida, identificar procesos químicos celulares, tráfico celular y la clasificación de metabolitos. Además, se pueden estudiar procesos de penetración de microorganismos patógenos y las reacciones de defensa de las plantas (Hassan y El-Awadi, 2013).
En estudios previos se demostró la actividad antifúngica in vitro de bacterias provenientes de la filosfera de Musa frente a M. fijiensis (Poveda et al., 2010). Atendiendo a lo anterior, el objetivo de este trabajo fue determinar la respuesta histoquímica de plantas de Musa spp. inoculadas con M. fijiensis y filtrado de cultivo bacteriano de Bacillus pumilus CCIBP-C5 aislado de la filosfera de Musa sp. y con actividad antifúngica in vitro frente a M. fijiensis.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron plantas de `Grande naine' (Musa AAA), propagadas in vitro vía organogénesis, según el protocolo descrito por Orellana (1994).
Suspensión micelial de Mycosphaerella fijiensis
Se empleó el aislado de M. fijiensis CCIBP-Pf-83, perteneciente a la Colección de Cultivos Microbianos del Laboratorio de Microbiología Aplicada del IBP. Para su cultivo, el aislado fue inoculado en Enlermeyers de 100 ml de volumen con 50 ml de Caldo Papa Dextrosa (PDB) (BioCen). Estos fueron incubados en agitación a 120 rpm y 28oC, durante 15 días. Para obtener la suspensión de M. fijiensis se decantó el medio de cultivo y se homogeneizó en mezcladora (Ultraturrax T25), durante un minuto con medio de cultivo PDB, se filtró por tamiz de 40.0 µm y se ajustó a 5.0x105 fragmentos de micelio ml-1 en medio de cultivo PDB.
Filtrado de cultivo bacteriano
Para el estudio se empleó Bacillus pumilus CCIBP-C5, perteneciente a la Colección de Cultivos Microbianos del IBP. Dicha cepa fue aislada de la filosfera de Musa spp. y posee actividad antifúngica in vitro frente a M. fijiensis (Poveda et al., 2010). Se inoculó 1 ml del cultivo de la cepa bacteriana ajustado a DO600=0.1 (~5.0x109 ufc ml-1) en 100 ml de medio de cultivo Caldo Nutriente (CN) (BioCen). Se incubaron durante 48 horas (120 rpm y 30ºC) y posteriormente se centrifugaron por 15 min a 4ºC y 10 000 g (Eppendorf Centrifuge 5810 R). Para eliminar las células bacterianas, el sobrenadante fue esterilizado por filtración (0.22 µm) y se conservó a 4ºC. El sobrenadante libre de células bacterianas se denominó filtrado de cultivo bacteriano (fc).
Inoculación artificial con M. fijiensis y aplicación del filtrado de cultivo bacteriano
Las plantas se plantaron en bolsas de polietileno con sustrato compuesto por 50% de humus de lombriz, 30% de compost y 20% de zeolita a una razón de 5:3:2 (v/v), en casa de cultivo durante 45 días. Transcurrido ese tiempo, las plantas se transfirieron a macetas plásticas (20 cm de diámetro con un litro de capacidad) con igual sustrato y permanecieron allí otros 45 días, hasta alcanzar como mínimo 20 cm de altura y tres hojas activas. El riego fue por aspersión tres veces al día, iluminación solar, con una media en la intensidad luminosa de 280-400 µmol m2 s-1 (medido con Extech Light Meter 401025, USA). La temperatura media durante el día fue de 30 ± 2ºC y la humedad relativa del 80 ± 5%.
Las plantas in vitro de `Grande naine' se inocularon artificialmente con M. fijiensis según
el procedimiento descrito por Leiva-Mora et al. (2010). Tanto al filtrado de cultivo bacteriano como a la suspensión de M. fijiensis se les adicionó gelatina al 1% (m/v) para aumentar la adhesión a la superficie de la hoja. La inoculación de ambos se realizó por la parte abaxial de las tres primeras hojas. La suspensión micelial se aplicó con la ayuda de un pincel y el filtrado de cultivo bacteriano por aspersión tres días posteriores a la inoculación (dpi) con el patógeno. Las plantas se ubicaron completamente al azar en la casa de cultivo.
Se conformaron los siguientes tratamientos:
1) Control: plantas de `Grande naine' con tres hojas expandidas completamente y 20 cm de altura, sin inocular.
2) Filtrado de cultivo bacteriano B. pumilus CCIBP-C5: plantas inoculadas con filtrado de cultivo bacteriano.
3) Control inoculado: plantas inoculadas con M. fijiensis.
4) Filtrado de cultivo bacteriano B. pumilus CCIBP-C5 y M. fijiensis: plantas inoculadas con el patógeno y tres días después con el filtrado de cultivo bacteriano.
Para determinar la acumulación de compuestos bioquímicos, la toma de muestras se realizó en los primeros 14 días posteriores a la inoculación (dpi) con el patógeno, correspondiente al período de incubación del hongo. En cada uno de los tiempos de evaluación se tomaron como muestra las tres hojas inoculadas por planta, para cada tratamiento.
En cada hoja se tomaron al azar, fragmentos de 1 cm2 de la zona media de la tercera hoja inoculada de cada tratamiento a los 6, 10 y 14 dpi. Las muestras fueron tratadas según las técnicas descritas más adelante. Todas las muestras se observaron en microscopio óptico (Novel) con amplificación de 400x y se fotografiaron inmediatamente.
Deposiciones de calosa
Para observar las deposiciones de calosa, los fragmentos de hojas fueron fijados en solución amortiguadora de fosfato de sodio y formaldehído al 10% y gradientes de alcohol etílico (30, 50 y 70%). Para el aclaramiento se siguió el protocolo que se describe brevemente: las muestras de hojas se lavaron con agua destilada y se sumergieron en hipoclorito de sodio al 3%, durante 20 minutos a temperatura ambiente. Transcurrido este tiempo las hojas se lavaron con agua destilada a temperatura ambiente. Posteriormente, las muestras se acidificaron con ácido acético al 20%, durante 10 minutos. Finalmente, se lavaron en agua destilada a temperatura ambiente.
Las deposiciones de calosa se visualizaron con una tinción diferencial, mediante el protocolo del ácido peryódico 0.5% y el reactivo de Schiff (Merck), propuesto por McManus y Mowry (1964). La presencia de calosa se determinó por la aparición de áreas de color rosa.
Acumulación de anión superóxido
El anión superóxido (O2-) se detectó indirectamente a partir de la reducción de Nitroblue Tetrazolium (NBT), según la metodología propuesta por Fryer et al. (2002). Las muestras se sumergieron en una solución de NBT 6 mM, durante 8 horas. Para incrementar el contraste se removió la clorofila del tejido vegetal con etanol al 95% (v/v) a 100°C, durante 5 minutos.
Acumulación de compuestos fenólicos
Para la detección de compuestos fenólicos se empleó el método colorimétrico descrito por Reeve (1951). Se agregó una gota de nitrato de sodio acuoso al 10% (v/v), una gota de ácido acético acuoso al 10% (v/v) y luego una gota de urea acuosa al 20% (m/v). Después de 3 minutos, se adicionaron dos gotas de NaOH 2N. En presencia de los compuestos fenólicos se observa una coloración roja intensa.
Acumulación de lignina
Las deposiciones de lignina en las paredes celulares se visualizaron utilizando una tinción con fluoroglucina al 1% (m/v) en etanol al 70% (v/v), durante 5 minutos (Southerton y Deverall, 1990). Se adicionaron dos gotas de ácido clorhídrico (HCl) concentrado y se enjuagó con agua. Ante la presencia de lignina se observan áreas de color rojo/rosado (Gahan, 1984).
RESULTADOS Y DISCUSIÓN
Se observó una respuesta de la planta, a nivel histoquímico, frente a la aplicación del filtrado de cultivo de Bacillus pumilus CCIBP-C5 independientemente de la presencia del patógeno.
Deposiciones de calosa
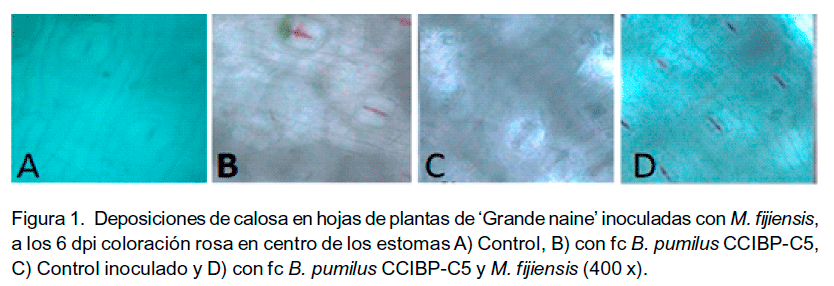
A los 6 dpi se observó una tinción rosada en la cavidad subestomática en las plantas donde se aplicaron los filtrados de cultivo; en plantas inoculadas (Figura 1d) o no con M. fijiensis (Figura 1b). El ácido peryódico es un oxidante fuerte que reacciona con la calosa dando lugar a aldehídos que toman un color rosa con el reactivo de Schiff (McManus y Mowry, 1964). Sin embargo, en las plantas sin el filtrado de cultivo, no se observaron deposiciones de calosa en el período evaluado (Figura 1a y c).
La calosa es un polímero formado por (1-3)-â-D-glucano, cuyas deposiciones locales en la planta están asociadas a heridas, infección por patógenos y a estrés fisiológico (Voigt et al., 2006). En respuesta a la infección con patógenos fúngicos la calosa constituye una barrera estructural inducible (Ferreira et al., 2007). Según Asselbergh et al. (2007), este compuesto es depositado en la pared celular debajo del sitio de penetración entre la membrana plasmática y la pared celular, formando las llamadas papilas que bloquean la entrada del hongo. Además, la síntesis de calosa constituye una defensa física por su relación con la clausura estomática (Luna et al., 2011).
En este sentido, García-Gutiérrez et al. (2013) observaron deposiciones de calosa en las células epidérmicas y del mesófilo a las 72 horas, en plantas de melón (Cucumis melo L.) inoculadas con B. subtilis UMAF6639 y con Podosphaera fusca (Fr.) U. Braun & Shishkoff. En este estudio no se observaron diferencias en la respuesta de defensa de las plantas en presencia o no de la bacteria cuando no se inoculó el patógeno. Los resultados fueron indicativos de la activación de mecanismos de defensa previo a la inducción de la bacteria en conjunto con la activación directa por el patógeno.
Acumulación de anión superóxido
En las plantas donde se aplicó el filtrado de cultivo, se observó la aparición de un complejo azul oscuro alrededor de los estomas debido a la reacción del NBT con el anión superóxido a los 6 dpi (Figura 2b y d). La coloración azul es debido a que el NBT se oxida dando un color azul oscuro en la zona donde se acumula el O2- (Fryer et al., 2002). A los 10 y 14 dpi la coloración fue menos intensa y en toda la superficie de la hoja, no siendo posible determinar una respuesta localizada o relacionada con la penetración del patógeno.
Los resultados están en correspondencia con los encontrados por Patykowski y Urbanek (2003), quienes detectaron un aumento de O2- en hojas de tomate (Solanum lycopersicum L.) parcialmente resistente en la fase temprana de la infección por Botrytis cinerea Pers. Por otro lado, KuŸniak et al. (2014) observaron acumulación de O2- en plantas de calabaza (Cucurbita maxima L.) y pepino (Cucumis sativus L.) a los 5 dpi en respuesta a la inoculación con Erysiphe cichoracearum (DC.) y Pseudomonas syringae pv. lachrymans (Smith y Brian), respectivamente. Estos autores determinaron que la acumulación de este ion es temporal y está en correspondencia con el estallido oxidativo relacionado con la respuesta hipersensible en la planta.
M. fijiensis es un hongo hemibiotrófico, que tiene primero una fase biotrófica y posteriormente pasa a la fase necrotrófica. En patógenos biotróficos un incremento de ROS puede causar la muerte del patógeno o estar involucrado como segundo mensajero en la respuesta sistémica de defensa en la planta (De Gara et al., 2003). Sin embargo, los patógenos necrotróficos estimulan la producción de ROS, lo cual induce a la muerte celular de la planta y favorece la colonización e infección del patógeno (Torres et al., 2012).
Atendiendo a ello, se puede suponer que la inducción de un estallido oxidativo en los primeros días de la infección limite el desarrollo y crecimiento de M. fijiensis. En el patosistema Musa-M. fijiensis, varios autores han observado en el estallido oxidativo una respuesta temprana en cultivares resistentes inoculados en comparación con cultivares susceptibles (Cavalcante et al., 2011; Torres et al., 2012).
Acumulación de compuestos fenólicos
En cuanto a la detección de fenoles (Figura 3) no fue posible encontrar diferencias entre los tratamientos mediante el método ensayado. Sin embargo, en el estudio realizado se observaron cambios en la morfología de las células cuando se aplicó el filtrado de cultivo. En las plantas inoculadas artificialmente con M. fijiensis (Figura 3 c y d) se observó una coloración naranja.
En este mismo patosistema, Sánchez-García et al. (2010) observaron acumulación de compuestos fenólicos en las células epidérmicas tanto del cultivar resistente `Calcutta 4' como del susceptible `Grande naine' posteriormente a la inoculación con M. fijiensis. La acumulación de estos compuestos fue aislada al inicio y aumentó en correspondencia con el estado de síntomas de la enfermedad en la planta.
Los compuestos fenólicos son metabolitos secundarios sintetizados a partir de intermediarios del metabolismo primario, a través de rutas como la de los fenilpropanoides. Las sustancias que se producen forman parte del arsenal defensivo de la planta y sus funciones no se restringen a un compuesto en particular (Dixon et al., 2002).
Acumulación
de lignina En cuanto a la detección de lignina tampoco fue posible encontrar
diferencias entre los tratamientos mediante el método ensayado. Al igual
que en el contenido de fenoles se
detectaron cambios en las células cuando se aplicó el filtrado
de cultivo bacteriano. En este caso se observó un reborde más
oscuro en los estomas (Figura 4). Estos resultados coinciden
con los referidos por Cavalcante et al. (2011), quienes a los 10 dpi observaron
modificaciones en la pared celular de los cultivares parcialmente resistente
‘Pisang Madu’ y resistente ‘Calcutta 4’. La no detección
de estos compuestos tanto para los fenoles como para la lignina, puede ser debido
al corto tiempo entre la inoculación y la evaluación. La lignina
es un polímero complejo formado
por cadenas largas de ácidos fenólicos, constituye un componente
estructural de la pared celular de las plantas. Su deposición hace a
la pared cel ular más gruesa y resistente, lo que restringe la penetración
y el ataque de patógenos (Ferreira et al., 2007). Autores como Sánchez-García
et al. (2010) refieren que la deposición de lignina se produce en las
paredes celulares de las células dañadas en correspondencia con
la evolución de los síntomas o la aparición de lesiones
y que es mayor en los cultivares resistentes respecto a los susceptibles.
CONCLUSIONES
La aplicación de filtrado de cultivo bacteriano de Bacillus pumilus CCIBP-C5 indujo la formación de deposiciones de calosa y anión superóxido en plantas de `Grande naine' inoculadas con M. fijiensis, no siendo necesario para ello la presencia del patógeno.
REFERENCIAS
Asselbergh, B, Curvens K, França SC, Audenaert K, van Vuylsteke BF, Höfte M (2007) Resistance to Botrytis cinerea in sitiens, an abscisic acid-deficient tomato mutant, involves timely production of hydrogen peroxide and cell wall modifications in the epidermis. Plant Physiology 144: 1863-4877
Cavalcante, JB, Escoute J, Madeira JP, Romero RE, Nicole MR, Oliveira LC, Hamelin C, Lartaud M, Verdeil JL (2011) Reactive oxygen species and cellular interactions between Mycosphaerella fijiensis and banana. Tropical Plant Biology 4: 134-143
Ceballos, I, Mosquera S, Ángulo M, Mira JJ, Argel lE, Uribe-Velez D, Romero-Tabarez M, Orduz-Peralta S, Villegas V (2012) Cultivable bacteria population associated with leaves of banana and plantain and their antagonistic activity against Mycosphaerella fijiensis. Environmental Microbiology 64: 641-653
De Gara, L, de Pino MC, Tommasi F (2003) The antioxidant systems vis-á-vis reactive oxygen species during plant-patogen interaction. Plant Physiology and Biochemestry 41: 863-870
Dixon, RA, Achnine L, Kota P, Liu CJ, Srinivasa-Reddy MS, Wang L (2002) The phenylpropanoid pathway and plant defence - a genomics perspective. Molecular Plant Pathology 3: 371-390
Ferreira, RB, Monteiro S, Freitas R, Santos CN, Chen Z, Batista LM, Duarte J, Borges A, Teixeira AR (2007) The role of plant defense proteins in fungal pathogenesis. Molecular Plant Pathology 8(5): 677-700
Fravel, DR (2005) Commercialization and implementation of biocontrol. Annu Rev Phytophatol 43: 337-359
Fryer, MJ, Oxborough K, Mullineaux Ph, Baker NR (2002) Imaging of photo oxidative stress responses in leaves. Journal of Experimental Botany 53(372): 1249-1254
García-Gutiérrez, L, Zeriouh H, Romero D, Cubero J, de Vicente A, Pérez-García A (2013) The antagonistic strain Bacillus subtilis UMAF6639 also confers protection to melon against cucurbit powdery mildew by activation of jasmonate- and salicylic acid-dependent defense responses. Microbial Biotechnology 6: 264-274
González, R, Bustamante E, Shannon P, Ruiz C (1996) Avances en el control biológico de Sigatoka negra (Mycosphaerella fijiensis). En: Badilla, W, Rivera G, Mora JR, Navarro W, Badilla W (Eds) Memoria: fitopatología X Congreso Nacional Agronómico y de Recursos Naturales, pp. 53-57. CATIE. San José
Hassan EA, El-Awadi ME (2013) Brief review on the application of histochemical methods in different aspects of plant research. Nature and Science 11(12): 54-67
KuŸniak E, Œwiercz U, Chojak J, Sekulska-Nalewajko J, Goc³awski J (2014) Automated image analysis for quantification of histochemical detection of reactive oxygen species and necrotic infection symptoms in plant leaves. Journal of Plant Interactions 9(1): 167-174
Leiva-Mora, M, Alvarado-Capó Y, Acosta-Suárez M, Cruz-Martín M, Sánchez-García C, Roque B (2010) Protocolo para la inoculación artificial de plantas de Musa spp. con Mycosphaerella fijiensis y evaluación de su respuesta mediante variables epifitiológicas y componentes de la resistencia. Biotecnología Vegetal 10 (2): 79-88
Luna, E, Pastor V, Robert J, Flors V, Mauch-Mani B, Ton J (2011). Callose deposition: a multifaceted plant defense response. Molecular Plant-Microbe Interactions 24 (2): 183-193
McManus, JF, Mowry R (1964) Straining methods. Histological and histochemical. Special methods for the constituents of cell and tissues, pp. 99-246. Harper & Row. New York
Orellana, P (1994) Tecnología para la micropropagación de clones de Musa spp. Tesis para aspirar por el grado científico de doctor en ciencias Agrícolas. UCLV. IBP. Santa Clara, Cuba
Patykowski, J, Urbanek H (2003) Activity of enzymes related to H2O2 generation and metabolism in leaf apoplastic fraction of tomato leaves infected with Botrytis cinerea. Journal of Phytopathology 151: 153-161
Poveda, I, Cruz-Martín M, Sánchez-García C, Acosta-Suárez M, Leiva-Mora M, Roque B, Alvarado-Capó Y (2010) Caracterización de cepas bacterianas aisladas de la filosfera de Musa spp. con actividad antifúngica in vitro frente a Mycosphaerella fijiensis. Biotecnología Vegetal 10 (1): 57-61
Reeve, RM (1951) Histochemical tests for polyphenols in plant tissues. Stain Tech 26: 91-96
Sánchez-García, C Alvarado-Capó Y, Cruz-Martín M, Acosta-Suárez M, Leiva-Mora M, Roque B (2010) Detección de compuestos bioquímicos relacionados con la respuesta defensiva en plantas de Musa spp. inoculadas artificialmente con Mycosphaerella fijiensis. Biotecnología vegetal 10 (2): 89-97
Southerton, SG, Deverall BJ (1990) Histochemical and chemical evidence for lignin accumulation during the expression of resistance to leaf rust fungi in wheat. Phys Mol Plant Path 36: 483-494
Torres, JM, Calderón H, Rodríguez-Arango E, Morales JG, Arango R (2012) Differential induction of pathogenesis-related proteins in banana in response to Mycosphaerella fijiensis infection. European Journal of Plant Pathology 133: 887-898
Recibido: 11-11-2014
Aceptado:
18-02-2015
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.