ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 15, No. 2: 105 - 114, abril - junio, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto del tipo de explante y la frecuencia de inmersión
en la producción de microtubérculos de papa cv. `Andinita' en
Sistemas de Inmersión Temporal
Effect of explant type and immersion frequency on potato microtubers cv. `Andinita' production in Temporary Immersion Systems
Janet Igarza1, Manuel de Feria2*, Yelenys Alvarado-Capó2, Tatiana Pugh3, Juan Jaime4, Miguel Pérez4, Mario San Roman4, Daniel Agramonte2. *Autor para correspondencia
1Laboratorio
de Biotecnología Vegetal (CITMA), Holguín, Cuba
2Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las
Villas, Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara, Cuba.
CP 54 830. e-mail: mdeferia@ibp.co.cu
3Escuela
Socialista de Agricultura Tropical (INIA), Maracay, Venezuela
4Laboratorio Cultivo de Tejidos y el Campo Experimental de Mucuchíes (INIA). Mérida, Venezuela
RESUMEN
La papa (Solanum tuberosum L.) es uno de los cultivos más importantes. La producción comercial de microtubérculos en sistemas de inmersión temporal podría representar un salto cualitativo en la obtención de material vegetal de plantación. Este estudio tuvo como objetivos determinar el efecto del tipo de explante y la frecuencia de inmersión en la formación y desarrollo de microtubérculos de papa cv. `Andinita' en sistemas de inmersión temporal. Se evaluó el efecto de tres frecuencias de inmersión (cada 2, 3 y 4 h) y tres tipos de explante (yemas apicales, primer y segundo segmento nodal). Cada recipiente de cultivo se inoculó con 100 explantes, para un total de nueve tratamientos con tres repeticiones cada uno. En todos los tratamientos con una inmersión cada 4 h se alcanzaron los mejores resultados con respecto a la altura de las plantas, mientras que, al combinar esta frecuencia de inmersión con el uso de yemas apicales, se obtuvo el mayor número de segmentos nodales por planta (10.5). En la etapa de tuberización más del 88% de los microtubérculos obtenidos presentaron un diámetro superior a 4.0 mm y una masa fresca que osciló entre 0.5 y 3.5 g. Se demostró que tanto la frecuencia de inmersión, como el tipo de explante influyeron en la calidad y número de microtubérculos producidos. Los mejores resultados se obtuvieron con una inmersión cada 4 h y yemas apicales como explante inicial con 4.9 microtubérculos por planta.
Palabras clave: frecuencia de inmersión, semilla, yemas apicales
ABSTRACT
The potato (Solanum tuberosum L.) is one of the most important crops. Commercial production of microtubers in temporary immersion systems could represent a qualitative step in the production of planting material. This study aimed to determine the effect of explant type and immersion frequency in the formation and development of microtubers of potato cv. `Andinita' in temporary immersion systems. The effect of three immersion frequencies (every 2, 3 and 4 h) and three types of explants (apical buds, first and second nodal segments) was evaluated. Each culture vessel was inoculated with 100 explants, for a total of nine treatments with three replicates each one. In all treatments with an immersion every 4 h were achieved best results with respect to height of the plants, whereas, by combining this immersion frequency and apical buds, was obtained the higher number of nodal segments per plant (10.5). In the tuberization stage over 88% of the microtubers obtained presented a diameter greater than 4.0 mm and a fresh mass that ranged between 0.5 and 3.5 g. It was shown that both the immersion frequency and the type of explant influenced the quality and number of microtubers produced. The best results were obtained with an immersion every 4 h and apical buds as initial explants with 4.9 microtubers per plant.
Key words: apical buds, immersion frequency, seed
INTRODUCCIÓN
La papa (Solanum tuberosum L.), es uno de los cultivos más importantes a nivel mundial. Su producción en el 2012 ocupó el cuarto lugar, después del maíz (Zea mays L.), el arroz (Oryza sativa L.) y el trigo (Triticum spp.) con una producción que alcanzó aproximadamente 365 millones de toneladas (FAOSTAT, 2013).
A partir de la selección de clones avanzados procedentes del Centro Internacional
de la Papa en Perú, en 1987 se liberó el cultivar `Andinita'
(Solanum tuberosum L. subsp. andigenum) para ser utilizado en
condiciones de los Andes Venezolanos con altitudes alrededor de 2 000 msnm.
Este cultivar, es uno de los más importantes para las zonas altas de
Venezuela debido a sus rendimientos y tolerancia a enfermedades (Alcalá
de Marcano et al., 1996) como por ejemplo su moderada resistencia a Phytophthora
infestans (Mont) que se considera el principal problema fitopatológico
de la papa en el país (García y Salas, 2005).
En el Laboratorio de Cultivo de Tejidos del Campo Experimental Mucuchíes (INIA-Mérida), este cultivar se ha propagando por técnicas biotecnológicas para la posterior obtención de semilla pre-básica en casas de cultivo (Mogollón et al., 2000; Lugo et al., 2009).
Además, se han utilizado Sistemas de Inmersión Temporal (SIT) para obtener microtubérculos (Igarza et al., 2011) de los cuales se han producido minitubérculos en casa de cultivo (Igarza et al., 2013) o se han sembrado directamente en campo (Igarza et al., 2014).Sin embargo, se requieren estudios que permitan profundizar en el efecto de cada uno de los factores que intervienen en la producción de microtubérculos en SIT.
Teniendo en cuenta lo anterior, el presente trabajo tuvo como objetivo determinar el efecto del tipo de explante y la frecuencia de inmersión en la producción de microtubérculos de papa cv. `Andinita' con dicho sistema de cultivo.
MATERIALES Y MÉTODOS
Material vegetal
Como material vegetal para inocular los SIT se emplearon plantas in vitro de papa cv. `Andinita' (Solanum tuberosum L. subsp. andigenum) libres de virus, establecidas y propagadas según el protocolo propuesto por Salas (1995) y que tenían entre tres y cinco subcultivos de multiplicación en medio de cultivo semisólido.
El proceso para obtener microtubérculos de papa cv. `Andinita' en SIT comprendió dos etapas. Una primera de crecimiento de las plantas in vitro y una segunda de tuberización.
El sistema de inmersión temporal utilizado siguió el mismo principio de funcionamiento que el descrito por Jiménez et al. (1999) con frascos de cultivo de 10 litros de volumen total, los cuales fueron esterilizados por 30 min a 121°C con 6.0 litros de medio de cultivo para la etapa de crecimiento y durante 40 min y similar temperatura, pero con 9.0 litros del medio de cultivo para la etapa de tuberización.
Etapa de crecimiento
Se evaluó el efecto de tres frecuencias de inmersión (cada 2, 3 y 4 h) y tres tipos de explantes: yemas apicales (ápices), 1er. y 2do. segmento nodal de aproximadamente de 1.0 cm, con la hoja completa en la respuesta in vitro de las plantas. En cada frasco de cultivo se inocularon 100 explantes, para un total de nueve tratamientos con tres repeticiones cada uno.
El medio de cultivo estuvo compuesto por las sales MS (Murashige y Skoog, 1962), complementado con 1.0 mg l-1 de tiamina-HCl, 100 mg l-1 de mio-inositol, 30 g l-1 de sacarosa, con el pH fue ajustado a 5.6 previo a la esterilización. El tiempo de inmersión se fijó en 2 min según lo descrito por Jiménez et al. (1999).
A las dos y cinco semanas de cultivo se describieron las características morfológicas de las plantas. Para ello, se tomaron como referencia los descriptores morfológicos de papa (Solanum tuberosum L.) (Huamán, 2007). Además, a las cinco semanas de cultivo se midió la altura de las plantas in vitro (cm) y se cuantificó el número de entrenudos por planta.
Etapa de tuberización
En esta etapa de formación de microtubérculos la concentración de sacarosa se incrementó a 80 g l-1 y el volumen de medio de cultivo a nueve litros por frasco. Se emplearon los mismos tratamientos que en la etapa de crecimiento.
Los SIT se mantuvieron por dos semanas en condiciones de iluminación similares a la etapa de crecimiento. Posteriormente, los frascos de cultivo se cubrieron individualmente con bolsas de tela de color negro y permanecieron en condiciones de oscuridad por siete semanas hasta la cosecha de los microtubérculos.
Al final del periodo, los microtubérculos cosechados fueron caracterizados morfológicamente mediante los descriptores propuestos por Huamán (2007). Además, se le midió el diámetro (cm), se determinó la masa fresca (g) y se cuantificó el número de microtubérculos por recipiente y por planta. A partir del diámetro todos los microtubérculos se clasificaron en cuatro grupos: menores de 4.0 mm, entre 4.0-6.9 mm, entre 7.0-10.0 mm y mayores de 10.0 mm.
Análisis y procesamiento estadístico
Se utilizó el paquete PASW Statistics 17, a los datos se le aplicaron pruebas de normalidad y homogeneidad de varianzas y en los casos en que no se cumplieron los supuestos de normalidad y homogeneidad de varianza se aplicó la prueba de Kruskall Wallis, mientras que, las medias entre los tratamientos se compararon mediante la prueba de Mann Whitney para p<0.05.
RESULTADOS Y DISCUSIÓN
Etapa de crecimiento
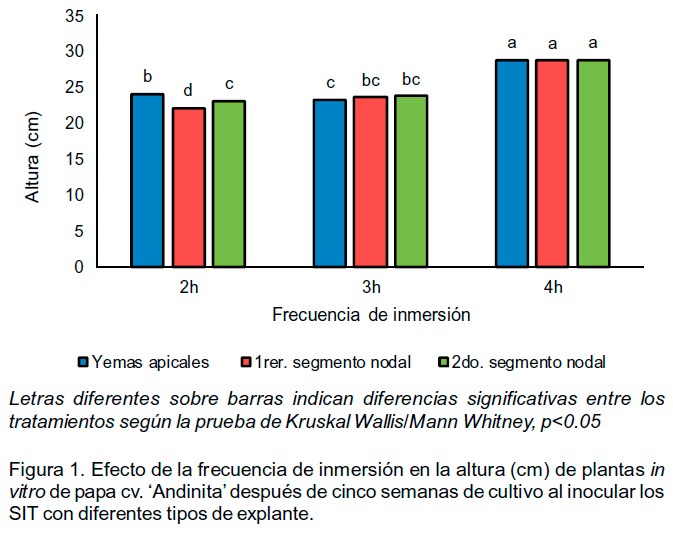
La aplicación de diferentes frecuencias de inmersión influyó en el crecimiento de las plantas in vitro en la etapa de crecimiento. Con una inmersión cada cuatro horas (seis inmersiones por día), independientemente del tipo de explante utilizado, se alcanzaron los mayores valores de altura (Figura 1), con diferencias significativas con respecto a los restantes tratamientos.
En todos los tratamientos inoculados con yemas apicales después de dos semanas de cultivo las plantas in vitro alcanzaron la mitad de la altura del frasco de cultivo, a diferencia de los tratamientos inoculados con el 1er. y 2do. segmentos nodales que solo llegaban hasta aproximadamente un 25% de la altura del frasco. Sin embargo, a las cinco semanas de cultivo estas diferencias solo se observaron entre los diferentes tipos de explantes inoculados en el tratamiento con una inmersión cada dos horas.
En todos los casos también se observó que después de la primera semana de cultivo las plantas obtenidas a partir de yemas apicales presentaron desarrollo de raíces. En los SIT las plantas in vitro son sometidas a una inmersión en medio de cultivo líquido con una determinada frecuencia diaria y tiempo de inmersión (Teisson et al., 1996). A diferencia de los sistemas de cultivo estáticos, el medio de cultivo sólo está en contacto con la planta por un corto periodo de tiempo y cuando se retira, las diferentes partes de las plantas quedan cubiertas por una fina película de medio de cultivo que impide la desecación del tejido y mejora la asimilación de los nutrientes por parte de la planta (Etienne y Berthouly, 2002; Escalona, 2006). La frecuencia con que las plantas se ponen en contacto con el medio de cultivo condiciona no solo su nutrición sino también las características de la atmósfera interna del recipiente de cultivo que en cada inmersión se renueva cuando se impulsa el medio de cultivo del recipiente reservorio al de las plantas in vitro (Berthouly y Etienne, 2005).
Se observó además, que las plantas obtenidas con una inmersión de medio de cultivo cada cuatro horas, desarrollaron entre tres y cinco nuevos tallos a partir de sus yemas axilares, a diferencia de las plantas que se obtuvieron con una inmersión cada dos horas, en las cuales no se estimuló la brotación de estas yemas. El tratamiento con una inmersión cada tres horas produjo una respuesta intermedia en cuanto a la brotación de las yemas axilares y la formación de nuevos tallos.
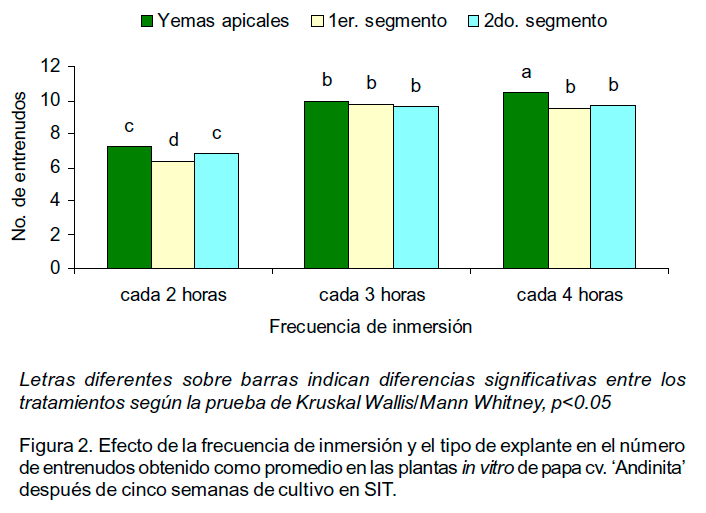
La frecuencia de inmersión también influyó en el número de segmentos nodales por planta (Figura 2). Los mejores resultados se obtuvieron al combinar una inmersión cada cuatro horas y plantas obtenidas a partir de yemas apicales.
Los procesos fisiológicos como la brotación de yemas y el desarrollo de nuevos tallos en plantas de papa están mediados, entre otros factores, por la acción y el balance de determinados reguladores del crecimiento (Taiz y Zerger, 2010). Para obtener microtubérculos de papa cv. `Andinita' no se incluyeron dichas sustancias en el medio de cultivo y todos los tratamientos estuvieron sometidos a similares condiciones de cultivo (tiempo de inmersión, iluminación, temperatura, volumen de medio de cultivo, composición del medio de cultivo, fotoperíodo) excepto la frecuencia de inmersión y el tipo de explante. No obstante, en las plantas obtenidas con una inmersión cada cuatro horas, independientemente del explante utilizado, se observaron cambios morfológicos en la etapa de crecimiento. Entre ellos, el desarrollo de nuevos tallos laterales, mayor número de entrenudos y crecimiento en longitud de las plantas en comparación con las obtenidas con una inmersión cada dos horas. Esta respuesta pudiera relacionarse con modificaciones del balance endógeno de reguladores del crecimiento en la planta, inducidas por las condiciones de cultivo, donde la frecuencia de inmersión fue el factor determinante. Según Cañal et al. (2001) muchas de las características fisiológicas y morfológicas de las plantas formadas in vitro están influenciadas por el ambiente físico, químico y gaseoso de los recipientes de cultivo. En este sentido, Pérez-Alonso et al. (2001) informaron que las plantas de papa (Solanum tuberosum subsp. tuberosum) cv. `Atlantic' cultivadas en SIT incrementaron la altura en aproximadamente tres veces y el número de entrenudos en más de dos veces comparadas con plantas cultivadas en medio de cultivo semisólido. Por su parte, Lugo et al. (2009) observaron que en plantas in vitro de papa cv. `Andinita' multiplicadas en medio de cultivo semisólido y con bajo intercambio gaseoso, el número de entrenudos fue mayor que en aquellas cultivadas con similar medio de cultivo pero en recipientes con alto intercambio.
Después de cinco semanas de cultivo, las plantas in vitro presentaron características morfológicas de los foliolos laterales primarios similares a las obtenidas en medio de cultivo semisólido de donde se tomaron los explantes iniciales. Sin embargo, las plantas en los SIT también presentaron foliolos laterales secundarios, lo que demostró que su desarrollo vegetativo era más avanzado que el de las plantas obtenidas en medio de cultivo semisólido en similar período de tiempo.
De acuerdo con los descriptores morfológicos de papa (Huamán, 2007) las hojas de las plantas in vitro del cv. `Andinita' se observaron expandidas y bien desarrolladas, con foliolos laterales primarios separados, foliolo terminal anchamente elíptico y el ápice del foliolo terminal redondeado, lo cual coincidió con las características de este cultivar en condiciones ex vitro.
Las plantas in vitro cultivadas en los SIT también presentaron tallos visiblemente más gruesos que las desarrolladas en medio de cultivo semisólido, con un color verde intenso.
Etapa de tuberización
Durante las dos semanas que las plantas permanecieron bajo fotoperíodo de 16 horas luz en la etapa de tuberización, no se observaron cambios de coloración en las hojas, pero sí un incremento en el desarrollo de las raíces.
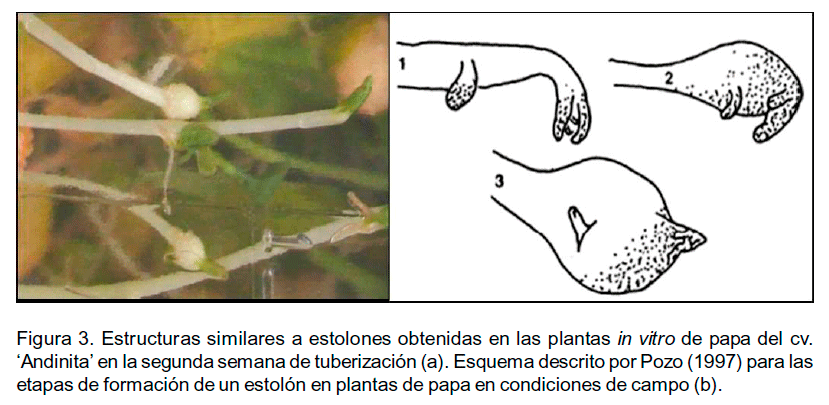
Se observó, además, engrosamiento de los tallos y una disminución paulatina en su coloración. En la segunda semana se logró distinguir la presencia de estructuras similares a estolones y se distinguieron todas las etapas de su desarrollo (inducción, iniciación y crecimiento) (Figura 3). La inducción y formación de estolones en plantas in vitro de papa que tuberizan in vitro, se ha descrito por diferentes autores (Salas et al., 2003, Lugo et al., 2009). Los estolones en condiciones naturales son tallos subterráneos que crecen en posición más o menos horizontal. Ante determinadas señales inductoras de la tuberización en su extremo subapical comienza un engrosamiento que concluye con la formación del tubérculo (Pozo, 1997). Este proceso de tuberización que se origina a partir de los estolones comprende una serie de etapas de desarrollo que involucran el cese de crecimiento en el ápice, el engrosamiento de los estolones por crecimiento radial subapical y la inducción divisiones celulares longitudinales y más tarde divisiones orientadas al azar (Xu et al., 1998). Este último proceso es acompañado por la acumulación de almidón y proteínas de almacenamiento y requiere cambios transcripcionales y metabólicos coordinados (Kloosterman et al., 2008).
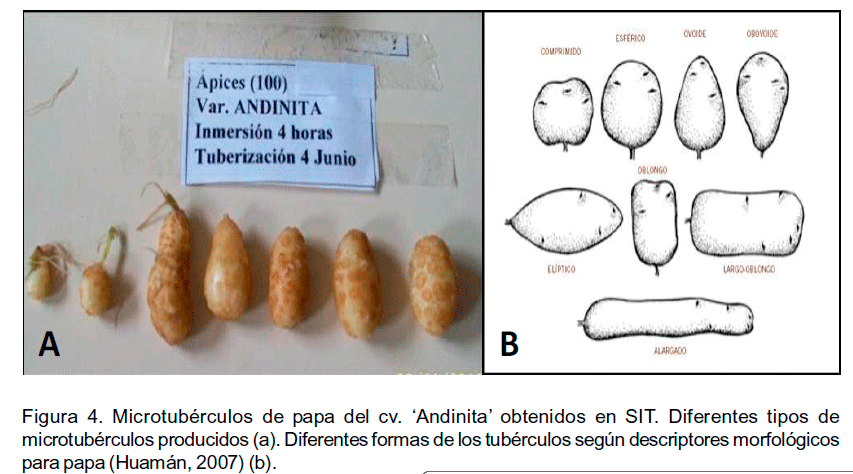
Después de siete semanas de cultivo a la oscuridad, las plantas in vitro mostraron clorosis y pérdida de algunas hojas. Los microtubérculos se formaron tanto en la base de las yemas axilares como en el extremo de los estolones. Además, se observaron diferentes formas de los microtubérculos de acuerdo con los criterios establecidos en los descriptores de papa por Huamán (2007) (Figura 4). Los de diámetro más pequeño tenían forma esférica, el resto mostraba características de obovoide, elíptico o largo oblongo, estos últimos fueron los que predominaron.
En los tratamientos con el mayor número de inmersiones (cada 2 h, 12 inmersiones por día), los microtubérculos mostraron mayor diversidad de formas. En muchos de ellos se observó brotación de las yemas y algunos presentaron un mayor contenido de agua, lo cual puede ser negativo durante el proceso de conservación pues se deshidratan.
En este sentido, Cabrera et al. (2009) observaron que al producir microtubérculos de ñame (Dioscorea alata L.) en SIT y aumentar el número de inmersiones de cuatro a ocho veces por día y en consecuencia incrementarse el contacto del medio de cultivo con los explantes, se produjeron microtubérculos de menor calidad caracterizados por una mayor consistencia acuosa. Según Etienne y Berthouly (2002) el tiempo de inmersión determina la toma de nutrientes y la presencia de síntomas de hiperhidricidad en las plantas.
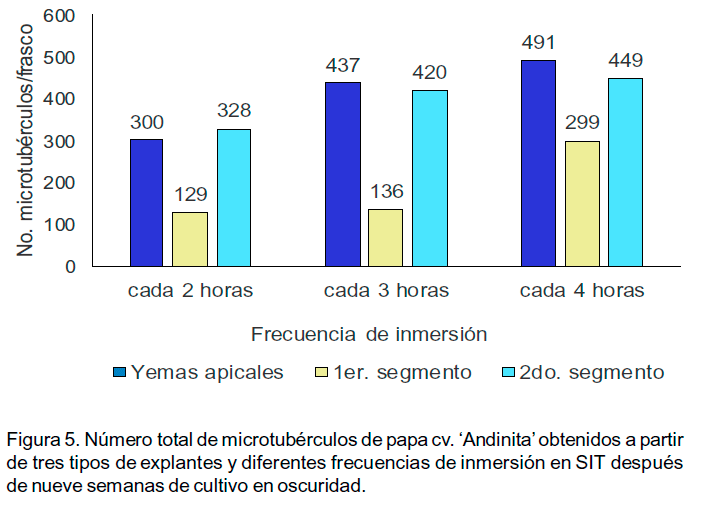
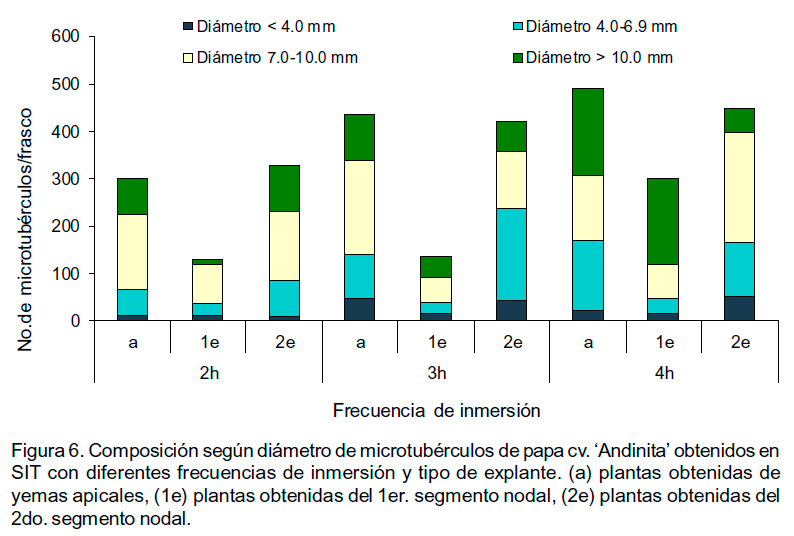
El número de microtubérculos por frasco de cultivo osciló entre 129 y 491 en dependencia del tratamiento (Figuras 5 y 6). Se observaron microtubérculos en todas las categorías establecidas de acuerdo con la escala predeterminada que considera el diámetro. Estos se ubicaron desde la base de la planta hasta la zona media, pero, su formación predominó en la zona basal de la planta.
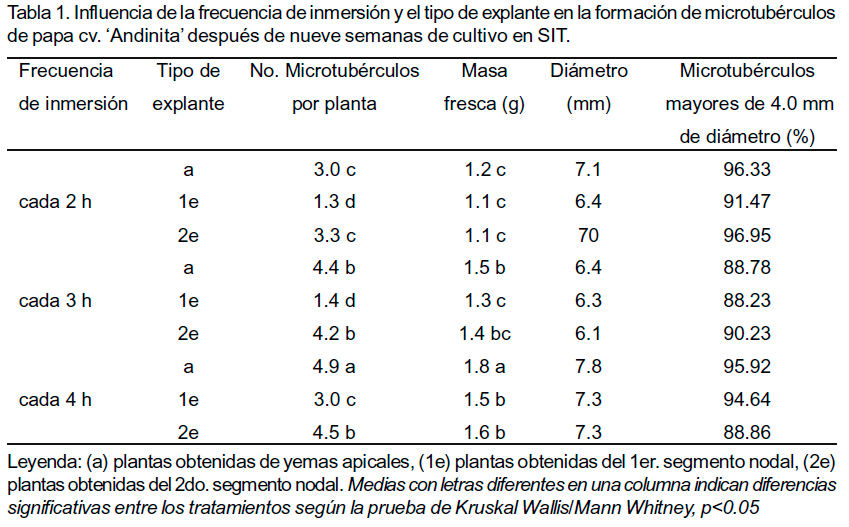
Por otra parte, se comprobó que la frecuencia de inmersión también influyó sobre el número de microtubérculos por planta y su masa fresca. El tratamiento con la mejor respuesta en la etapa de crecimiento (plantas procedentes de yemas apicales y sometidas a inmersiones cada 4 h), también produjo el mayor número de microtubérculos por planta y con mayor masa fresca. Más del 88.0% de los microtubérculos en todos los tratamientos tenían más de 4.0 mm. El número de microtubérculos por planta en todas las frecuencias de inmersión fue significativamente inferior en aquellas procedentes del primer segmento nodal. La variable diámetro de los microtubérculos no mostró diferencias significativas entre los tratamientos (Tabla1). Los microtubérculos con menos de 4.0 mm de diámetro variaron entre 1.1 y 3.9 mm, mientras que los mayores de 10 mm llegaron a alcanzar hasta 18 mm.
Se demostró
que las condiciones de cultivo de las plantas in vitro influyeron en
el resultado de la formación de microtubérculos. El uso de SIT
posibilitó obtener resultados superiores en variables como el número
de microtubérculos por planta, la masa fresca y el diámetro, con
respecto a los resultados informados previamente para este mismo cultivar, pero
con el empleo de medio de cultivo en estado semisólido (Mogollón
et al., 2000; Salas et al., 2003; Lugo et al., 2009). En
este estudio, en todos los tratamientos la masa fresca promedio de los microtubérculos
fue mayor a 1.0 g y el diámetro promedio osciló entre 6.1 y 7.8
cm. En los microtubérculos mayores de 4.0 mm la masa fresca tuvo un valor
mínimo de 0.5 g y en los mayores de 10 mm alcanzó hasta 3.5 g.
Por otra parte, en los microtubérculos menores de 4.0 mm los valores
oscilaron entre 0.1-0.5 g, para microtubérculos entre 4.0-6.9 mm osciló
entre 0.5 a 1.2 g, en los de 7.0 a 10 mm varió de 1.2 a 1.8 g y en los
mayores de 10 mm osciló desde 1.8 a 3.5 g.
A la masa fresca
de los microtubérculos se le concede gran importancia, ya que se ha comprobado
que aquellos con menos de 0.5 g no resultan adecuados para su plantación
directa en casa de cultivo o campo (Lommen y Struik, 1994) debido entre otros
factores a su deshidratación en el almacenamiento y a la lenta brotación.
En este sentido, Ranalli (1997) señaló que el diámetro
y la masa fresca de los microtubérculos están correlacionados
con la duración del período de dormancia. Según este investigador,
los tubérculos pequeños, menores de 0.5 g experimentan deshidratación
cuando son almacenados por un período de tiempo prolongado.
Existen algunos autores que refieren el diámetro del tubérculo como la característica de referencia que indica su calidad ya que es más sencilla de determinar que la masa fresca; esta variable se conoce entre los productores como calibre. Sin embargo, se requiere determinar si existe relación entre la masa fresca y diámetro de los tubérculos para cada cultivar ya que los tubérculos pueden variar en forma y consistencia según las condiciones de cultivo y el genotipo. Atendiendo a estos criterios, en este trabajo se constató que deberían emplearse tanto la masa fresca como el diámetro ya que los microtubérculos agrupados por diámetro diferían significativamente en su masa fresca (Tabla 1).
Estos resultados sin lugar a dudas evidencian cuan superior puede llegar a ser la calidad en general de los microtubérculos obtenidos en SIT si se comparan los resultados con los obtenidos con el mismo cultivar pero en medio de cultivo semisólido y líquido estático o una combinación de estas alternativas donde en ninguno de los casos la masa fresca de un microtubérculo superó 1.0 g (Salas, 1995; Mogollón et al., 2000; Lugo et al., 2009).
Sin embargo, incluso con el empleo de los SIT se han descrito resultados diferentes en relación con la masa fresca y el porcentaje de microtubérculos aprovechables que se pueden obtener. Por ejemplo, Jiménez et al. (1999), informaron que con ocho inmersiones por día y cinco minutos de inmersión, se logró 1.3 g de masa fresca como promedio en microtubérculos de papa del cv. `Atlantic' con un 62% de estos mayores de 6.0 mm, mientras que para el cv. `Desirée' obtuvieron un 72% de microtubérculos mayores de 6.0 mm. Por su parte, Pérez-Alonso et al. (2001), al emplear el mismo equipamiento, con la misma frecuencia de inmersión pero menor tiempo de inmersión (2 min), obtuvieron microtubérculos con una masa fresca promedio de 0.9 g con un 95% de los mismos aprovechables (mayores de 4.0 mm).
En general, se ha señalado que los microtubérculos con un diámetro mayor a 4.0 mm tienen mayores posibilidades de conservarse en condiciones de cámaras refrigeradas, facilitan su manipulación y presentan una mejor brotación, lo que permite su plantación directa en campo sin necesidad de brotarlos en un área de aclimatización (Pérez-Alonso et al., 2001). En este estudio se logró más de un 88% de microtubérculos con estas características en todos los tratamientos.
Aunque en la literatura científica no abundan los trabajos sobre la obtención de microtubérculos de papa en SIT, los resultados descritos refieren diferentes valores en cuanto al número de microtubérculos por frasco de cultivo, un resultado condicionado por factores tales como el tipo de recipiente, las condiciones de cultivo empleadas, la densidad de explantes por recipiente, el genotipo, etc. Por ello, es difícil establecer comparaciones y se debería de hacer énfasis en presentar variables que se correlacionaran con la posible eficiencia del sistema empleado y no dejar de hacer referencia al número de microtubérculos por planta, así como el diámetro y la masa fresca promedio, incluyendo quizás qué porcentaje de los obtenidos superó los 4.0 mm de diámetro.
CONCLUSIONES
Se corroboró la influencia de la frecuencia de inmersión y el tipo de explante en la producción de microtubérculos de papa cv. Andinita' en Sistemas de Inmersión Temporal. Los mejores resultados se obtuvieron con inmersiones cada cuatro horas y el uso de yemas apicales como explante inicial con un promedio de 4.9 microtubérculos por planta, resultado superior a los descritos hasta el presente en la literatura científica para este mismo cultivar en condiciones estáticas y medio de cultivo semisólido. Más del 88% de los microtubérculos tuvieron un diámetro mayor de 4.0 mm y su masa fresca osciló entre 0.5 y 3.5 g.
REFERENCIAS
Alcalá de Marcano D, Salas JA, Pire A, Narváez D (1996) Aceptación de la variedad Andinita por productores de papa del estado Lara. FONAIAP Divulga No. 53. [En línea] Disponible en: http://sian.inia.gob.ve/repositorio/revistas_tec/FonaiapDivulga/fd53/papa.htm. Consultado el 22 de enero de 2012
Berthouly M, Etienne H (2005) Temporary immersion systems: a new concept for use liquid medium in mass propagation. p. 165-195. En: Hvoslef-Eide AK, W Preil (Eds.). Liquid Culture Systems on in vitro plant propagation. Springer. Dordrecht.
Cabrera M, Gómez R, Rayas A, de Feria M, López J, Basail M, Medero V (2009) Protocolo para la formación de microtubérculos de ñame (Dioscorea alata L.) en Sistema de Inmersión Temporal. Rev Colombiana Biotecnología 2: 19-30
Cañal MJ, Rodríguez R, Fernández B, Sánchez-Tames R, Majada PR (2001) Fisiología del cultivo in vitro. Biotecnología Vegetal 1 (1): 3-9
Escalona M (2006) Temporary immersion beats traditional techniques on all fronts. Prophyta Annual. 48-49
Etienne E, Berthouly M (2002) Temporary immersion systems in plant micropropagation. Plant Cell Tissue and Organ Culture 69: 215-231
FAOSTAT (2013) Venezuela Producción de Papa. [En línea] Disponible en: http://www.faostat.org/ Consultado el 22 de enero de 2014
García, R, Salas J (2005) Aspectos generales del cultivo de la papa. En: García R, Salas J, Ramos G (Eds.). Producción de Semilla de Papa en Venezuela. Serie Manuales de Cultivo No. 5, pp.18-29. INIA. Mérida
Huamán Z (2007) Descriptores morfológicos de la papa (Solanum tuberosum L.). Centro de la conservación de la biodiversidad agrícola de Tenerife. Tenerife.
Igarza Janet, de Feria Manuel, Alvarado-Capó Yelenys, Pugh Tatiana, Pérez Miguel, San Roman Mario, Agramonte Daniel (2014) Caracterización morfo-agronómica de plantas de papa cv. `Andinita' a partir de la siembra en campo de microtubérculos obtenidos en sistemas de inmersión temporal. Biotecnología Vegetal 14 (2): 81 89
Igarza Janet, de Feria Manuel, Alvarado-Capó Yelenys, Pugh Tatiana, Pérez Miguel, San Roman Mario, Agramonte Daniel (2013) Empleo de microtubérculos de papa cv. `Andinita' obtenidos en Sistemas de Inmersión temporal para producir minitubérculos en casa de cultivo. Biotecnología Vegetal 13 (4): 209 217
Igarza Janet, de Feria Manuel, Alvarado-Capó Yelenys, Pugh Tatiana, Pérez Miguel, San Roman Mario, Agramonte Daniel (2011) Obtención de microtubérculos de papa cv. `Andinita' en Sistemas de Inmersión Temporal. Biotecnología Vegetal 11 (1): 59 -62
Jiménez E, Pérez N, de Feria M, Barbón R, Capote A, Chávez M, Quiala E, Pérez JN (1999) Improved production of potato microtubers using a temporary immersion system. Plant Cell Tissue and Organ Culture 59: 19-23
Kloosterman B, D De Koeyer, R Griffiths, B Flinn, B Steuernayel, V Scholz (2008) Genes driving potato tuber initiation and growth: identification based on transcriptional changes using the POCI array. Functional and Integrative Genomics 8: 329-340
Ku SB, GE Edwards, CB Tanner (1977) Effects of light, carbon dioxide, and temperature on photosynthesis, oxygen Inhibition of photosynthesis, and transpiration in Solanum tuberosum. Plant Physiology 59: 868-872
Lommen WJ, PC Struik (1994) Field performance of potato minitubers with different fresh weights and conventional seed tubers: crop establishment and yield formation. Potato Research 37: 301-313
Lugo JG, N Mogollón, ZF Rodríguez, JG Díaz (2009) Efecto del intercambio gaseoso sobre el crecimiento y tuberización de vitroplantas de papa Rev. Fac. Agron 26: 325-339
Mogollón N, M Gallardo, N Hernández (2000) Effects of benzylaminopurine, sucrose and culture method on microtuberization of potatoes (Solanum tuberosum L.) cv. Andinita. Proceedings of the Interamerican Society for Tropical Horticulture 42: 451-455
Murashige T, F Skoog (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497
Pérez-Alonso N, M de Feria, E Jiménez, A Capote, M Chávez, E Quiala (2001) Empleo de sistemas de inmersión temporal para la producción a gran escala de tubérculos in vitro de Solanum tuberosum L. cv. Atlantic y estudio de su comportamiento en campo. Biotecnología Vegetal 1: 17-21
Pozo CM (1997) Producción de Tubérculos-semillas de Papa. Manual de Capacitación. Fascículo 2.3 Tuberización, tamaño de la semilla y corte de tubérculos. Centro Internacional de la Papa. Lima
Ranalli P (1997) Innovative propagation methods multiplication programmes in seed tuber. Potato Research 40: 439-453
Salas JE (1995) Producción de semilla pre-básica de Papa. FONAIAP Divulga No. 48 [En línea] Disponible en: http://sian.inia.gob.ve/repositorio/revistas_tec/FonaiapDivulga/fd48/texto /prodpapa.htm. Consultado el 22 de enero de 2012
Salas JE, N Mogollón, ME Sanabria (2003) Anatomía de estructuras vegetativas y origen de los estolones, microtubérculos y raíces adventicias en plantas in vitro de papa (Solanum tuberosum L.) cv. Granola. Rev. Fac. Agron. 20(2): 131-143
Taiz L, E Zeiger (2010) Plant Physiology. Fifth Edition. Sinauer Associates. Sunderland. MA
Teisson C, D Alvard, B Berthouly, F Cote, JV Escalant, H Etienne, M Lartaud (1996) Simple apparatus to perform plant tissue culture by temporary immersion. Acta Horticulturae 440: 521-526
Xu X, AA M van Lammeren, E Vermeer, D Vreugdenhil (1998) The Role of gibberellin, abscisic acid, and sucrose in the regulation of potato tuber formation in vitro. Plant Physiology 117 (2): 575-584
Recibido: 17-09-2014
Aceptado:
14-01-2015
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.