COMUNICACIÓN CORTA
Biotecnología
Vegetal Vol. 15, No. 2: 123 - 126, abril - junio, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto del sulfato de adenina en la formación de brotes
de Phaseolus vulgaris L. cultivar `CIAP7247F' vía organogénesis
indirecta
Adenine sulfate effect on shoot formation of Phaseolus vulgaris L. cultivar `CIAP7247F' via indirect organogenesis
Novisel Veitía*, Lourdes R García, Amanda Martirena-Ramírez, Idalmis Bermúdez-Caraballoso, Raúl Collado, Damaris Torres, Carlos Romero. *Autora para correspondencia
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara, Villa Clara. Cuba. CP 54 830. e-mail: novisel@ibp.co.cu
RESUMEN
El presente trabajo tuvo como objetivo determinar el efecto del sulfato de adenina en la regeneración de plantas a partir de callos de P. vulgaris cultivar `CIAP 7247F'. Para ello, se adicionó al medio de cultivo de regeneración dos concentraciones (20 y 40 mg l-1) de sulfato de adenina y se incluyó un control para conformar un total de tres tratamientos. Se cuantificó el número de brotes por tratamiento formados en el medio de cultivo de regeneración y en la elongación se midió la altura de los brotes. Se determinó que el empleo de 40 mg l-1 de sulfato de adenina en el medio de cultivo incrementó el número de brotes por callo. En el presente trabajo se demostró que la adición de sulfato de adenina estimuló la formación y elongación de brotes a partir de callos organogénicos de frijol común cultivar `CIAP 7247F'.
Palabras clave: callos, cultivo de tejidos, frijol común, regeneración in vitro
ABSTRACT
This study aimed to determine the effect of adenine sulfate in plant regeneration from callus of Phaseolus vulgaris L. cultivar `CIAP 7247F'. To this, it was added two concentrations (20 and 40 mg l-1) adenine sulfate to the regeneration culture medium and it was included a control to form a total of three treatments. The number of formed shoots was quantified by treatment in the regeneration culture medium and the height of shoot was measured in elongation medium. It was determined that the use 40 mg l-1 adenine sulfate in the culture medium increased the number of shoots per callus. In the present study it was demonstrated that the addition of adenine sulfate stimulated the formation and elongation of shoots obtaining from organogenic callus in common bean cultivar `CIAP 7247F'.
Key words: callus, common bean, in vitro regeneration, tissue culture
INTRODUCCIÓN
La obtención de nuevas variedades de frijol (Phaseolus vulgaris L.) ha sido un objetivo fundamental en los programas de mejoramiento genético debido a la demanda del producto a nivel mundial. Sobre esta base, la biotecnología vinculada con estos programas permite acortar el tiempo de duración de los mismos. Las investigaciones encaminadas a desarrollar protocolos de regeneración de plantas con el empleo del cultivo de tejidos se han potenciado en los últimos años. En frijol común mediante la vía de organogénesis indirecta existían tres protocolos poco repetibles e ineficientes (Arellano et al., 2009).
En el Instituto
de Biotecnología de las Plantas se ha desarrollado un protocolo regeneración
de plantas vía organogénesis indirecta aplicado
a cinco cultivares de frijol común (Collado et al., 2013). Sin
embargo, es necesario optimizarlo para aumentar el crecimiento y vigor de las
plantas antes de ser llevadas a casa de cultivo. De acuerdo con lo anterior,
el presente trabajo tuvo como objetivo determinar el efecto del sulfato de adenina
en la regeneración de plantas a partir de callos de P. vulgaris
cultivar `CIAP 7247F'.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon callos de Phaseolus vulgaris L. cultivar `CIAP 7247F' formados a partir de semillas frescas.
Para el desarrollo de los experimentos se utilizó el protocolo de regeneración de plantas vía organogénesis indirecta descrito por Collado et al. (2013). Se establecieron cinco tratamientos los cuales fueron:
· medio de cultivo de regeneración con 20 mg l-1 de sulfato de adenina (SA-20),
· medio de cultivo de regeneración con 40 mg l-1 de sulfato de adenina (SA-40),
· medio de cultivo de regeneración (control).
Una vez regenerados los brotes fueron colocados en el medio de cultivo de elongación. Los medios de cultivo de formación y multiplicación de callos, así como los de inducción y elongación de brotes empleados, fueron los propuestos por Collado et al. (2013).
En todas las etapas del protocolo las plantas fueron colocadas en cámaras de crecimiento a 25±2oC, con fotoperiodo de 16 horas luz/8 de oscuridad. Para la iluminación de la cámara se emplearon lámparas fluorescentes con una intensidad 45 µmol m-2 s-1. Se utilizaron frascos de vidrio de 250 ml de volumen y se colocaron cuatro callos por frasco de cultivo.
Las evaluaciones consistieron en cuantificar el número de brotes por callo colocado en el medio de cultivo de regeneración durante 21 días y se midió la altura de las plantas (cm) a los 14 días en el medio de cultivo de elongación.
Análisis estadístico
Para el análisis estadístico de los datos relacionados con el número de brotes por callo y la altura de las plantas se empleó la prueba de Kruskall Wallis/Mann Whitney para p<0.05, previa comprobación de los supuestos de normalidad y heterogeneidad de varianza. Se empleó el paquete estadístico SPSS (Statistical Package for Social Science) versión PASW Statistic 21.
RESULTADOS Y DISCUSIÓN
Con el empleo del sulfato de adenina se logró incrementar el número de brotes por callo en medio de cultivo de regeneración. Los mayores valores en el número de brotes por callo se lograron con el empleo de 40 mg l-1 de sulfato de adenina en el medio de cultivo con diferencias significativas con los otros dos tratamientos (Figura 1).
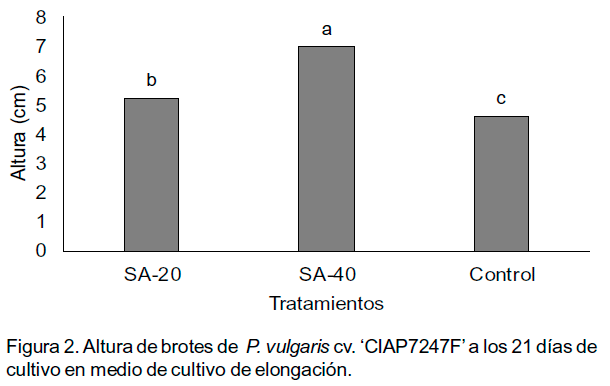
De igual manera fue la respuesta en cuanto a la altura de los brotes procedentes de las dos concentraciones de sulfato de adenina. Los mayores valores de altura de los brotes se presentaron en aquellos que fueron regenerados en el medio de cultivo que contenía 40 mg l-1 de sulfato de adenina con diferencias significativas con los procedentes tratamientos. Estos dos últimos también difirieron significativamente entre ellos con los valores más bajos de altura de los brotes para el tratamiento control (Figura 2).
Los brotes elongados procedentes de los medios de cultivo de regeneración que contenían sulfato de adenina presentaron una coloración verde más intensa que los procedentes del tratamiento control (Figura 3).
El sulfato de adenina se ha empleado previamente en la obtención de brotes de frijol común pero con resultados variables. En este sentido, Gaticas et al. (2010), lograron incrementar el número de brotes en cinco variedades mexicanas de frijol común regeneradas vía organogénesis directa con el empleo de sulfato de adenina. Ellos encontraron que de cinco genotipos estudiados tres alcanzaron los mayores valores en el número de brotes con el empleo de 40 mg l-1 y dos con 20 mg l-1. Por el contrario, Quintero-Jiménez et al. (2010), no observaron diferencias cuando se incluyó adenina en los medios basales en la formación de yemas o el desarrollo de brotes en cuatro cultivares de P. vulgaris vía organogénesis directa. Los resultados del presente trabajo en organogénesis indirecta coinciden con los descritos por García et al. (2012) para este mismo cultivar `CIAP 7247F' de P. vulgaris. Estos autores lograron un incremento en el número y la altura de brotes regenerados pero vía organogénesis directa con el empleo de 20 mg l-1 y afirmaron el beneficio de incorporar en el medio de cultivo el sulfato de adenina. También describieron una coloración verde más intensa en las hojas de las plantas regeneradas in vitro.
El reforzamiento de la actividad de la citoquinina o el incremento en el crecimiento de brotes ha sido demostrado con el empleo de adenina o sulfato de adenina incorporado al medio de cultivo. En este sentido, la adenina estimula la embriogénesis y la callogénesis, incrementa el crecimiento en ápices meristemáticos, induce la proliferación de brotes y promueve la formación de brotes adventicios a partir de callos o directamente del explante (van Staden et al., 2008; Gatica et al., 2010).
En la presente investigación se logró incrementar el número de brotes y la altura de los brotes con el empleo de sulfato de adenina en el medio de cultivo de regeneración de brotes de P. vulgaris cultivar `CIAP 7247F'. Lo anterior incrementa las posibilidades del uso del protocolo de regeneración in vitro en el mejoramiento genético del frijol común.
REFERENCIAS
Arellano J, Fuentes SI, Castillo-Espana P, Hernández G (2009) Regeneration of different cultivars of common bean (Phaseolus vulgaris L.) via indirect organogenesis. Plant Cell Tiss. Organ Cult. 96: 1118
Collado R, Veitía N, Bermúdez-Caraballoso I, García LR, Torres D, Romero C, Rodríguez Lorenzo JL, Angenon, G (2013) Efficient in vitro plant regeneration via indirect organogenesis for different common bean cultivars. Scientia Horticulturae 153: 109116
Delgado-Sánchez, P, Saucedo-Ruiz M, Guzmán-Maldonado SH, Villordo-Pineda E, González Chavira M, Fraire-Velázquez S, Acosta-Gallegos JA, Mora-Avilés A (2006) An organogenic plant regeneration system for common bean (Phaseolus vulgaris L). Plant Science 170: 822827
García L, Bermúdez-Caraballoso I, Veitía N, Collado R, Torres D, Romero C (2009) Efecto del sulfato de adenina en la regeneración y elongación de brotes de frijol. Biotecnología Vegetal 12 (1): 59 -62
Gatica Arias AM, Muños Valverde J, Ramírez Fonseca P, Valdez Melara M (2010) In vitro plant regeneration system for common bean (Phaseolus vulgaris): effect of N6-benzylaminopurine and adenine sulphate. Electronic Journal of Biotechnology 13:18
van Staden J, Zazimalova E, George EF (2008) Plant Growth Regulators II: Cytokinins, their Analogues and Antagonists. En: George EF, Hall MA, Geert-Jan De Klerk (Eds) Plant Propagation by Tissue Culture 3rd Edition. Volume I. The Background, pp. 213216. Springer. Dordrecht
Recibido: 25-11-2014
Aceptado:
02-02-2015
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.