ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 12, No. 3: 165 - 171 , julio - septiembre, 2012
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
ISSN 1609-1841, RNPS: 0397 (Versión impresa)
Caracterización morfológica y anatomía foliar de Bambusa vulgaris en fase de aclimatización
Foliar anatomy and morphological characterization of Bambusa vulgaris in the acclimatization phase
Ortelio Hurtado*, Marisol Freire-Seijo, Michel Leiva-Mora, Yudith García-Ramírez. *Autor para correspondencia.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas.
RESUMEN
El presente estudio se realizó con el objetivo de lograr la caracterización morfológica y anatómica durante la fase de aclimatización de plantas cultivadas in vitro de Bambusa vulgaris Schrad. ex Wendl. Para ello se consideró el desarrollo morfológico de la hoja y la raíz, en plantas aclimatizadas con 0 y 90 días de plantadas, así como a plantas de campo con más de 15 años de plantadas. Entre los principales resultados se pudieron constatar diferencias entre las estructuras de la lámina foliar en los períodos ensayados. Ambos presentaron epidermis adaxial y abaxial monoestratificadas, con existencia de tricomas, estomas, micropelos en la zona intercostal. La superficie abaxial mostró células de sílice y papilas. En el análisis de la sección transversal de la lámina foliar de B. vulgaris se pudo observar células buliformer y fusoides, constatando la presencia del xilema, floema, epidermis, cutícula, los haces vasculares, el clorénquima presentando diferencias entre las etapas de desarrollo. En el corte longitudinal realizado a la unión tallo raíz se pudo demostrar que existía un mayor desarrollo en las plantas con 90 días aclimatizadas.
Palabras clave: bambú, epidermis, estomas, lámina foliar, tricomas.
ABSTRACT
This study was aimed to achieve the morphological and anatomical characterization of in vitro plants of Bambusa vulgaris Schrad. ex Wendl during acclimatization. The morphological development of the leaf and root in plants acclimatized with 0 and 90 days after planting, as well as field plants with more than 15 years of planting were considered. Results showed important differences between the structures of the leaf in the evaluated periods. Both presented adaxial and abaxial monostratified epidermis, with presence of trichomes, stomata, micro-hairs in the intercostal area. The abaxial surface showed silica and papilla cells. In the analysis of the cross section of leaf blade B. vulgaris were observed bulliform and fusoid cells, confirming the presence of the xylem, phloem, epidermis, cuticle, vascular bundles, the chlorenchyma showing differences among the development stages. The longitudinal cut to the root-stem junction demonstrated a further development in plants acclimatized for 90 days.
Key words: bamboo, trichomes, leaf blade, stomata, epidermis.
INTRODUCCIÓN
Los bambúes son especies protectoras del ambiente. La sujeción al sustrato, mediante sus raíces y rizomas, evita la erosión y elimina las cárcavas. Además, contribuyen a embellecer el paisaje y a descontaminar la atmósfera. Es un procesador del dióxido de carbono (CO2) y poseen gran importancia en la conservación de los recursos hídricos. En Cuba, los bambúes crecen a lo largo de todo el territorio nacional mostrando gran adaptabilidad. La especie Bambusa vulgaris Schrad. ex Wendl se conoce como la más adaptada y abundante en el territorio.
Los recursos maderables en Cuba son escasos, lo que hace necesario la búsqueda de recursos rápidamente renovables. Las técnicas biotecnológicas son una alternativa para la propagación acelerada del cultivo del bambú en condiciones in vitro, ya que las vías tradicionales de propagación son limitadas; debido a que la regeneración sexual ocurre estacionalmente por medio de semillas. De manera asexual, puede propagarse por la activación de las yemas del rizoma o mediante tallos jóvenes. Esta última vía de propagación es la más empleada pero afecta sensiblemente el número de tallos disponibles para la cosecha y es extremadamente trabajosa. Por estas razones, se hace necesaria la regeneración y multiplicación de plantas in vitro, como una alternativa a la propagación vegetativa (Daquinta, 2003). La identificación de los bambúes, es un poco diferente a la que se realiza para la mayoría de las plantas con flores, debido a que el proceso de floración tarda muchos años y suele ser esporádico. Por esta razón, se identifican géneros y especies mediante sus características anatómicas. Esto, asociado al conocimiento de la anatomía en la lámina foliar ayuda a establecer diferencias significativas para cada especie (Montiel et al., 2006).
Sin embargo, uno de los problemas identificados en la propagación in vitro de los bambúes, se encuentra en la fase de aclimatización dada la baja supervivencia de las plantas en condiciones ex vitro. Esto se relaciona con factores como la temperatura, calidad de los sustratos, la humedad relativa, el sustrato y fundamentalmente la calidad del material vegetal. El conocimiento existente acerca de la aclimatización de las plantas cultivadas in vitro de los bambúes es limitado, principalmente su desarrollo anatómico en esta etapa del cultivo, representando la principal causa de la baja supervivencia el material vegetal. Por ello, resultados científicos sobre el tema garantizarían obtener plantas con calidad en condiciones de casa de cultivo. El objetivo de este trabajo estuvo dirigido a caracterizar hojas de plantas cultivadas in vitro de Bambusa vulgaris durante la fase de aclimatización desde el punto de vista morfológico y anatómico.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon plantas cultivadas in vitro de B. vulgaris en fase de enraizamiento previo a su plantación en fase de aclimatización y con 30, 60 y 90 días de plantadas. Además, se utilizaron hojas de plantas crecidas en campo con 15 años de sembradas ubicadas en la ribera del río Ochoa, Santa Clara.
Caracterización morfológica y anatómica
Con el objetivo
de realizar la caracterización morfológica y de la anatomía
foliar de plantas de B. vulgaris plantadas en casa de cultivo
se describieron las características de las plantas,
cuantificó el número de estomas y se realizaron observaciones
microscópicas.
Para el conteo del número de estomas se tomaron muestras de lámina foliar de plantas cultivadas in vitro de 30, 60 y 90 días de plantadas en fase de aclimatización y de plantas procedentes de campo (Figura 1b).Los fragmentos se cortaron a 1 cm2 de la zona central de esta (Figura 1a), luego se colocaron en KOH durante 24 horas. Posteriormente se enjuagaron tres veces con agua corriente y fueron teñidos con azul de toluidina (0.1%) durante 3 minutos. Luego se lavaron y fueron colocados en un portaobjeto y se agregó glicerol ácido. Las observaciones se realizaron en el microscopio óptico (OLYMPUS) con aumento 400x. Se cuantificó el número de estomas/mm2 y se describió la presencia tricomas.
Para la observación de la anatomía foliar de las plantas de B. vulgaris se procesaron plantas cultivadas in vitro, de 90 días de plantadas en fase de aclimatización y plantas de campo. Se realizó un corte trasversal a 1 cm2 de la lámina foliar. Además, se realizaron de forma manual cortes longitudinales de la unión entre la zona caulinar y la raíz. La tinción se realizó con azul de toluidina durante tres segundos y las observaciones se realizaron al microscopio óptico Olympus (400x).
Finalmente, se tomaron muestras de hojas de cultivo in vitro al día 0 y los 90 días de ser plantadas en fase de aclimatización y plantas de campo. Se fijaron en FAA (formaldehído 37%, ácido acético 100%, etanol 70%, en una proporción 5:5:90). Luego fueron deshidratados en un gradiente ascendente de etanol y embebidas en cera de parafina. Posteriormente se realizaron cortes de 10 µm de espesor con micrótomo rotatorio (Zeiss, Alemania), se fijaron en portaobjetos y se tiñeron con safranina al 0.5%. Las secciones histológicas de las diferentes muestras se examinaron en microscopio óptico (Olympus) y las imágenes fueron captadas con una cámara digital acoplada al microscopio.
Los datos relacionados
con el número de estomas mm-2 fueron comparados mediante
la prueba C de Dunnett previa comprobación de los supuestos de
normalidad y homogeneidad de varianza el paquete estadístico PASW Statistics
versión 18.0 sobre Windows.

RESULTADOS Y DISCUSIÓN
Las plantas cultivadas in vitro de B. vulgaris en fase de aclimatización presentaban en general características típicas de la especie. Al respeto Londoño (2001) refirió en plantas de campo las siguientes características morfológicas: bambú simpodial, ligeramente cespitoso, hábito perenne, presenta tallos herbáceos, los rizomas bien desarrollados y huecos son un eje segmentado típicamente subterráneo que constituye la estructura de soporte de la planta. Culmos erectos, sinuados, 1 000 cm -2 000 cm de altura y 4-10 cm de diámetro, paredes 0.7 cm- 1.5 cm de espesor, de color verde brillante; entrenudos 20 cm - 45 cm longitud y huecos, con pelos cafés y cera blanca cuando joven llegando a ser glabros y lisos cuando viejos; nudos oblicuos, ligeramente protuberantes; desarrolla varias ramas por nudos con una rama primaria dominante. Hoja caulinar ampliamente triangular, 15 cm - 45 cm x 20 cm, decidua, cubierta por pelos negros por la superficie abaxial; lamina erecta ligeramente angosta en la unión con la vaina. Lámina foliar lanceolada de 6 cm-30 cm x 1cm-6 cm, glabra.
En la fase de aclimatización
después de los 90 días de plantadas, presentaban los culmos erectos,
sinuados, de 3 cm-120 cm de altura y 0.3 cm-0.6 cm de diámetro, paredes
finas de 0.1 cm _ 0.2 cm de espesor, entrenudos 4 cm - 15 cm longitud y huecos,
la hoja caulinar de 2 cm _ 3.5 cm x
10 cm, la lamina foliar lanceolada 6 cm _ 23 cm x 1.5 cm _ 4.5 cm.
Durante la observación al microscopio de las muestras tomadas a la lámina foliar de las plantas de B. vulgaris procedentes del cultivo in vitro (día 0) y de plantas con 90 días de plantadas en fase de aclimatización se observó en la superficie adaxial (haz) entre las zonas intercostales, la presencia de estomas (Figura 2a). Estos formaban largas hileras en la superficie y en medio de la lámina foliar (Figura 2b). Unido a los estomas que estaban ubicados paralelos a las fibras epidérmicas, se observaron tricomas de tipo espinoso.
Además, fueron identificados cuerpos de sílice, micropelos (Figura 2c), presencia de papilas céricas y tricomas en forma de espinas (Figura 2d) estos se pudieron observar tanto en la zona adaxial como en la abaxial.
Las observaciones realizadas coinciden en sus resultados con lo descrito por Judziewicz et al. (1999) y Montiel et al. (2006), al describir las estructuras presentes en hojas de plantas de campo pertenecientes a especies de Guaduas.
De forma general
los estomas de las plantas cultivadas in vitro seleccionadas para ser
llevadas a fase de aclimatización, eran muy pequeños, siempre
menores a los observados en las muestras pertenecientes a plantas desarrolladas
en fase de aclimatización durante 90 días.

Específicamente, respecto a la presencia de estomas, se encontraron diferencias anatómicas entre las hojas de las plantas de 30, 60 y 90 días de plantadas en casa de cultivo. Se observó que el número de estomas/mm2 se incrementó a medida que las plantas se adaptaron a las condiciones ex vitro (Figura 3).
Durante los primeros 30 días de las plantas en la casa de cultivo, se hicieron visibles los estomas en la zona adaxial de la hoja.
Las hojas de las plantas de 90 días presentaron el mayor número de estomas/mm2 pero difirieron significativamente respecto a las hojas colectadas en plantas de campo.
En la observación de la anatomía foliar Saiter y Neves, (2009) en especies Merostachys (Poaceae: Bambusoideae) con plantas de campo y Montiel et al. (2006) en Guadua paniculada en plantas adultas de tres años de cultivo, observaron en la superficie adaxial de la vaina de las hojas numerosos estomas, pero en menor cuantía que en la zona abaxial, tricomas bicelulares, tricomas en forma de gancho, células de sílice y células largas con márgenes muy ondulados.
Coincidiendo con lo antes descrito, Vieira et al. (2002) y Garlet de Pelegrin et al. (2009) el primero en tres especies de bambúes (Raddia brasiliensis, Pharus lappulaceus y Cryptochloa capillata) y el segundo en Poaceae (Erianthecium bulbosum y Erianthecium parodi) observaron las mismas características en las plantas de campo.
Al realizar un corte transversal a las hojas se observó que las láminas foliares de las plantas en cultivadas in vitro, en fase de aclimatización y en campo mostraron una epidermis uniestratificada en ambas superficies. La cutícula se mostró muy fina en las plantas cultivadas in vitro (Figura 4a). El grosor de la cutícula de las plantas de campo y las de 90 de días de aclimatizadas fue similar (Figura 4b y 4c).
También fue posible observar células buliformes, estas se diferencian de las demás células por su forma y tamaño (Figura 4d, 4e y 4f). Este tipo de células se presenta de forma exclusiva en la epidermis de la superficie adaxial, por su presencia es fácilmente identificada la zona abaxial de la adaxial (Londoño, 2002).
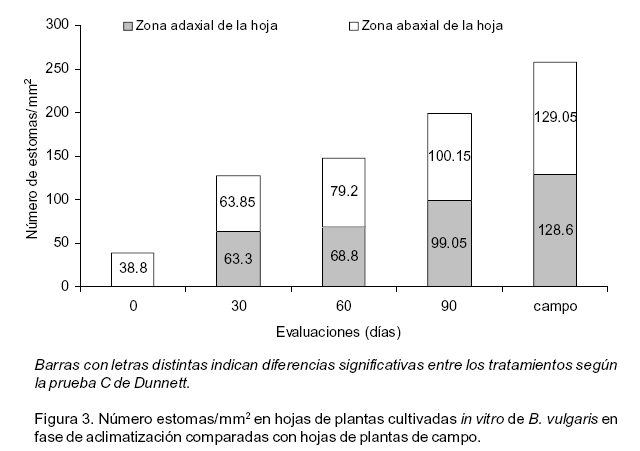
Barras con letras distintas indican diferencias significativas entre los tratamientos
según la prueba C de Dunnett.
Figura 3. Número
estomas/mm2 en hojas de plantas cultivadas in vitro de B.
vulgaris en fase de aclimatización comparadas con hojas de plantas
de campo.
haces vasculares, respecto a las plantas cultivadas in vitro.
Otras células identificadas fueron las fusoides, ellas son características de las Bambusoideae y presentan paredes muy delgadas, aclorófilas translúcidas, con perfil fusiforme y se encuentran perpendicular a los haces vasculares. Otros autores como Vieira et al. (2002) y Montiel et al. (2006) confirman la presencia de este tipo de células al realizar estudios en plantas de campo de la especie Guadua angustifolia y en otras tres especies de bambúes.
Hasta el momento no se cuenta con referencias sobre estudios y descripción de la anatomía foliar de B. vulgaris en plantas de campo ni tampoco en plantas cultivadas in vitro y aclimatizadas.
Al observar los cortes longitudinales de la unión del tallo y la raíz de plantas cultivadas in vitro y de plantas con 90 días de plantadas en casa de cultivo se observó que existía unión tallo-raíz, pero las plantas cultivadas in vitro que fueron seleccionadas para su siembra en casa de cultivo no presentaban un sistema radicular funcional. Todo lo contrario ocurrió cuando se analizaron los cortes realizados a las plantas con 90 días de plantadas (Figura 5a y 5b).

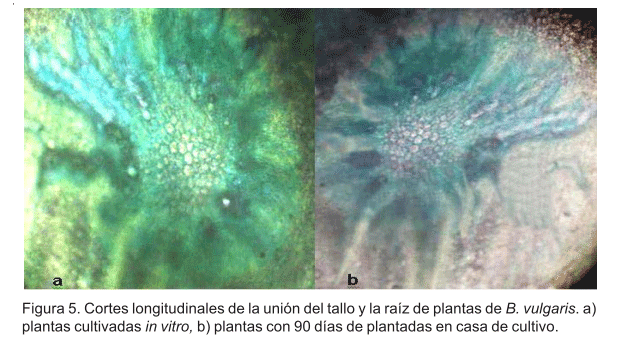
Las condiciones creadas en la fase de aclimatización posibilitaron que las plantas desarrollaran una cutícula organizada evitando con ello un posible estrés de humedad o deshidratación. Estas condiciones también favorecieron el desarrollo de haces vasculares con extensiones esclerenquimáticas hacia ambas epidermis (Figura 4h, 4i y 4j), lo cual permitió pasar en forma más eficiente de su condición in vitro a ex vitro, es decir, restituirse de su condición autótrofa como consecuencia de la reducción de la humedad relativa y aumento de la luminosidad. Según Roth (1990) y Navas (2008) la luz y la humedad son los factores que influyen mayormente en los cambios anatómicos de las hojas.
Al observar los haces vasculares también se presentaron diferencias entre las muestras en cuanto a las vainas vasculares. En las plantas que crecieron in vitro hubo escaso desarrollo de éstas y muy desorganizado crecimiento (Figura 4h), En las plantas aclimatizadas con noventa días de plantadas y las de campo los haces vasculares estaban más desarrollados y organizados (Figura 4i y 4j).
Mogollón
(2002) en estudios realizados en Dieffenbachia maculata Schott encontró
una respuesta similar durante la fase de aclimatización y campo en el
desarrollo de las
Las observaciones realizadas demostraron que las plantas de B. vulgaris
a los 90 días de cultivo tenían desde el punto de vista anatómico,
un desarrollo similar a las plantas de campo. Los resultados mostrados permiten
afirmar que a los 90 días de cultivo las plantas pueden ser llevadas
a campo o someterlas a un esquema de macropropagación mediante deshijes.
AGRADECIMIENTOS
A las facilidades
creadas por el proyecto Bambú-Biomasa financiado por la Agencia Suiza
para el Desarrollo y la Cooperación
(COSUDE) que permitieron el desarrollo de esta investigación.
REFERENCIAS
Daquinta, M, Rodríguez R, Ramos L, Capote I, Lezcano Y, Trino D, Escalona M, (2003) Manejo Biotecnológico de Especies Forestales y Bambúes en Cuba. Centro de Bioplantas, UNICA, Carretera a Morón, km 9 Ciego de Ávila.
Garlet de Pelegrin,
CM, Longhi-Wagner H M, Oliveira P L (2009) Leaf anatomy as a taxonomic tool
for Briza Complex species (Poaceae: Pooideae: Poeae) Acta Bot. Bras.
23 (3): 666.680
Londoño, X (2001) Botánica taxonómica de los bambúes
de América. Seminario Internacional de Bambú, Mérida, Venezuela.
21 al 23-11-01. Mimeografiado 9 p.
Londoño, X (2002) Distribución, morfología, taxonómia, anatomía, silvicultura y usos de los bambúes del nuevo mundo. Maestría en Construcción - Módulo Guadua, Agosto, Universidad Nacional de Colombia, Santafé de Bogotá
Mejia, G, Amanda I, Gallardo C, Vallejo C, Jairo J (2009) Plants of the genus Bambusa: importance and application in the pharmaceutical, cosmetic and food industry. Vitae 16 (3): 396-405
Mogollón, N (2002) Multiplicación, aclimatización y cambios morfoanatómicos de plantas in vitro de Dieffenbachia maculata Schott. Trabajo de ascenso. Decanato de Agronomía. Universidad Centroccidental Lisandro Alvarado. Barquisimeto
Montiel, M, Sánchez E (2006) Ultraestructura de bambúes del género Dendrocalamus (Poaceae: Bambusoideae) cultivados en Costa Rica IV: Dendrocalamus asper, clones Taiwán y Tailandia. Rev. Biol. Trop. 54: 65-75
Montiel, M, Jiménez V M, Guevara E (2006) Caracterización anatómica ultraestructural de las variantes Atlántica, Sur y Cebolla del bambú, Guadua angustifolia (Poaceae: Bambusoideae), en Costa Rica. Rev. Biol. Trop. 54: 1-12
Roth, I (1990) Leaf structure of a Venezuelan cloud forest in relation to the microclimate, pp. 53-114 Gebruder Borntraeger, Berlin
Saiter, D M, Neves L J (2009) Scanning electron microscopy of the leaf epidermis of Merostachys Spreng. (Poaceae: Bambusoideae). Acta Bot. Bras. 23(2): 516-525
Vieira, R C, Gomes D M S, Sarahyba I S, Arruda R C O (2002) Leaf anatomy of three herbaceous bamboo species. Braz. J. Biol. 62(4b): 907-922
Recibido: 10-4-2012
Aceptado: 21-6-2012
Ortelio Hurtado.Instituto de Biotecnología
de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní
km 5.5. Santa Clara, Villa Clara, Cuba. CP 54 830. e-mail: ortelio@ibp.co.cu
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
