Reseña Bibliográfica Biotecnología Vegetal Vol. 9, No. 1: 3 - 18, enero - marzo, 2009
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Floración in vitro revisión de literatura
Wayner Montero-Carmona1 y Víctor M. Jiménez2*. *Autor para correspondencia.
1Centro de Investigación y Desarrollo Agrícola Sostenible para el Trópico Húmedo, Escuela de Agronomía, Instituto Tecnológico de Costa Rica, Sede Regional San Carlos, Costa Rica.
2Centro para Investigaciones en Granos y Semillas (CIGRAS), Universidad de Costa Rica, 2060 San Pedro, Costa Rica. e-mail: victor.jimenez@ucr.ac.cr
RESUMEN
La floración in vitro puede ser inducida en diferentes estadios durante el desarrollo de las plantas in vitro mediante variaciones en los factores físicos y químicos relacionados con el cultivo de tejidos. Dentro de los factores físicos, el fotoperíodo y la temperatura son los que se han estudiado con más detalle. Su efecto inductivo puede variar en diferentes especies. Algunos factores físicos también pueden ser sustituidos por estímulos químicos. Los factores químicos que han sido descritos con más frecuencia en la literatura son algunos reguladores de crecimiento y la relación sacarosa/nitrógeno. Las citoquininas pueden inducir el desarrollo floral a partir de varios órganos; no obstante, altas concentraciones pueden inhibir la floración y ocasionar brotación de yemas vegetativas. Las giberelinas y las poliaminas (principalmente espermidina) presentan un efecto positivo en la inducción floral. De forma contrastante, el etileno y las auxinas han mostrado ser poderosos inhibidores de la floración in vitro. Sin embargo, las auxinas parecen ser necesarias durante los primeros estadios del desarrollo floral. Un aumento en la concentración de sacarosa en el medio de cultivo puede favorecer el desarrollo de flores in vitro; mientras que concentraciones altas de nitrógeno pueden estimular el desarrollo vegetativo de los explantes. No obstante, si las concentraciones de nitrógeno son muy bajas, el explante no se desarrolla bien. La presente revisión de literatura tiene como fin discutir los factores más comunes que participan en la inducción de la floración in vitro, así como presentar la literatura científica más relevante en el tema a partir de 1980.
Palabras clave: cultivo de tejidos, inducción floral, inductores, reguladores de crecimiento
ABSTRACT
In vitro flowering can be induced at different stages during development of in vitro plants by changes in chemical and physical factors related to the tissue culture process. Among the physical factors, photoperiod and temperature have been studied more detailed. Their inductive effect may vary in different species. Some physical factors can also be replaced by chemical stimuli. The chemical factors more frequently described in the literature are some growth regulators and the sucrose/nitrogen ratio. Cytokinins may induce flower development from various organs, but high concentrations can inhibit flowering and cause sprouting of vegetative buds. Gibberellins and polyamines (mostly spermidine) have a positive effect on flower induction. While, ethylene and auxin seem to be powerful inhibitors of in vitro flowering. However, auxins seem to be necessary during the early stages of floral development. An increase in the concentration of sucrose in the culture medium favor development of flowers in vitro, whereas a high concentration of nitrogen can stimulate vegetative growth of explants. Nevertheless, if the nitrogen concentration is too low, explants do not develop well. The aim of this literature review is to discuss most common factors related to in vitro flowering and to list the most relevant scientific literature about the subject from 1980 on.
Key words: flower induction, growth regulators, inducers, tissue culture
Abreviaturas: 2,4-D Ácido 2,4-diclorofenoxiacético, 2iP 2isopentiladenina, ABA Ácido abscísico, AC Agua de coco, AG3 Ácido giberélico, AIA Ácido indol acético, AIB Ácido indol butírico, ANA Ácido naftalen acético, BAP Benciladenina, CAct Carbón activado, CasHid Caseína hidrolizada, DSDPs Plantas de día corto desplazado, GAx Giberelina x, LDPs Plantas de día largo, MES Ácido 2 (N-morfolino) etanosulfónico, MS Murashige y Skoog (1962), MT Murashige y Tucker (1969), PSF Plantas sensibles al fotoperíodo, Put Putrescina, PVP Polivinilpirrolindona, SAM S-adenosil-L-metionina, SAMDC S-adenosil-L-metionina descarboxilasa, SDPs Plantas de día corto, Spd Espermidina, Spm Espermina, TDZ Tidiazuron
Contenido
INTRODUCCIÓN
FACTORES QUE AFECTAN LA FLORACIÓN IN VITRO
Fotoperíodo
Reguladores de crecimiento
Nitrógeno
Concentración de sacarosa
Temperatura
Aireación y gelificación EFECTO DEL GENOTIPO EN LA INDUCCIÓN FLORAL IN VITRO Conclusiones
INTRODUCCIÓN
El éxito reproductivo de una planta depende de que complete su ciclo hasta floración. Durante el proceso de inducción floral, a nivel de meristemo, ocurren una serie de eventos que afectarán el hábito de crecimiento vegetativo, incluyendo pérdida de la dominancia apical, alargamiento del tallo, cambios en la filotaxia y la forma de la hoja (Galoch et al., 2002). El inicio de la floración está fuertemente regulado por cambios ambientales relacionados con factores estacionales tales como el fotoperíodo y la temperatura, y por el estado de desarrollo de la planta (Bernier et al., 1993; Laurie, 2004).
La inducción floral involucra una serie de cambios profundos, pasando de estadios vegetativos (producción de tallos y hojas) a estadios reproductivos (producción de flores y semillas). La floración requiere de un alto grado de reservas por parte de la planta; por lo que se han generado mecanismos para asegurar que los procesos de inducción floral ocurran durante los periodos favorables para la floración. La forma en que las plantas regulan los procesos de inducción floral varía entre especies. Sin embargo, este proceso comúnmente involucra el uso de señales internas relacionadas con el fotoperíodo o cambios en temperatura (vernalización). La disponibilidad de agua, nutrientes o reguladores de crecimiento son otros de los factores de importancia para la inducción floral (Laurie, 2004).
Una sustancia debe cumplir con los siguientes requisitos para que se pueda confirmar su participación en la inducción floral: estímulos que conducen a la floración deben aumentar sus niveles endógenos en los meristemos, inhibidores de su biosíntesis deben bloquear la inducción floral y deben encontrase pruebas que relacionen molecular o bioquímicamente a dicha sustancia con la inducción floral (King et al., 2001).
Se ha relacionado a un grupo importante de genes con los procesos de inducción y regulación de la floración. Entre ellos se han propuesto varios relacionados con el control negativo (LHY/CCA1, TOC1) o positivo (CO, PHYB) de los ritmos circadianos que conllevan a la floración (Barak et al., 2000; Hayama y Coupland, 2003). Durante los períodos inductivos, la floración es promovida por genes como PHYA, FHA, CO, GI, LHY o FT. Mientras que en períodos no inductivos, la floración puede inducirse por tocoferoles (Molina-Torres et al., 1989) o mediante regulación hormonal (Roldán et al., 1999).
Los primeros trabajos publicados sobre floración in vitro datan de 1933, cuando White logró, a partir del estímulo de meristemos preformados, la inducción floral en Stellaria media (Scorza, 1982). Posteriores eventos de floración in vitro han sido referidos a partir de la reorganización de estructuras preformadas (meristemos apicales, yemas y embriones somáticos), así como a partir de brotes adventicios obtenidos de callo proveniente de diversos tejidos (segmentos de tallo, raíces, hojas, cotiledones, pétalos, capas de células epidermales, protoplastos), entre otros (Scorza, 1982; Bernier et al., 1993; Laurie, 2004).
En este trabajo se pretende hacer una recopilación, lo más exhaustiva posible, de los informes científicos relacionados con floración in vitro que se han publicados a partir de 1980. Las referencias anteriores a dicha fecha ya habían sido compiladas por Scorza (1982). Recientemente se publicó una revisión en el tema, pero limitada a plantas neófitas, que son aquellas plantas herbáceas que tienen órganos de almacenamiento bajo tierra, tales como bulbos, cormos, rizomas o tubérculos (Ziv y Naor, 2006).
FACTORES QUE AFECTAN LA FLORACIÓN IN VITRO
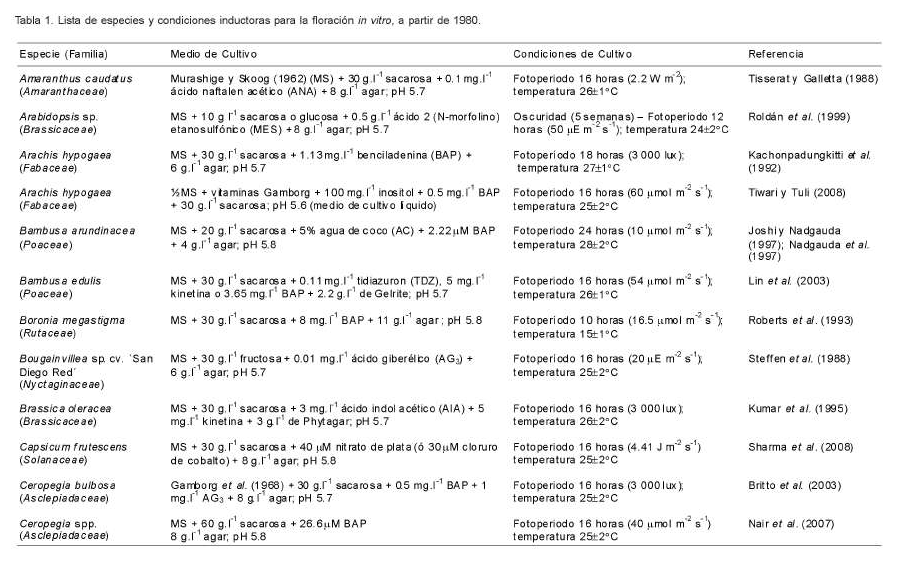
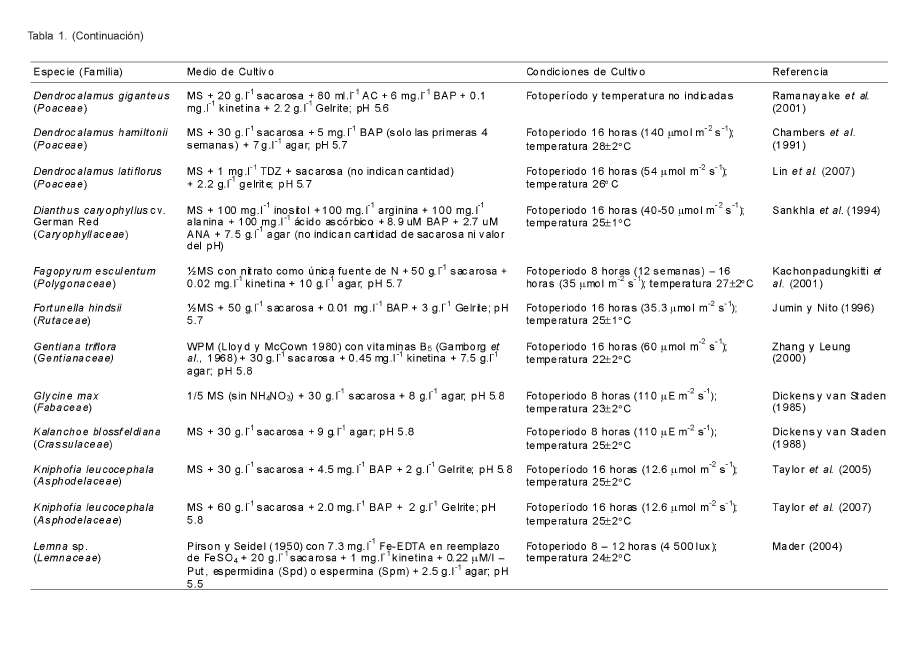
La floración in vitro puede ser inducida en diferentes estadios de desarrollo de las plantas in vitro mediante variaciones en factores químicos y físicos relacionados con el cultivo de tejidos. Las familias de plantas que presentan mayor número de referencias sobre floración in vitro son: Poaceae, Rutaceae, Orchidaceae, Brassicaceae y Cucurbitaceae (Tabla 1). Sin embargo, la gran variedad de familias en las que se ha informado dicho fenómeno parece indicar que no existe una relación directa entre el grupo taxonómico y la inducción de este proceso. La única relación que parece mantenerse es que fotoperiodos de 16 horas luz o mayores inducen la floración in vitro en plantas de día largo (long day plants, LDPs) en presencia de citoquininas en el medio de cultivo (Hillson y LaMotte, 1977; Scorza y Janick, 1980; Rajasekaran et al., 1983; McDaniel et al., 1991; Kachonpadungkitti et al., 1992; Zhang y Leung, 2000; King et al., 2001).




Fotoperíodo
La percepción del fotoperíodo requiere de la participación de fotorreceptores. Entre los más importantes se encuentran los fitocromos, los cuales pueden distinguir entre luz y oscuridad, así como la duración de estas fases (Reid et al., 2004). Períodos de oscuridad continua estimulan un aumento en la biosíntesis de diversas giberelinas y su sensibilidad por parte de las células (Reed et al., 1996). La percepción de longitudes de onda correspondientes al espectro rojo e infrarrojo por parte de las hojas inductoras (generalmente las más cercanas a la yema) parecen activar una señal de estímulo para la inducción floral. Esta señal es trasladada en un lapso de 16 a 24 horas posterior al inicio de la exposición al período de luz correcto, sin verse afectada por la intensidad lumínica (Perilleux et al., 1994).
La sensibilidad de las plantas in vitro hacia el fotoperíodo varía durante su desarrollo. En algunos casos las plantas presentan un aumento y en otros una disminución en la sensibilidad conforme avanzan hacia la madurez. Estos cambios en la capacidad de percepción de las plantas hacia la luz ha sido relacionada, no con los cambios en la susceptibilidad de los meristemos al estímulo de inducción floral, sino con los procesos inductivos de dicho estímulo en las hojas (Simmonds, 1982). Se han encontrando plantas de día corto (short day plants, SDPs), plantas de día corto desplazado (displaced short day plants, DSDPs) y LDPs que responden al mismo ritmo circadiano de aproximadamente 24 horas in vitro. La inducción floral en el cultivo de tejidos parece estar fuertemente influenciada por este modelo en muchas plantas sensibles al fotoperíodo (PSF) (Kachonpadungkitti et al., 2001). Se ha hecho referencia al papel del fotoperíodo como un factor de gran importancia para la floración in vitro en diferentes especies (Tabla 2).
Reguladores de crecimiento
En forma general, los reguladores del crecimiento y las poliaminas son considerados como las principales señales de estímulo para la inducción floral. Su relación, tanto a nivel de la inducción como de la morfogénesis de la flor, indica que su acción es multifactorial (Bernier et al., 1993; Perilleux y Bernier, 1997). A nivel fisiológico, citoquininas, auxinas y giberelinas han mostrado tener un efecto importante en la inducción floral en varias especies de plantas (Metzger, 1987). Durante la inducción floral en Lolium, una LDP, los niveles de GA5 aumentan inicialmente, seguido varios días después, por un incremento en la concentración de GA1, AG3, GA4 y GA6 (King et al., 2001). Los cambios para que los meristemos vegetativos pasen a su estadío reproductivo involucran la redistribución de fitohormonas endógenas y la pérdida de la dominancia apical. El efecto de las fitohormonas durante la inducción floral puede estar relacionado con cambios en el crecimiento y desarrollo de los meristemos en estado vegetativo, que pasan a un estado reproductivo (Galoch et al., 2002).
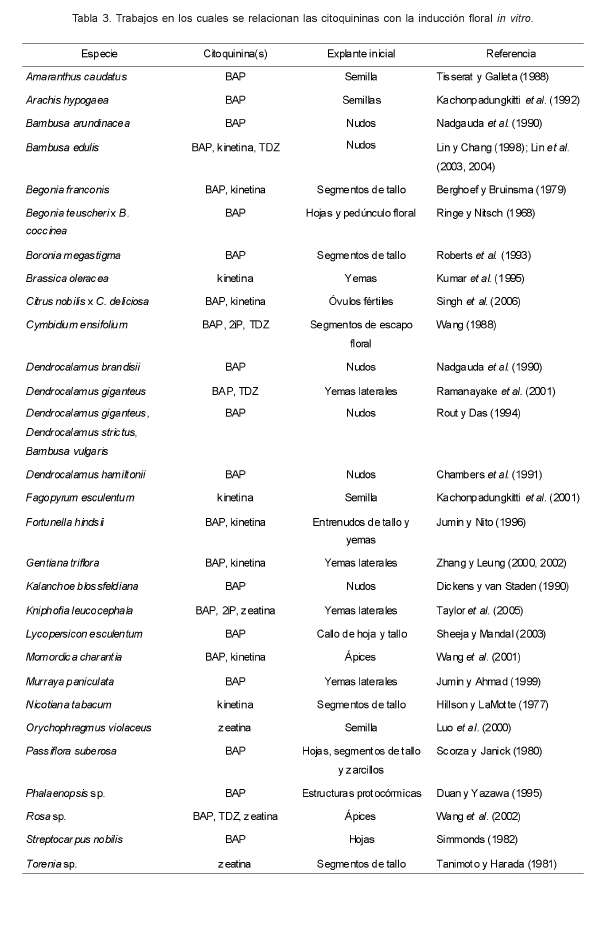
In vitro, las citoquininas pueden inducir el desarrollo floral a partir de varios órganos (Tabla 3). Tidiazurón (TDZ), 2isopentiladenina (2iP) y benciladenina (BAP) han mostrado tener un fuerte efecto inductor en Cymibidum ensifolium (Chang y Chang, 2003) y Bambusa edulis (Lin et al., 2004). Sin embargo, no todas las citoquininas muestran un efecto positivo en la floración. Altas concentraciones de varias citoquininas (zeatina, kinetina, BAP y 2iP) pueden inhibir la inducción floral y ocasionar un efecto en la brotación de yemas vegetativas, como se ha observado en Torenia sp. (Tanimoto y Harada, 1981), Fagopyrum esculentum (Kachonpadungkitti et al., 2001), Pharbitis nil (Galoch et al., 2002) y Kniphofia leucocephala (Taylor et al., 2005).

Hay indicios de que las citoquininas y giberelinas son exportadas desde las hojas hacia los meristemos durante la inducción floral in vitro en Mormodica charantia (Prakash, 1977), Panax ginseng (Chang y Hsing, 1980), Passiflora suberosa (Scorza y Janick, 1980), Arabidopsis sp. (Roldán et al., 1999) y Orychophragmus violaceus (Luo et al., 2000). Tanto citoquininas como giberelinas pueden tener un efecto inductor en fotoperiodos de baja intensidad lumínica (por debajo de los 34 mM m-2 s-1) en O. violaceus (Luo et al., 2000) y P. nil (Galoch et al., 2002). Se ha informado que altas concentraciones de citoquininas o giberelinas (superiores a 5 mg l-1) promueven la inducción floral pero, a la vez, han inhibido el desarrollo de estructuras florales en P. nil (Galoch et al., 2002).
Las giberelinas son fundamentales en el proceso de inducción floral in vitro en condiciones de fotoperiodicidad no inductiva tal como se ha observado en Bougainvillea sp. cv. San Diego Red´ (Steffen et al., 1988), Kalanchoe blossfeldiana (Dickens y van Staden, 1990), Arabidopsis sp. (Roldán et al., 1999) y Zantedeschia sp. (Naor et al., 2004). Además, el efecto de las giberelinas aparenta ser sinérgico con el efecto inductor causado por el fotoperíodo en P. nil (Galoch et al., 2002) y en Olea europaea (Chaari-Rkhis et al., 2006).
Las poliaminas putrescina (Put), espermidina (Spd) y espermina (Spm) han sido relacionadas con diferentes procesos fisiológicos de importancia para el desarrollo de la planta, uno de ellos la inducción floral. Una relación Spd/Spm alta estimula la floración in vitro en varias especies (Bais et al., 2001). Los efectos de la Put suelen ser menores y más variables que los de Spd y Spm. Esto sugiere que Put no actúa per se, sino probablemente como precursor de la Spd (Mader, 2004).
La relación poliaminas/etileno parece estar involucrada en la inducción floral in vitro de forma contrastante en LDPs y SDPs. En LDPs las concentraciones endógenas de etileno tienden a ser inferiores a las de poliaminas y el caso contrario se da en las SDPs (Bais et al., 2001; Mader, 2004). La Put puede inducir la conversión de S-adenosil-L-metionina (SAM) en Spd en Cichorium intybus, lo cual reduce la síntesis de etileno (Bais et al., 2001). En Lemna sp., la relación a favor del etileno permite que la enzima S-adenosil-L-metionina descarboxilasa (SAMDC) catalice la síntesis de etileno a partir de SAM (Mader, 2004).
Reducciones en las emisiones de etileno pueden ser resultado directo de la aplicación exógena de poliaminas. Las poliaminas (Put, Spd y Spm) pueden actuar como inhibidores de SAMDC; mientras que el etileno puede bloquear el metabolismo de las poliaminas en las plantas, reprimiento la inducción floral (Bais et al., 2001). El AgNO3 ha mostrado tener un efecto positivo en la inducción floral en C. intybus, aparentemente porque los iones Ag2+ reducen la capacidad de los receptores de membrana para detectar el etileno, lo que inhibe su acción. Esto resulta en una autoinhibición en el proceso de biosíntesis del etileno, generando que la SAM quede disponible para la síntesis de poliaminas (Bais et al., 2001).
Se ha observado inhibición de la inducción floral in vitro mediante la adición de auxinas en Plumbago indica (Nitsch y Nitsch, 1965), Streptocarpus nobilis (Simmonds, 1982), P. nil (Galoch et al., 2002) y B. edulis (Lin et al., 2003). Las auxinas han mostrado ser un poderoso inhibidor de la floración in vitro tanto en SDPs como en LDPs. En LDPs se ha observado que la inducción floral se da como resultado de la reducción de la concentración de auxinas en el meristemo. Esto ocasiona un cambio en la relación auxina/citoquinina a favor de las citoquininas lo cual puede llevar al proceso de floración. Hay dos posibles explicaciones para este cambio: que algunas auxinas actúen como inhibidores directos de la floración o que las auxinas desvíen los nutrientes necesarios para que ocurra la inducción floral (Dickens y van Staden, 1990). No obstante, la adición de auxinas exógenas parece ser necesaria durante los primeros estadios del desarrollo floral en Nicotiana tabacum (Hillson y LaMotte, 1977), Begonia franconis (Berghoef y Bruinsma, 1979), Torenia sp. (Tanimoto y Harada, 1981), Solanum tuberosum (Al-Wareh et al., 1989), Citrus limon (Tisserat et al., 1990), Brassica oleracea (Kumar et al., 1995), Rosa sp. (Wang et al., 2002) y B. edulis (Lin et al., 2003).
Aunque generalmente se ha relacionado al ácido abscísico (ABA) con inhibición de la inducción floral (Bernier y Périlleux 2005), en K. blossfeldiana la presencia de concentraciones bajas de ABA es indispensable para la floración in vitro. Esto debido probablemente al efecto inhibitorio del ABA sobre el desarrollo vegetativo (Dickens y van Staden, 1990).
Nitrógeno
La relación carbono/nitrógeno juega un papel importante en la inducción floral in vitro. Concentraciones altas de nitrógeno se han relacionado con el desarrollo vegetativo de explantes de S. nobilis (Simmonds, 1982) y del cruce Doritis pulcherrima x Kingiella philippiensis (Duan y Yazawa, 1994). De la misma forma, hay indicios de que entre mayor sea la concentración de nitrógeno en el medio de cultivo, menor es el porcentaje de explantes que desarrollan flores en Torenia sp. (Tanimoto y Harada, 1981), S. nobilis (Simmonds, 1982), O. violaceus (Luo et al., 2000) y F. esculentum (Kachonpadungkitti et al., 2001). Una relación alta en sacarosa y baja en nitrógeno estimuló el desarrollo reproductivo en Torenia sp. (Tanimoto y Harada, 1981), Perilla crispa (Wada y Totsuka, 1982), P. nil (Ishioka et al., 1991), D. pulcherrima x K. philippiensis (Duan y Yazawa, 1994) y M. charantia (Wang et al., 2001). No obstante, si las concentraciones de nitrógeno son muy bajas, el explante (vegetativo o reproductivo) no se desarrolla eficientemente (Hillman y Posner, 1971; Simmonds, 1982; Dickens y van Staden, 1988; Luo et al., 2000).
Concentración de sacarosa
La participación de carbohidratos en el control de la floración ha sido discutida por varias décadas. La inducción floral es resultado de un aumento en el transporte de asimilados, especialmente sacarosa, hacia los meristemos apicales. Se ha observado que la concentración de sacarosa aumenta en los meristemos apicales durante la inducción floral en varias especies, incluyendo LDPs, SDPs o plantas que dependen de cambios en la temperatura para iniciar los procesos de floración. En PSF dicho transporte se da en estadios iniciales de la inducción floral, en los cuales no es posible que dicha movilización sea a causa de un aumento en las necesidades metabólicas del meristemo, tanto en condiciones in vivo (Bernier et al., 1993; Perilleux y Bernier, 1997) como in vitro (Roldán et al., 1999).
El transporte de sacarosa de las hojas hacia los meristemos durante la inducción floral ha hecho pensar que este compuesto podría ser la señal de estímulo para la floración. Aumentos en la concentración de sacarosa en SDPs pueden inducir a la floración. En PSF in vitro, una simple exposición a fotoperíodos inductivos resultó en un rápido aumento en los niveles de sacarosa en los productos transportados desde la hoja hacia los meristemos (Scorza, 1982; Roldán et al., 1999). Sin embargo, en LDPs la floración se puede lograr mediante fotoperíodos inductivos que estimulan la floración sin necesidad de aumentar los niveles de sacarosa en los meristemos. Lo mismo ocurre en DSDPs, en donde fotoperíodos prolongados de baja intensidad inducen el estímulo de floración sin aumentar las concentraciones de sacarosa en los meristemos (Roldán et al., 1999).
Las discrepancias entre los diferentes sistemas de PFS (SDPs, LDPs y DSDPs) en cuanto al transporte de sacarosa desde las hojas hacia los meristemos y la posibilidad de inducción floral sin necesidad de aumento en los niveles de sacarosa podría indicar que la presencia de sacarosa en el meristemo no está relacionada directamente con la inducción floral, sino más bien con el desarrollo de las estructuras florales in vitro (Scorza, 1982) o in vivo (Bernier et al., 1993; Perilleux y Bernier, 1997; King y Ben-Tal, 2001). Sin embargo, un aumento en la concentración de sacarosa en el medio de cultivo sí puede aumentar el porcentaje de explantes que desarrollan flores in vitro. Esto se ha observado en S. nobilis (Simmonds, 1982), Leptinella nana (Carson y Leung, 1994), Bambusa sp. (John y Nadgauda, 1999), F. esculentum (Kachonpadungkitti et al., 2001) y el cruce Citrus nobilis x C. deliciosa (Singh et al., 2006).
Se sabe muy poco sobre la relación que tiene el almidón con la inducción floral. Eimert et al. (1995) sugirieron que la acumulación de almidón produce cambios en el metabolismo del nitrógeno durante la inducción de este proceso. Además, postularon la existencia de vías metabólicas regulatorias comunes entre el catabolismo del almidón y la inducción floral en Arabidopsis sp. in vitro. Por otra parte, el acúmulo de almidón normalmente está relacionado con retrasos en la floración de Lollium temulentum in vivo (Perilleux y Bernier, 1997).
La relación sacarosa/giberelinas presenta una nueva ruta para la interpretación de la inducción floral. En Fuchsia hybrida se observó que conforme aumente la concentración de sacarosa y el nivel de giberelinas en el meristemo, este inicia el desarrollo reproductivo. Si solo se aumenta el nivel de giberelinas en el meristemo, el resultado es la elongación del tallo y la reducción de los niveles de sacarosa en el meristemo (King y Ben-Tal, 2001).
Temperatura
Muchas plantas en fase de crecimiento vegetativo no pueden iniciar la producción de estructuras reproductivas in vitro sin un apropiado tratamiento de vernalización (Luo et al., 2000). En varias especies frutales, períodos con bajas temperaturas son requeridos para estimular la inducción floral. Durante la floración in vitro en Citrus, tratamientos con bajas temperaturas permitieron la transformación de los meristemos vegetativos en florales (Tisserat et al., 1990; García-Luis et al., 1992).
Algunos genes que actúan independientemente de la regulación fotoperíodica (FCA, FPA, FVE, FY o LD) se han considerado de gran importancia para la inducción floral durante fotoperíodos no inductivos. En muchos casos, este efecto puede ser sustituido por tratamientos de vernalización. En plantas susceptibles a la vernalización, la represión de la floración es causada por genes tales como FRI, FLC y TFL, los cuales promovieron el crecimiento vegetativo y evitaron el desarrollo de estructuras reproductivas en Arabidopsis sp. (Roldán et al., 1999).
En Phalaenopsis, tratamientos de vernalización (los cuales normalmente pueden estimular la floración in vivo) no promovieron la inducción floral in vitro (Duan y Yazawa, 1995), lo cual sugiere que las condiciones para la inducción floral no siempre son similares en cultivo in vitro a las mostradas en crecimiento ex vitro.
Aireación y gelificación
La influencia de una buena aireación en medios de cultivo líquidos para el desarrollo de la floración ha sido estudiada, principalmente en relación con la reducción del fenómeno de la hiperhidricidad. No se ha informado la ocurrencia de floración in vitro en cultivos hiperhídricos, lo que podría sugerir que el proceso de hiperhidricidad inhibe la inducción floral, así como inhibe otros procesos morfogenéticos in vitro (Scorza, 1982). Se ha indicado que un aumento en la concentración del agente gelificante en el medio de cultivo puede favorecer la producción de flores in vitro en Cucumis sativus cv. Marketmore-76 (Tisserat y Galleta, 1993) y F. esculentum (Kachonpadungkitti et al., 2001).
EFECTO DEL GENOTIPO EN LA INDUCCIÓN FLORAL IN VITRO
Se ha observado un efecto variable del genotipo en la inducción floral in vitro. Por un lado, diferentes cultivares de Perilla crispa (Wada y Totsuka, 1982), Amaranthus sp. (Tisserat y Galleta, 1988), Solanum tuberosum (papa) (Al-Wareh et al., 1989), Arachis hypogaea (maní) (Kachonpadungkitti et al., 1992), Arabidopsis (Roldán et al., 1999), Rosa sp. (rosa) (Wang et al., 2002), Lycopersicon esculentum (tomate) (Sheeja y Mandal, 2003) y Zantedeschia spp. (cala) (Naor et al., 2004), utilizados en varios estudios de floración in vitro, no mostraron diferencias estructurales en las flores producidas ni en los procesos de inducción floral evaluados.
Sin embargo, en el caso de las especies Begonia socotrana, B. sutherlandii, B. evansiana y B. multiflora, así como de las variedades Gloire de Lorraine, Regent, Carollina de Lucerna, Comte de Miribel, de esta especie, solo B. socotrana y la variedad Carollina de Lucerna produjeron flores en respuesta a tratamientos evaluados in vitro (Ringe y Nitsch, 1968). La presencia de ácido indol acético (AIA) en el medio de cultivo pudo haber inhibido la inducción floral en los meristemos de las otras especies y variedades. En estudios realizados en F. esculentum, se identificaron diferencias estructurales entre las flores obtenidas (flores normales y enanas) en las mismas condiciones de cultivo entre diferentes genotipos de esta especie (Kachonpadungkitti et al., 2001). Si bien las flores fueron morfológicamente idénticas, la alta concentración de sacarosa pudo actuar como un inhibidor del desarrollo de los meristemos florales. Por otra parte, de seis variedades de olivo (O. europaea) evaluadas por Chaari-Rkhis et al. (2006), solo la variedad Chemlali no presentó inducción floral in vitro. Esto probablemente se debió a que el medio de cultivo (bajo en nitrógeno) y las concentraciones evaluadas de AG3 (1, 2 y 10 mg l-1) no indujeron el estímulo deseado en este cultivar.
CONCLUSIONES
Las ventajas que presenta el cultivo in vitro para el estudio de la inducción floral radican en la facilidad para aplicar diversos estímulos que induzcan o inhiban este fenómeno sin involucrar las variantes ambientales (de Fossard, 1974; Scorza, 1982). En los últimos años, los estudios realizados in vitro han buscado establecer un modelo eficiente, reproducible y simple para la inducción floral. Lo anterior con el fin de facilitar estudios a nivel molecular y bioquímico de los procesos involucrados (inactivación, sobre-expresión, interacción entre genes y factores de transcripción). A nivel de aplicación práctica, podría retardarse la floración de cultivos que no requieran desarrollo reproductivo, inducir floración para acortar procesos de fitomejoramiento y reproducción, prevenir o reducir la producción de agentes alergénicos, así como controlar la producción y diseminación de polen en plantas transgénicas; sin olvidar el potencial uso comercial de las plantas ornamentales floreadas in vitro (Nadgauda et al., 1990; Roldán et al., 1999; Wang et al., 2002; Laurie, 2004).
REFERENCIAS
Al-Khayri, JM, Huang FH, Morelock TE (1991) In vitro flowering in regenerated shoots of spinach. HortScience 26: 1422
Al-Wareh, H, Trolinder NR, Goodin JL (1989) In vitro flowering of potato. HortScience 24: 827-829
Anitha, S, Kumari BDR (2006) In vitro flowering in Rauvolfia tetraphylla L. Pakistan Journal of Biological Sciences 9: 422-424
Bais, H, Sudha G, Ravishankar G (2001) Influence of putrescine, silver nitrate and polyamine inhibitors on the morphogenetic response in untransformed and transformed tissue of Cichorium intybus and their regenerants. Plant Cell Reports 20: 547-555
Barak, S, Tobin EM, Green RM, Andronis C, Sugano S (2000) All in good time: the Arabidopsis circadian clock. Trends in Plant Science 5: 517-522
Bernier, G, Périlleux C (2005) A physiological overview of the genetics of flowering time control. Plant Biotechnology Journal 3: 316
Bernier, G, Havelange A, Houssa C, Petitjean A, Lejeune P (1993) Physiological signals that induce flowering. The Plant Cell 5: 1147-1155
Berghoef, J, Bruinsma J (1979) Flower development of Begonia franconis Liebm. IV. Adventitious flower bud formation on excised inflorescence pedicels in vitro. Zeitschrift für Pflanzenphysiologie 94: 407-416
Britto, SJ, Natarajan E, Arockiasamy DI (2003) In vitro flowering and shoot multiplication from nodal explants of Ceropegia bulbosa Roxb. var. bulbosa. Taiwania 48: 106-111
Carson, AJ, Leung DWM (1994) In vitro flowering and propagation of Leptinella nana L., an endangered plant. New Zealand Journal of Botany 32: 79-83
Chaari-Rkhis, A, Maalej M, Ouled-Messaoud SO, Drira N (2006) In vitro vegetative growth and flowering of olive tree in
response to GA3 treatment. African Journal of Biotechnology 5: 2097-2302
Chambers, SM, Heuch JHR, Pirrle A (1991) Micropropagation and in vitro flowering of bamboo Dendrocalamus hamiltonii Munro. Plant Cell, Tissue and Organ Culture 27: 45-48
Chang, C, Chang WC (2003) Cytokinins promotion of flowering in Cymbidium ensifolium var. misericors in vitro. Plant Growth Regulation 39: 217-221
Chang, W, Hsing Y (1980) In vitro flowering of embryoids derived from mature root callus of ginseng (Panax ginseng). Nature 284: 341-342
de Fossard, R (1974) Flower initiation in tissue and organ culture. En: Street, H (Ed) Tissue culture and plant science, pp. 193-212. Academic Press. Londres
Dewir, YH, Chakrabarty D, Ali MB, Singh N, Hahn EJ, Paek KY (2007) Influence of AG3, sucrose and solid medium/ bioreactor culture on in vitro flowering of Spathiphyllum and association of glutathione metabolism. Plant Cell, Tissue and Organ Culture 90: 225-235
Dewir, YH, Chakrabarty D, Hahn EJ, Datta SK, Paek KY (2008) Kinetics of nutrient utilization and photosynthetic enzyme activities during floral versus vegetative differentiation of Spathiphyllum in air-lift bioreactor cultures. Plant Growth Regulation 54: 157-164
Dickens, CWS, van Staden J (1985) In vitro flowering and fruiting of soybean explants. Journal of Plant Physiology 120: 83-86
Dickens, CWS, van Staden J (1988) The in vitro flowering of Kalanchoe blossfeldiana Poellniz I. Role of culture conditions and nutrients. Journal of Experimental Botany 39: 461-471
Dickens, CWS, van Staden J (1990) The in vitro flowering of Kalanchoe blossfeldiana Poellniz II. The effect of growth regulators and gallic acid. Plant and Cell Physiology 31: 757-762
Duan, JX, Yazawa S (1994) Induction of floral development in x Doriella tiny (Doritis pulcherrima x Kingiella philippinensis) in vitro and in vivo. Scientia Horticulturae 59: 253-261
Duan, JX, Yazawa S (1995) Floral induction and development in Phalaenopsis in vitro. Plant Cell, Tissue and Organ Culture 43: 71-74
Eimert, K, Wang SM, Lue WL, Chen J (1995) Monogenic recessive mutations causing both late floral initiation and excess starch accumulation in Arabidopsis. The Plant Cell 7: 1703-1712
Ferreira, W de M, Kerbauy GB, Kraus JE, Pescador R, Suzuki RM (2006) Thidiazuron influences the endogenous levels of cytokinins and IAA during the flowering of isolated shoots of Dendrobium. Journal of Plant Physiology 163: 1126-1134
Franklin, G, Pius PK, Ignacimuthu S (2000) Factors affecting in vitro flowering and fruiting of green pea (Pisum sativum L.). Euphytica 115: 65-73
Galoch, E, Czaplewska J, Burkacka-Laukajtys E, Kopcewicz J (2002) Induction and stimulation of in vitro flowering of Pharbitis nil by cytokinin and gibberellin. Plant Growth Regulation 37: 199-205
Gamborg, OL, Miller LA, Ojima K (1968) Nutrient requirements of suspension cultures of soybean root cells. Experiment of Cell Research 50: 151-158
García-Luis, A, Kanduser M, Santamarina P, Guardiola JL (1992) Low temperature influence on flowering in Citrus. The separation of inductive and bud dormancy releasing effects. Physiologia Plantarum 86: 648-652
Handro, W (1983) Effects of some growth regulators on in vitro flowering of Streptocarpus nobilis. Plant Cell Reports 2: 133-136
Hayama, R, Coupland G (2003) Shedding light on the circadian clock and the photoperiodic control of flowering. Current Opinion in Plant Biology 6: 13-19
Hee, KH, Loh CS, Yeoh HH (2007) Early in vitro flowering and seed production in culture in Dendrobium Chao Praya Smile (Orchidaceae). Plant Cell Reports 26: 2055-2062
Hillman, WS, Posner HB (1971) Ammonium ion and the flowering of Lemna perpusilla. Plant Physiology 47: 586-587
Hillson, TD, LaMotte CE (1977) In vitro formation and development of flower buds on tobacco stem explants. Plant Physiology 60: 881-884
Ishioka, N, Tanimoto S, Harada H (1991) Roles of nitrogen and carbohydrate in flower-bud formation in Pharbitis apex cultures. Journal of Plant Physiology 138: 573-576
John, CK, Nadgauda RS (1999) In vitro-induced flowering in bamboos. In Vitro Cellular and Developmental Biology-Plant 35: 309-315
Joshi, M, Nadgauda RS (1997) Cytokinins and in vitro induction of flowering in bamboo: Bambusa arundinacea (Retz.) Willd. Current Science 73: 523-526
Jumin, HB, Ahmad M (1999) High-frequency in vitro flowering of Murraya paniculata (L.) Jack. Plant Cell Reports 18: 764-768
Jumin, HB, Nito N (1996) In vitro flowering of Fortunella hindsii (Champ.). Plant Cell Reports 15: 484-488
Kachonpadungkitti, Y, Hisajima S, Arai Y (1992) Life cycle of peanut (Arachis hypogaea L.) plant in vitro. Bioscience, Biotechnology and Biochemistry 56: 543-546
Kachonpadungkitti, Y, Romchatngoen S, Hasegaw K, Hisajima S (2001) Efficient flower induction from cultured buckwheat (Fagopyrum esculentum L.) node segments in vitro. Plant Growth Regulation 35: 37-45
Kerbauy, GB (1984) In vitro flowering of Oncidium varicosum mericlones (Orchidaceae). Plant Science Letters 35: 73-75
King, RW, Ben-Tal Y (2001) A florigenic effect of sucrose in Fuchsia hybrida is blocked by gibberellin-induced assimilate competition. Plant Physiology 125: 488-496
King, RW, Moritz T, Evans LT, Junttila O, Herlt AJ (2001) Long-day induction of flowering in Lolium temulentum involves sequential increases in specific gibberellins at the shoot apex. Plant Physiology 127: 624-632
Knudson, L (1946) A new nutrient solution for orchid seed germination. American Orchid Society Bulletin 15: 214-217
Kostenyuk, I, Oh BJ, So IS (1999) Induction of early flowering in Cymbidium niveo-marginatum Mak in vitro. Plant Cell Reports 19: 1-5
Kumar, VA, Kumar A, Kumar J (1995) In vitro flowering and pod formation in cauliflower (Brassica oleracea var. botrytis). Current Science 69: 543-545
Laurie, D (2004) Flowering time. En: Christou, P y Klee, H (Eds). Handbook of Plant Biotechnology (Vol 1), pp. 659-671. Wiley, Chichester
Liang, O P, Keng CL (2006) In vitro plant regeneration, flowering and fruiting of Phyllanthus niruri L. (Euphorbiaceae). International Journal of Botany 2: 409-414
Lin, CS, Chang WC (1998) Micropropagation of Bambusa edulis through nodal explants of field-grown culms and flowering of regenerated plantlets. Plant Cell Reports 17: 617-620
Lin, CS, Lin CC, Chang WC (2003) In vitro flowering of Bambusa edulis and subsequent plantlet survival. Plant Cell, Tissue and Organ Culture 72: 71-78
Lin, CS, Lin CC, Chang WC (2004) Effect of thidiazuron on vegetative tissue-derived somatic embryogenesis and flowering of bamboo Bambusa edulis. Plant Cell, Tissue and Organ Culture 76: 75-82
Lin, CS, Liang CJ, Hsaio HW, Lin MJ, Chang, WC (2007) In vitro flowering of green and albino Dendrocalamus latiflorus. New Forests 34: 177- 186
Lloyd, G, McCown B (1980) Commercially feasible micropropagation of montain laurel, Kalmia latifolia, by use of shoot-tip culture. Combined Proceedings of the International Plant Propagators Society 30: 421-442
Luo, P, Ye Q, Lan Z (2000) A study on floral biology of seedlings in vitro in Orychophragmus violaceus: Induction of flowers in seedlings of O. violaceus cultured in vitro. Plant Cell, Tissue and Organ Culture 63: 73-75
Mader, JC (2004) Differential in vitro development of inflorescences in long and short day Lemna spp.: Involvement of ethylene and polyamines. Journal of Plant Physiology 161: 653-663
Maheshwari, P, Kumar A (2006) Organogenesis, shoot regeneration, and flowering response of Vernonia cinerea to different auxin/cytokinin combinations. In vitro Cellular and Developmental Biology-Plant 42: 589-595
Makunga, NP, van Staden J (2008) An efficient system for the production of clonal plantlets of the medicinally important aromatic plant: Salvia africana-lutea L. Plant Cell, Tissue and Organ Culture 92: 63-72
McDaniel, CN King RW, Evans LT (1991) Floral determination and in vitro floral differentiation in isolated shoot apices of Lolium temulentum. Planta 182: 9-16
Metzger, JD (1987) Hormones and reproductive development. En: Davies, PJ (Ed) Plant hormones and their role in plant growth and development, pp. 431-462. Martinus Nijhoff, Dordrecht
Molina-Torres, J, Laidman DL, Gaunt JK (1989) The influence of photoperiod on incorporation of precursors into tocopherols and plastoquinone in Xanthium strumarium L. New Phytologist 111: 397-401
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497
Murashige, T, Tucker D (1969) Growth factor requirements of citrus culture. Proceedings of the 1st International Citrus Symposium 3: 1155-1161
Murthy, KSR, Ramulu DR, Rao JC, Emmanuel S, Pullaiah T (2006) In vitro flowering of Spathoglottis plicata Bl. (Orchidaceae). Phytomorphology 56: 117-120
Nadgauda, RS, Parasharami, VA y Mascarenhas, AF (1990) Precocious flowering and seeding behavior in tissue cultured bamboos. Nature 344: 335-336
Nadgauda, RS, John CK, Parasharami VA, Joshi MS, Mascarenhas AF (1997) A comparison of in vitro with in vivo flowering in bamboo: Bambusa arundinacea. Plant Cell, Tissue and Organ Culture 48: 181-188
Nair, AK, Dilip ND, Subhash PS (2007) High-frequency in vitro flowering in six species of Ceropegia. Journal of Plant Biology 50: 374-377
Naor, V, Kigel J, Ziv M (2004) Hormonal control of inflorescence development in plantlets of calla lily (Zantedeschia spp.) grown in vitro. Plant Growth Regulation 42: 7-14
Nitsch, JP, Nitsch C (1965) Néoformation de fleurs in vitro chez une espèce de jours courts: Plumbago indica L. Annales de Physiologie Vegetale 7: 251-256
Peeters, AJM, Gerards W, Barendse GWM, Wullems GJ (1991) In vitro flower bud formation in tobacco: interaction of hormones. Plant Physiology 97: 402-408
Perilleux, C, Bernier G (1997) Leaf carbohydrate status in Lolium temulentum during the induction of flowering. New Phytologist 135: 59-66
Perilleux, C, Bernier G, Kinet JM (1994) Circadian rhythms and the induction of flowering in the long-day grass Lolium temulentum L. Plant, Cell and Environment 17: 755-761
Pirson, A, Seidel F (1950) Zell- und stoffwechselphysiologische Untersuchungen an der Wurzel von Lemna minor L. unter besonderer Berücksichtigung von Kalium- und Kalziummangel. Planta 38: 431-473
Prakash, G (1977) Plant growth regulators and sex expression in flower buds of Momordica charantia in vitro. Current Science 46: 328-330
Qiao, Q, Xing F-W, Xiao Y-P, Chen H-F (2009) Somatic embryogenesis and in vitro flowering in Saposhnikovia divaricata. Journal of Plant Growth Regulation 28: 81-86
Rajasekaran, K, Mullins MG, Nair Y (1983) Flower formation in vitro by hypocotyl explants of cucumber (Cucumis sativus L.). Annals of Botany 52: 417-420
Ramanayake, SMSD, Wanniarachchi WAVR, Tennakoon TMA (2001) Axillary shoot proliferation and in vitro flowering in an adult giant bamboo, Dendrocalamus giganteus Wall. Ex Munro. In Vitro Cellular and Developmental Biology-Plant 37: 667671
Reed, JW, Foster KR, Morgan PW, Chory J (1996) Phytochrome B affects responsiveness to gibberellins in Arabidopsis. Plant Physiology 112: 337-342
Reid, R, Jones H, Smith H (2004) Phytochromes -Biotechnological prospects. En: Christou, P y Klee, H (Eds) Handbook of Plant Biotechnology (Vol 1), pp. 725-737, Wiley, Chichester.
Ringe, F, Nitsch JP (1968) Conditions leading to flower formation on excised Begonia fragments cultured in vitro. Plant and Cell Physiology 9: 639-652
Roberts, NJ, Luckman GA, Menary RC (1993) In vitro flowering of Boronia megastigma Nees. and the effect of 6-benzylaminopurine. Plant Growth Regulation 12: 117-122
Roldán, M, Gómez-Mena C, Ruiz-García L, Salinas J, Martínez-Zapater JM (1999) Sucrose availability on aerial part of the plant promotes morphogenesis and flowering of Arabidopsis in the dark. The Plant Journal 20: 581-590
Rout, GR, Das P (1994) Somatic embryogenesis and in vitro flowering of 3 species of bamboo. Plant Cell Reports 13: 683-686
Rugini, E (1984) In vitro propagation of some olive (Olea europaea Savatina L.) cultivars with different rootability, and medium development using analytical data from developing shoots and embryos. Scientia Horticulturae 24: 123-134
Sankhla, D, Davis TD, Sankhla N, Upadhyaya A (1994) In vitro production of flowering shoots in German Red carnation: effect of uniconazole and gibberellic acid. Plant Cell Reports 13: 514-518
Saritha, KV, Naidu CV (2007) In vitro flowering of Withania somnifera Dunal.-An important antitumor medicinal plant. Plant Science 172: 847-851
Saxena, SN, Kaushik N, Sharma R (2008) Effect of abscisic acid and proline on in vitro flowering in Vigna aconitifolia. Biologia Plantarum 52: 181-183
Scorza, R (1982) In vitro flowering. Horticultural Reviews 4: 106-127
Scorza, R, Janick J (1980) In vitro flowering of Passiflora suberosa L. Journal of the American Society for Horticultural Science 105: 892-897
Sharma, A, Kumar V, Giridhar P, Ravishankar GA (2008) Induction of in vitro flowering in Capsicum frutescens under the influence of silver nitrate and cobalt chloride and pollen transformation. Electronic Journal of Biotechnology 11: 1-6
Sheeja, TE, Mandal AB (2003) In vitro flowering and fruiting in tomato (Lycopersicon esculentum). Asia Pacific Journal of Molecular Biology and Biotechnology 11: 37-42
Sim, GE, Loh CS, Goh CJ (2007) High frequency early in vitro flowering of Dendrobium Madame Thong-In (Orchidaceae). Plant Cell Reports 26: 383-393
Sim, GE, Loh JG, Loh CS (2008) Induction of in vitro flowering in Dendrobium Madame Thong-In (Orchidaceae) seedlings is associated with increase in endogenous N6-(Ä2-isopentenyl)-adenine (iP) and N6-(Ä2-isopentenyl)-adenosine (iPA) levels. Plant Cell Reports 27: 1281-1289
Simmonds, J (1982) In vitro flowering on leaf explants of Streptocarpus nobilis. The influence of culture medium components on vegetative and reproductive development. Canadian Journal of Botany 60: 1461-1468
Singh, B, Sharma S, Rani G, Virk GS, Zaidi AA, Nagpal A (2006) In vitro flowering in embryogenic cultures of Kinnow mandarin (Citrus nobilis Lour x C. Deliciosa Tenora). African Journal of Biotechnology 5: 1470-1474
Sivanesan, I, Jeong BR (2007) Micropropagation and in vitro flowering in Pentanema indicum Ling. Plant Biotechnology 24: 527-532
Steffen, JD, Sachs RM, Hackett WP (1988) Bougainvillea inflorescence meristem development: comparative action of GA3 in vivo and in vitro. American Journal of Botany 75: 403-408
Tang, AF, Cappadocia M, Byrne D (1983) In vitro flowering in cassava (Manihot esculenta Crantz). Plant Cell, Tissue and Organ Culture 2: 199-206
Tanimoto, S, Harada H (1981) Effects of IAA, zeatin, ammonium nitrate and sucrose on the initiation and development of flower buds in Torenia stem segments cultured in vitro. Plant and Cell Physiology 22: 1553-1560
Taylor, NJ, Light ME, van Staden J (2005) In vitro flowering of Kniphofia leucocephala: influence of cytokinins. Plant Cell, Tissue and Organ Culture 83: 327-333
Taylor, NJ, Light ME, van Staden J (2007) Monosaccharides promote flowering in Kniphofia leucocephala in vitro. Plant Growth Regulation 52: 73-79
Tee, CS, Maziah M, Tan CS (2008) Induction of in vitro flowering in the orchid Dendrobium Sonia 17. Biologia Plantarum 52: 723-726
Tisserat, B, Galletta PD (1988) In vitro flowering in Amaranthus. HortScience 23: 210-212
Tisserat, B, Galletta PD (1993) Production of cucumber fruits from the culture of ´Marketmore-76´ plantlet. Plant Cell Reports 13: 37-40
Tisserat, B, Galletta PD, Jones D (1990) In vitro flowering from Citrus limon lateral buds. Journal of Plant Physiology 136: 56 60
Tiwari, S, Tuli R (2008) Factors promoting efficient in vitro regeneration from de-embryonated cotyledon explants of Arachis hypogaea L. Plant Cell, Tissue and Organ Culture 92: 15-24
Vacin, E, Went F (1949) Some pH changes in nutrient solution. Botanic Gardens Conservation News 110: 605-613
Vaz, APA, Figueiredo-Ribeiro RCL, Kerbauy GB (2004) Photoperiod and temperature effects on in vitro growth and flowering of P. pusilla, an epiphytic orchid. Plant Physiology and Biochemistry 42: 411-415
Virupakshi, S, Manjunatha BR, Naik GR (2002) In vitro flower induction in callus from a juvenile explant of sugarcane, Saccharum officinarum L., Var. CoC 671. Current Science 83: 1195-1197
Vu, NH, Anh PH, Nhut DT (2006) The role of sucrose and different cytokinins in the in vitro floral morphogenesis of rose (hybrid tea) cv. «First Prize». Plant Cell, Tissue and Organ Culture 87: 315-320
Wada, K, Totsuka T (1982) Long-day flowering of Perilla plants cultured in nitrogen-poor media. Plant and Cell Physiology 23: 977-985
Wang, X (1988) Tissue culture of Cymbidium: Plant and flower induction in vitro. Lindleyana 3: 184-189
Wang, S, Tang L, Chen F (2001) In vitro flowering of bitter melon. Plant Cell Reports 20: 393-397
Wang, GY, Yuan, MF, Hong Y (2002) In vitro flower induction in roses. In Vitro Cellular and Developmental Biology-Plant 38: 513-518
Zhang, Z, Leung DWM (2000) A comparison of in vitro with in vivo flowering in gentian. Plant Cell, Tissue and Organ Culture 63: 223-226
Zhang, Z, Leung DWM (2002) Factors influencing the growth of micropropagated shoots and in vitro flowering in gentian. Plant Growth Regulation 36: 245-252
Ziv, M, Naor V (2006) Flowering of geophytes in vitro. Propagation of Ornamental Plants 6: 3-16
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
