Artículo Científico Biotecnología Vegetal Vol. 9, No. 1: 33 - 40, enero - marzo, 2009
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Influencia de la época del año y el tipo de frasco en la embriogénesis somática en papaya var. Maradol rojo
Laisyn Posada-Pérez*, Alexis Rodríguez, Rafael G. Kosky, Maritza Reyes y Marisol Tejeda *Autor para correspondencia.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5 . Santa Clara, Villa Clara, Cuba. CP 54 830. e-mail: laisyn@ibp.co.cu
RESUMEN
En la embriogénesis somática en la papaya se han realizado un amplio número de investigaciones, sin embargo, el efecto del ambiente in vitro y ex vitro sobre este proceso ha sido poco estudiado. Este trabajo tuvo como objetivos determinar la influencia de la época del año para la colecta de los frutos en la fase de formación de embriones somáticos de papaya, a partir de embriones cigóticos de frutos inmaduros y el efecto del tipo de frasco de cultivo en las fases de formación y germinación de los embriones somáticos. Los resultados permitieron definir que la época del año para la colecta de los frutos inmaduros no tuvo influencia en la formación de embriones somáticos, sin embargo, al emplear frascos de cultivo de vidrio se obtuvo un 63.7% de embriones cigóticos que desarrollaron embriones somáticos. Con el empleo de este tipo de frasco se alcanzaron los mejores resultados con un 90.7% de germinación de los embriones somáticos.
Palabras clave: cultivo in vitro, embriones cigóticos, papaya, tipo de frasco de cultivo
ABSTRACT
Somatic embryogenesis in papaya has been subjected to many researches. However, the effect of ex vitro and in vitro environment on this process has been little studied. The objectives of this work were to determine the influence of the seasons for fruit harvest at the formation of papaya somatic embryos stage, from zygotic embryos of immature fruits and the effect of the kind of culture flask on the formation and germination of somatic embryos stages. Results demonstrated that the season for the collection of immature fruits did not influence on the formation of somatic embryos. Besides the use of glass culture flaks allowed to obtain 63.7% of embryos that developed zygotic embryos. The best results were achieved using this kind of culture flaks, with a 90.7% germination of somatic embryos.
Key words: in vitro culture, papaya, type of culture flask, zygotic embryos
INTRODUCCIÓN
La papaya (Carica papaya L.) es oriunda de América Central y se caracteriza por ser un cultivo productivo en corto tiempo y de forma continua durante todo el año. La producción mundial en el 2008 ascendió a 6 937 097 toneladas (FAOSTAT, 2008). La principal variedad que se cultiva en Cuba es la Maradol rojo (Pestano, 2001). Por lo tanto tiene gran importancia económica a nivel mundial, debido a que se puede consumir como fruta fresca o procesarse para obtener otros productos como dulces, jaleas, licuados y encurtidos (Acuña, 2005).
En Cuba, en los últimos años se ha incrementado el área de cultivo de la papaya, sin embargo, los niveles de producción son bajos y la oferta no se corresponde con la demanda, esto ha sido causado principalmente por las enfermedades virales, las cuales son capaces de disminuir en más de un 50% la producción de las plantaciones (Arocha et al., 2002). A esto se adicionan las lesiones provocadas por hongos sobre los frutos post-cosecha, debido a la rápida maduración que presenta esta, lo cual limita su aceptación en el mercado. Por este motivo existe la necesidad de buscar alternativas para aumentar la producción y comercialización de esta especie.
La forma tradicional de propagación de la papaya, ha sido la reproducción sexual (por semillas), también puede ser propagada por medio de estacas o injertos aunque este método de propagación no brinda los efectos deseados. Las estacas son de lento desarrollo y los injertos degeneran y no mantienen las características deseadas. Para obtener semillas de calidad, los frutos deben provenir del cruzamiento entre plantas hermafroditas, de esta manera se puede lograr un 66% de plantas hermafroditas y 33% de plantas femeninas, con esta selección existe la certeza de no aparición de plantas masculinas no productivas (Otero, 2003).
La biotecnología puede acelerar los programas convencionales de propagación masiva de plantas y dar soluciones cuando los métodos convencionales fallan. Se han desarrollado diferentes métodos de regeneración de plantas a partir del cultivo de tejidos tanto por organogénesis, Vegas et al., 2003) como por embriogénesis somática (Gallardo et al., 2004; Posada-Pérez et al., 2007), sin embargo, por ser los métodos biotecnológicos hasta el presente más costosos respecto a la vía por semilla botánica su empleo está limitado solamente para genotipos híbridos que lo justifiquen (Elder y Macleod, 2000).
En el cultivo de la papaya varias metodologías de regeneración de plantas vía embriogénesis somática han sido establecidas, pero no se han realizado estudios sobre el efecto de factores ex vitro como la época del año para la colecta de los frutos en la inducción de los embriones somáticos a partir de embriones cigóticos inmaduros, así como la influencia del tipo de frasco en el proceso de embriogénesis somática en este cultivo.
El tipo de recipiente de cultivo (tamaño, forma, material y sistema de cierre) puede condicionar la evolución de la composición gaseosa en su interior durante el cultivo. En recipientes de cultivo cerrados herméticamente se ha detectado una acumulación de gases (dióxido de carbono y etileno) que además de influir o controlar el crecimiento, también pueden afectar los procesos de diferenciación y morfogénesis (Righetti et al., 1990). Muchos de los efectos del dióxido de carbono y el oxígeno han sido descritos para el crecimiento de plantas in vitro, pero poco trabajos se han realizado sobre la influencia de la atmósfera gaseosa sobre el proceso de embriogénesis somática (Shimazu y Kurata, 1999).
La atmósfera gaseosa es un factor importante en el desarrollo de la embriogénesis somática (Abdelmalek y Francine, 1999). Rustant et al. (1990) incrementaron la capacidad embriogénica de los explantes al adicionar inhibidores del etileno. De igual forma, Barbón et al. (2008) observaron un aumento en el número de embriones somáticos de café (Coffea arabica L.) formados al disminuir las concentraciones de dióxido de carbono en los frascos de cultivo. El tipo de frasco de cultivo a emplear según el tipo de cierre y la hermeticidad del mismo tiene una influencia en la composición de la atmósfera gaseosa dentro de este, lo cual tiene un efecto sobre en el proceso de la embriogénesis somática.
Por estas razones este trabajo tuvo como objetivos determinar la influencia de la época del año para la colecta de los frutos en la fase de formación de embriones somáticos de papaya, a partir de embriones cigóticos inmaduros y el efecto del tipo de frasco de cultivo en las fases de formación y germinación de los embriones somáticos.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon frutos inmaduros (90-120 días después de la antesis) de la variedad de papaya Maradol rojo, procedentes de flores hermafroditas elongatas.
En el laboratorio primeramente fueron lavados con una solución de detergente comercial y luego se colocaron 30 minutos en una solución de hipoclorito de sodio al 1.0%( v/v) con dos o tres gotas de Tween 80 por litro de solución. Posteriormente, se lavaron dos veces con agua destilada estéril, se secaron en la cabina de flujo laminar y se procedió a abrirlos con ayuda de una cuchilla, se extrajeron las semillas y se cortaron con el auxilio de bisturí No. 11 y pinzas curvas para obtener los embriones cigóticos inmaduros (Figura 1).
Formación de embriones somáticos a partir de embriones cigóticos Influencia de la época del año
La toma de frutos inmaduros y el cultivo in vitro de los embriones cigóticos inmaduros se realizaron en la época de lluvia en los meses de marzo a junio y en la época de seca en los meses de octubre a diciembre del año 2006.
Se colocaron cuatro embriones cigóticos por frasco de vidrio con una capacidad de 250 ml, el cual contenía 30 ml de medio de cultivo compuesto por el 50% de las sales MS (Murashige y Skoog, 1962), vitaminas MS, 5 mg.l-1 de ácido 2,4-diclorofenoxiacético (2,4-D), 400 mg.l-1 de L-glutamina, 100 mg.l-1 de mio-inositol, 30 g.l-1 de sacarosa.
A las seis semanas de cultivo se evaluó:
Número de embriones cigóticos (Ec) que formaron embriones somáticos (Es).
Pérdidas durante el proceso (número de frascos contaminados por microorganismos).
Este experimento se repitió tres veces en el tiempo y se utilizaron 40 embriones cigóticos inmaduros por tratamiento. Los datos fueron procesados en el paquete estadístico Statistix ver 1.0 a los que se les realizó una prueba de proporciones.
Influencia del tipo de frasco de cultivo
Este experimento tuvo como objetivo determinar el frasco de cultivo adecuado para la formación de los embriones somáticos. Para esto se evaluaron tres tipos de frascos:
Tratamiento 1: Frascos de cultivo de 250 ml (de vidrio) con 30 ml de medio de cultivo.
Tratamiento 2: Frascos de cultivo de 500 ml (frascos de policarbamato) con 60 ml de medio de cultivo.
Tratamiento 3: Placas de Petri de vidrio, de 94 x 16 mm de diámetro con 30 ml de medio de cultivo.
En dependencia del tipo de frasco se colocaron diferentes cantidades de embriones cigóticos con el mismo volumen de medio de cultivo por explante en cada tipo de frasco evaluado (7.5 ml x embrión cigótico). Se colocaron 4, 8 y 10 embriones cigóticos por tipo de frasco. Se utilizó el mismo medio de cultivo que en el experimento anterior. A los 45 días de cultivo se evaluó el número de embriones cigóticos que formaron embriones somáticos.
Este experimento se realizó tres veces en el tiempo y se utilizaron 40 embriones cigóticos inmaduros por tratamiento. Los datos fueron procesados en el paquete estadístico Statistix ver 1.0 a los que se les realizó una prueba de proporciones.
En la fase de formación y multiplicación de los embriones somáticos los frascos de cultivo con los explantes fueron colocados en cámara de cultivo en oscuridad total y 27±2ºC.
Germinación de embriones somáticos
Influencia del tipo de frasco
En este experimento se emplearon dos tipos de frasco, uno de vidrio de 250 ml de capacidad y otro de policarbamato de 500 ml de capacidad.
Se utilizaron embriones somáticos en etapa de torpedo y cotiledonal. Estos se colocaron en un medio de cultivo que contenía el 50% de las sales MS, vitaminas MS, 0.5 mg.l-1 de 6-bencilaminopurina (6-BAP), 100 mg.l-1 de mio-inositol, 20 g.l-1 de sacarosa, 0.06 mg.l-1 de vitamina B2, y 5 g.l-1 de
Agargel. En este experimento se realizó un segundo subcultivo a los 30 días, en el mismo medio de cultivo.
A los 60 días de cultivo se evaluó el número de embriones somáticos que germinaron.
Este experimento se realizó tres veces en el tiempo y se utilizaron 30 repeticiones por tratamiento. Los datos fueron procesados en el paquete estadístico Statistix ver 1.0 a los que se les realizó una prueba de proporciones.
Las plántulas obtenidas a partir de la germinación de los embriones somáticos, se colocaron en medio de cultivo de elongación, el cual contenía las sales MS, 0.25 mg.l-1 de ácido naftalenacético (ANA) y 0.25 mg.l-1 de 6-BAP.
Posterior a las cuatro semanas de cultivo y con una altura promedio superior a los 3.0 cm, las plantas se transfirieron a un medio de cultivo de enraizamiento, compuesto por el 50% de las sales MS y 5.0 mg.l-1 de ácido indolbutírico (AIB). En este medio de cultivo permanecieron durante 10 días para inducir la formación de raíces, pues a partir de este tiempo ocurre una caída casi total de las hojas (datos de experimentos preliminares). Luego se subcultivaron a un medio de cultivo compuesto por sales MS sin reguladores de crecimiento donde permanecieron por 20 días más.
Las condiciones de cultivo para esta fase fueron luz solar con un flujo de fotones fotosintéticos de 48-62.5 mol.m-2s-1 en las cámaras de crecimiento y 27±2oC. A las cuatro semanas, las plantas fueron llevadas a condiciones ex vitro en casa de cultivo.
Como gelificante del medio de cultivo se empleó y Gelrite (Duchefa) a razón de 2.5 g.l-1 y el pH fue ajustado siempre a 5.8 con el uso del ácido clorhídrico (HCl) 1.0 M o Hidróxido de sodio (NaOH) 1.0 M previo a la esterilización.
Análisis Estadístico
En los experimentos llevados a cabo en el laboratorio se aplicó una lectura de las observaciones completamente aleatoria. Los grupos homogéneos y diferentes fueron hallados a partir de la Prueba de Proporción. El nivel de significación fijado para todas las pruebas fue del 95%, o sea p< 0.05.
RESULTADOS Y DISCUSIÓN
Formación de embriones somáticos a partir de embriones cigóticos
Influencia de la época del año
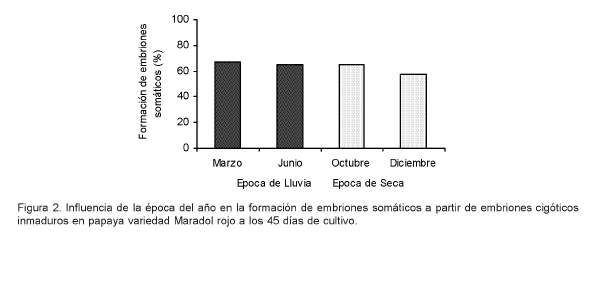
Los resultados demostraron que la época del año para la colecta de los frutos no influyó en la formación de embriones somáticos ya que no se observaron diferencias significativas entre los porcentajes de formación de embriones en los cuatro meses en los que se realizó el cultivo in vitro de los embriones cigóticos inmaduros (Figura 2).
Es importante destacar que a los 5 días de cultivo los embriones cigóticos comenzaron a abrir las hojas cotiledonales y a partir de los 20 días se observaron embriones somáticos en la zona apical. Los embriones formados se encontraban en etapa globular y presentaron una coloración amarillo claro. Se obtuvo una embriogénesis somática directa, de alta frecuencia, sin la formación de callo, con lo que se reduce el riesgo de la variabilidad genética en las plantas regeneradas. Estos resultados avalan los obtenidos por Posada-Pérez et al. (2007).
En el caso de la papaya no se encontraron publicaciones que refieran estudios sobre esta temática en este cultivo. Se conoce que el cambio estacional es uno de los factores a considerar en la respuesta embriogénica de diversos cultivos ya que las variaciones de temperatura, humedad y precipitaciones provocan fluctuaciones en las plantas, que influyen en la respuesta in vitro de los explantes. Por ejemplo, González et al. (2005) evaluaron la influencia de la época del año en la respuesta morfogénica y bioquímica de explantes foliares de Coffea canephora P. var. Robusta empleados para la formación de callos. Estos autores señalaron, que la época del año en que se tomaron los explantes ejerció un marcado efecto en su respuesta morfogénica y bioquímica en los genotipos evaluados, y comprobó que los períodos mayo - junio, enero - febrero y noviembre- diciembre resultaron más favorable dado un elevado porcentaje de formación de callos, bajos índices de actividad enzimática peroxidasa, oxidación fenólica y contaminación fúngica, así como un mayor contenido de proteínas totales.
También Bermúdez-Caraballoso (2007), pero en el cultivo del banano (Musa spp. cv Grande naine AAA) encontró una respuesta a la inducción de la embriogénesis somática cuando empleó flores masculinas inmaduras como explante inicial. Los meses de mayo y octubre fueron los de mayores porcentajes de respuesta embriogénica para Cuba. Estos resultados no parecen tener relación con la influencia que puedan tener las lluvias y la temperatura en este parámetro estudiado.
Escalant et al. (1994) plantearon que la relación entre la frecuencia e intensidad de la embriogénesis somática con el factor estacional aparecen como una incertidumbre, en el cual este último puede que tenga alguna influencia con respecto a los diferentes meses del año. En los estudios realizados por estos mismos autores en el cultivar Grande naine encontraron los mayores porcentajes de agregados embriogénicos, en orden descendente, en los meses de septiembre, octubre, marzo y abril para el caso de Costa Rica.
No obstante lo anterior, el resultado de este experimento pudo estar dado porque los frutos seleccionados procedían de un banco de semillas donde las condiciones de riego, fertilización y sanidad del cultivo estaban bien controladas y por lo tanto, dichos factores influyeron similarmente en todos los tratamientos evaluados independientemente de la época y de las condiciones del clima. Es de señalar que cuando se inicia el proceso de embriogénesis somática a partir de embriones cigóticos como sus células están predeterminadas embriogénicamente el factor que más influye, es la etapa de desarrollo de los embriones cigóticos para obtener una mayor o menor respuesta embriogénica (Merkle et al., 1995).
Influencia del tipo de frasco de cultivo
En todos los frascos de cultivos empleados se logró formar embriones somáticos a partir de los embriones cigóticos. Sin embargo, los mejores resultados se lograron en los frascos de vidrio de 250 ml de capacidad, con diferencia significativa, con respecto a las placas de Petri y a los frascos de cultivo de policarbamato, donde en estos últimos se formó la menor cantidad de embriones somáticos (Tabla 1).
Se conoce que la atmósfera gaseosa es un factor determinante en los procesos morfogénicos y está condicionada por el tipo y tamaño del envase seleccionado así como también el sistema de cobertura. Las tapas usadas en cultivo in vitro varían desde el tapón de algodón, papel de aluminio, película de resinite transparente o tapas rígidas de polipropileno. El intercambio gaseoso es diferente para cada tipo de tapa; en consecuencia, la atmósfera interna también sufrirá variaciones (Radice, 2004).
Esta diferencia significativa entre los tratamientos estudiados debe estar influenciada por la capacidad total de los frascos, o sea el ambiente interno que proporciona cada uno de ellos durante el periodo de cultivo. Por esta razón deben existir diferencias entre acumulación de sustancias gaseosas (O2 y CO2) y el intercambio gaseoso. Muchos de los efectos del CO2 y O2 han sido descritos para el crecimiento de plantas in vitro, pero poco se conoce sobre la influencia de la atmósfera gaseosa sobre el proceso de embriogénesis somática (Shimazu y Kurata, 1999). Ziv (1995) refiere que la composición del gas en el frasco de cultivo está influenciada por el volumen del vaso de cultivo y la magnitud de la ventilación.
El O2 y el CO2 son de importancia tanto para la embriogénesis cigótica como para la embriogénesis somática en algunas especies (Kvaalen y von Arnold, 1991).
Kessel y Carr (1972) demostraron que en suspensiones celulares de zanahoria existía un desarrollo de la embriogénesis si la presión parcial de O2 (pO2) disminuía, mientras que la embriogénesis del cultivo de anteras podía ser inducida con elevadas concentraciones de CO2. Este gas a pesar de su conocido efecto positivo en la fotosíntesis de las plantas, también promueve el crecimiento en suspensiones celulares heterotróficas de Caranthus roseus (Ducos et al., 1993).
Johansson y Eriksson (1984) informaron que elevadas concentraciones del CO2 es posible que se promueva la fijación en la oscuridad y mejore por esta vía el desarrollo de la embriogénesis somática en microsporas de Papaver, lo cual pudo también ocurrir en el presente experimento. También estos autores señalaron que en la especie Clematis venticela se estimuló la embriogénesis somática en cultivos de anteras cuando el tejido fue incubado a una concentración de dióxido de carbono de 2.0%, y se obtuvo un mayor rendimiento del número de embriones somáticos por explante en medio de cultivo semisólido, al mantener el material vegetal durante 60 días bajo el efecto del CO2 con respecto a otros explantes con un menor tiempo de cultivo.
Los resultados de este experimento pudieron estar dados por la mayor hermeticidad de los frascos de cultivo y placas de Petri de vidrio (tratamientos 1 y 3) con respecto a los frascos de cultivo de policarbamato (tratamiento 2), o pudo estar relacionado con la capacidad del frasco, los cuales permitieron una mayor concentración de CO2 en la atmósfera interna del frasco de cultivo, lo cual pudo haber determinado la mayor formación de embriones somáticos. Barbón et al. (2008) en Coffea arabica demostraron que la concentración de CO2 influye positivamente en la formación y multiplicación de embriones somáticos. Otra posible explicación a los resultados, es que el CO2 pudo estimular de forma directa la formación de los embriones somáticos, lo cual condujo a una modificación de los patrones de pH del medio de cultivo o de forma indirecta al producir cambios en el comportamiento del pH que favorecieron el proceso de embriogénesis somática.
El tipo de frasco de cultivo empleado, tuvo una influencia sobre el número de embriones que se obtuvieron a partir de los embriones cigóticos utilizados como explante inicial. Es necesario realizar otros estudios que permitan dilucidar la influencia de la atmósfera gaseosa, específicamente el CO2, sobre el proceso de embriogénesis somática en la fase de formación de embriones somáticos de papaya.
Germinación de los embriones somáticos
Influencia del tipo de frasco
Se logró la germinación de los embriones somáticos de papaya variedad Maradol rojo en ambos tratamientos, sin embargo, el mejor resultado se alcanzó en frascos de cultivo de vidrio con diferencias significativas en relación con los frascos de cultivo de policarbamato (Tabla 2).

En el tratamiento donde se emplearon frascos de cultivo de vidrio la germinación de los embriones somáticos se estimuló progresivamente, siendo el número de embriones somáticos germinados mayor que en los frascos de cultivo de policarbamato. A los 10 días de cultivo comenzaron a observarse en los frascos de vidrio embriones somáticos con una coloración verde clara y elongación del eje hipócotilo, mientras que en los frascos de cultivo de policarbamato demoró 20 días para que comenzara el proceso de germinación (Figura 3).
Este comportamiento puede ser explicado, entre otras, por dos razones, la primera relacionada con la incidencia de la intensidad luminosa sobre el frasco de cultivo, donde los frascos de policarbamato son menos transparentes y la luz incide con menor intensidad hacia el interior del mismo, lo que pudo provocar la disminución del porcentaje de germinación de los embriones somáticos. La segunda razón, por la posible influencia favorable de la atmósfera gaseosa en el interior de los frascos de vidrio que propició el mayor porcentaje de germinación de embriones somáticos. Este resultado fue referido también por Barbón (2003), quien demostró el efecto positivo del CO2 sobre la germinación de los embriones somáticos pero de Coffea arabica.
Cabe señalar que durante el desarrollo de este experimento fue necesario realizar un segundo subcultivo en el mismo medio de cultivo de germinación, para completar el desarrollo de los embriones somáticos germinados y aumentar el porcentaje con la germinación de los embriones somáticos que no habían germinado. Se evidenció que en el caso de los frascos de vidrio, las plantas in vitro se elongaron ligeramente y hubo un mayor desarrollo de las estructuras formadas donde se observó la formación de pequeñas hojas pero sin mucho desarrollo del tallo (Figura 4). Resultados similares obtuvieron Gallardo et al. (2004) y Posada-Pérez et al. (2007) y quienes refirieron haber realizados hasta tres subcultivos para lograr la germinación completa de los embriones somáticos.
En los frascos de cultivo de vidrio las plantas in vitro se desarrollaron completamente, con varias hojas verdaderas bien formadas (Figura 5), por lo que se tomó este tipo del frasco como el de mejores resultados.
Debido a que en esta especie la germinación de los embriones somáticos ocurre de forma parcial (Posada-Pérez et al., 2007), fue necesario utilizar un medio de cultivo para elongar las plantas in vitro y posteriormente que las mismas enraizaran.





Crecimiento y desarrollo de las plantas in vitro
Las plantas in vitro bien formadas obtenidas a partir de la germinación de los embriones somáticos, al ser colocadas en medio de cultivo de elongación presentaron una fuerte vigor y color verde oscuro en sus cuatro pares de hojas como promedio (Figura 6). Por otra parte, existió un desarrollo de las yemas laterales, lo que debió estar dado por la pérdida de la dominancia apical, por ambos subcultivos en medio de cultivo de germinación con citoquininas.
Se logró el enraizamiento de las plantas in vitro, al ser colocadas en el medio de cultivo de enraizamiento propuesto por Posada-Pérez et al. (2007). Las raíces presentaron una coloración blanca y alcanzaron una longitud de 5 cm como promedio. Además, presentaban muchas raíces secundarias. Debido a las características de esta fase donde se colocaron los explantes 10 días en medio de cultivo con auxina (AIB) y luego se subcultivaron a medio de cultivo sin regulador de crecimiento por un período de 20 días, le permitió a las plantas in vitro que alcanzaran una altura mayor (3-4 cm).
CONCLUSIONES
Se demostró que la época del año para la colecta de los frutos inmaduros no tuvo influencia en la formación de embriones somáticos. Al emplear frascos de vidrio se alcanzó un 63.7% de embriones cigóticos que desarrollaron embriones somáticos en papaya variedad Maradol rojo. Además, logró un 90.7% de germinación de los embriones somáticos al emplear frascos de cultivo de vidrio a los 30 días de cultivo.
REFERENCIAS
Abdelmalek, M, Francine M (1999) Effects of sealed and vented gaseous microenviroments on the maturation of somatic embryos of black spruce with a special emphasis on ethylene. Plant Cell. Tissue and Organ Culture 56: 201-209
Acuña, LE (2005) El cultivo de Mamón (Carica papaya) [en línea] En: <http://www.agronegocios.gob.sv/comoproducir/guias/ papaya.pdf> [consulta: 9 de Noviembre 2008]
Arocha,Y, Horta D, Roque A (2002) Detección de diferentes patógenos en plantas de papaya con sintomatología compleja en Cuba. I Simposio Internacional sobre Vigilancia Fitosanitaria y su relación con la Protección del entorno. Palacio de las Convenciones. La Habana. Cuba
Barbón, RR (2003) Aspectos relacionados con el ambiente físico y la caracterización molecular de la embriogénesis somática. Biotecnología Vegetal 3 (4): 211-221
Barbón, R, Jiménez E, Preil W (2008) Influence of in vitro environment on somatic embryogenesis of Coffea arabica L. cv. Caturra rojo: the effects of carbon dioxide on embryogenic cell suspensions. Plant Cell, Tissue and Organ Culture 95 (2): 155- 161
Bermudez-Caraballoso, I (2007) Transformación genética de banano cv. Gran Enano (AAA) mediante Agrobacterium tumefaciens para la búsqueda de resistencia a la Sigatoka negra (Mycosphaerella Fijiensis Morelet) Tesis de Doctorado. UCLV. IBP. Santa Clara
Ducos,J P, Zamarripa A, Eskes A, Pétiard V (1993) Production of somatic embryos of coffee in a biorreactor. 15éme Colloq. Sci. Int. Café. Montpellier, 6-11 june, Paris
Elder, R J, Macleod W N B (2000) Growth, yield and phenology of 2 hybrid papayas (Carica papaya L.) as influenced by method of water application. Australian Journal of Experimental Agriculture 40(5): 739-746
Escalant JV, Teisson C, Cote F (1994) Amplified somatic embryogenesis from male flowers of triploid banana and plantain cultivars (Musa spp.). In Vitro Cellular and Developmental Biology- Plant 30: 181-186
FAOSTAT (2008) Base de Datos estadística de la FAO [en línea] En: http://faostat.fao.org/site/567 [consulta: 6 de Enero 2009]
Gallardo, J, Kosky R, Tejeda M, Posada-Pérez L, Herrera I, Reyes M, García L, Freire-Seijo M (2004) Empleo de secciones de tallo de plantas in vitro de papaya (híbrido IBP 42-99) para obtener callos con estructuras embriogénicas. Biotecnología Vegetal 4(4): 213-216
González, ME, Hernández MM, Mazorra JM, Rodríguez Y, Cabrera M (2005) Influencia de la época del año y el genotipo en la respuesta morfológica y bioquímica de explantes foliares de Coffea canephora P. var. Robusta empleados para la formación de callos. Biotecnología Vegetal 5 (2): 121 - 127
Johansson, L, Erikson T (1984) Effects of carbon dioxide in antier cultures. Physiol. Plant. 60: 26-30
Kessel, R H J, Carr A H (1972) The effect of dissolved oxygen concentration on growth and differentiation of carrot (Daucus carota) tissue. J. Exp. Botany 23: 996-1007
Kvaalen, H, von Arnold, S (1991) Effects of various parcial pressures of oxygen and carbon dioxide on different stages of somatic embryogenesis in Picea abies. Plant Cell and Organ Culture 27: 49-57
Merkle, SA, Parrott WA, Flinn BS (1995) Morphogenic aspects of somatic embryogenesis En: TA. Thorpe (ed.) In vitro embryogenesis in plants, pp.156-204. Kluwer Academic Publishers, Dordrech
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15: 473-497
Otero, P (2003) Maradol Roja certificada [en línea] en: http:// www.semilladelcaribe.com.mx/paginas/tecno.htm> [consulta: 8 diciembre 2005]
Pestano, B (2001) El cultivo de la papaya [en línea] En: <http:/ /www.gacicuba.net/Pestano6.htm> [consulta: 6 diciembre 2005]
Posada-Pérez, L, Kosky RG, Reyes M (2007) Regeneración de plantas vía embriogénesis somática en papaya var. Maradol Rojo. Biotecnología vegetal 7(3):131-141
Radice S, (2004) Morfogénesis in vitro. En: Echeniqye V, Rubinstein C, Mroginski L (Eds.), Biotecnología y mejoramiento vegetal. Ediciones INTA, Buenos Aires
Righetti, B, Magananini E, Infante R, Pedrieri, S (1990) Ethylene, etanol, acetaldehyde and carbon dioxide released by Prunus avium shoot cultures. Physiologia Plantarum 78: 507-510
Roustan, J P, Latché A, Fallot J (1990) Inhibition of ethylene production and stimulacion of carrot somatic embryogenesis by salicylic acid. Biol. Plant 32: 273
Shimazu, T, Kurata K (1999) Relationship between production of carrot somatic embryos and dissolved oxygen concentration in liquid culture. Plant Cell Tissue and Organ Culture 57: 29-38
Vegas, A, Trujillo G, Sandrea Y, Mata J (2003) Obtención, regeneración y evaluación de híbridos intergenéricos entre Carica papaya y Vasconcellea cauliflora. INTERCIENCIA 28 (12): 710 714
Ziv, M (1995) The control of bioreactor environment for plant propagation in liquid culture. Acta Horticulturae 393: 25-38
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
