Artículo Científico Biotecnología Vegetal Vol. 9, No. 1: 53 - 59, enero - marzo, 2009
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Establecimiento y multiplicación in vitro de Curcuma longa L. In vitro establishment and multiplication of Curcuma longa L.
Ángel Espinosa Reyes*, Juan José Silva Pupo, Misterbino Borges García, Lilien Fajardo Rosabal, Jorge Pérez Pérez, Orlando González Paneque, Sandra Sariego Frómeta. *Autor para correspondencia
Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma. Carretera a Manzanillo km 17.5. Bayamo. Granma. Cuba. e-mail: aespinosar@udg.co.cu
RESUMEN
La cúrcuma es una planta muy apreciada como condimento, colorante y por sus propiedades medicinales. Aunque se han logrado resultados en su propagación in vitro aún los índices de establecimiento y multiplicación in vitro son bajos. El objetivo de este trabajo fue determinar el efecto de la longitud de la yema, el estado físico del medio de cultivo y la concentración de sales inorgánicas y reguladores del crecimiento en el establecimiento y multiplicación in vitro de cúrcuma. En el establecimiento se utilizaron yemas extraídas de rizomas principales, las cuales se desinfectaron, se eliminaron varias capas de primordios foliares y se cortaron yemas de 0.5-0.7 cm, 0.8-1.0 cm y de 1.1-1.3 cm de longitud. Para la multiplicación se usaron plantas in vitro de 30 días de establecidas y al medio de cultivo basal se adicionaron diferentes concentraciones de 6-BAP (0.0, 2.0, 4.0, 6.0 mg.l-1). Además, se determinó el efecto de adicionar las sales MS al 25, 50, 75 y 100% (control), así como emplear el medio de cultivo en estado líquido o semisólido. Se logró aumentar los valores de desinfección y establecimiento in vitro publicados para el cultivo, al utili zar yemas terminales con una longitud de 0.8-1.0 cm e hipoclorito de sodio al 2% de cloro activo durante 25 minutos. Durante la multiplicación in vitro se obtuvieron valores en cuanto al número de brotes por explante, longitud de los brotes y número de raíces por brote similares a los publicados previamente.
Palabras clave: micropropagación, plantas in vitro, sales MS
ABSTRACT
Turmeric is a very valuable plant as condiment, dye and due to its medicinal properties. Although results achieved in the in vitro propagation, rates of in vitro establishment and multiplication are low. The aim of this study was to determine the effect of bud length, physical state of culture medium and concentration of inorganic salts and growth regulators in the in vitro establishment and multiplication of turmeric. Buds taken from main rhizomes were used in the establishment.They were disinfected, several layers of leaf primordia were removed and buds were cut into 0.5-0.7 cm, 0.8-1.0 cm and 1.1-1.3 cm. In vitro plants of established after 30 days were used for multiplication. Various concentrations of 6-BAP (0.0, 2.0, 4.0, 6.0 mg.l-1) were added to basal culture medium. Besides, the effect of adding MS salts 25, 50, 75 and 100% (control) and the use of liquid or semisolid culture medium was determined. It did increase The values of disinfection and in vitro establishment, referred in literature, for the culture were increase since terminal buds of 0.8-1.0 cm and sodium hypochlorite 2% of active chlorine for 25 minutes were used. During the in vitro multiplication, values for the number of shoots per explant, length of shoots and number of roots per shoot were similar to those previously referred in literature.
Keywords: in vitro plant, micropropagation, MS salts
INTRODUCCIÓN
La cúrcuma (Curcuma longa L. sin. Curcuma domestica Val) es una planta muy apreciada como condimento y colorante (Hossain e Ishimine, 2005). Han sido comprobadas muchas propiedades medicinales en este cultivo, destacándose las hepatoprotectoras y antioxidantes (Cousins et al., 2007) mediadas por su fuerte poder antioxidante y su alta capacidad de protección del ácido desoxirribonucleico (ADN) contra el daño peroxidativo (Bingwen y Ping, 2007). También es preventiva del cáncer y de los desórdenes cardiovasculares (Mesa et al., 2000). Además, posee reconocidas propiedades antiinflamatorias y antiescleróticas (Chaniani, 2003), lo que justifica su uso en el tratamiento de inflamaciones y artritis, así como en la prevención de arteriosclerosis y tromboembolismos. Igualmente, se ha comprobado su eficacia en el control de desórdenes respiratorios, gastrointestinales y en afecciones de la piel como psoriasis o eczemas.
En Cuba, era considerada como una planta silvestre hasta la década del 90 del siglo pasado, en que comenzó a prestársele atención (Terán, 2002) y ha comenzado a utilizarse industrialmente en la producción de la salsa Panchita (INIVIT, 2002). Por otra parte, se han desarrollado investigaciones relacionadas con la extracción, caracterización y evaluación de sus propiedades medicinales (Vistel et al., 2003; Medina et al., 2006).
Nadgauda et al. (1978), fueron los primeros en publicar un protocolo para la micropropagación de cúrcuma, el cual mostró bajos porcentajes de establecimiento y multiplicación. En otros estudios, Balachandran et al. (1999), informaron sobre resultados en la propagación y conservación in vitro por crecimiento mínimo de tres especies de cúrcuma (Curcuma aeruginosa, Curcuma caesia y Curcuma longa). Posteriormente, Salvi et al. (2002), empleando un medio de cultivo con 6-bencilaminopurina (6-BAP) y ácido nalftalenacético (ANA) para la multiplicación in vitro, lograron elevar el número de brotes por explante y con ello el índice de multiplicación. Sin embargo, los índices de establecimiento y multiplicación in vitro en este cultivo aún son bajos, por lo que es necesario continuar estudios relacionados con el tipo de explante, el estado y composición química del medio de cultivo, que permitan incrementarlos.
Por estas razones este trabajo tuvo como objetivo determinar el efecto de la longitud de la yema, el estado físico del medio de cultivo y la concentración de sales inorgánicas y reguladores del crecimiento en el establecimiento y multiplicación in vitro de cúrcuma.
MATERIALES Y MÉTODOS
El presente trabajo se realizó en el Centro de Estudios de Biotecnología Vegetal de la Facultad de Ciencias Agrícolas en la Universidad de Granma (UDG).
Se emplearon rizomas sanos y libres de daños mecánicos de plantas de cúrcuma provenientes del Instituto Nacional de Ciencias Agrícolas (INCA). Estos fueron sometidos a una minuciosa limpieza, y se eliminaron los restos de follaje, suelo y raíces. Luego se lavaron con una disolución de hipoclorito de sodio al 0.5% de cloro activo durante cinco minutos y fueron almacenados a temperatura ambiente en condiciones de laboratorio, hasta que se produjo la brotación espontánea de las yemas terminales. Cuando las yemas alcanzaron una longitud de 2.0-3.0 cm se colectaron para el cultivo in vitro.
Medios y condiciones de cultivo
En los diferentes experimentos realizados in vitro se utilizó como medio de cultivo basal el constituido por las sales y vitaminas propuestas por Murashige y Skoog (1962), al que se le adicionó mio-inositol 100.0 mg.l-1, sacarosa 30.0 g.l-1 y agar 6.0 g.l-1.
El pH de los medios de cultivo se ajustó 5.7 antes de la esterilización. En todos los experimentos se utilizaron frascos de 100 ml a los que se adicionaron 10.0 ml de medio de cultivo. La incubación del material vegetal se realizó en cámaras de luz solar, a 27±2°C, intensidad luminosa de 45-54 mmolm-2s-1 y humedad relativa de 80 a 85%.
En todos los casos se empleó un diseño completamente aleatorizado.
Desinfección
Las yemas extraídas de los rizomas se lavaron en agitación continua durante 30 minutos en agua con detergente y posteriormente se enjuagaron con agua destilada. Se colocaron en frascos de vidrio de 250 ml y se les añadió la solución desinfectante. La desinfección se realizó en la cámara de flujo laminar. Se conformaron cuatro tratamientos con dos concentraciones de Hipoclorito de Sodio (HS) (1.0 y 2.0% de cloro activo) y dos tiempos de inmersión (15 y 25 min).
Luego de la desinfección superficial, las yemas se enjuagaron tres veces con agua destilada estéril y con la ayuda de un bisturí, se eliminaron varias capas de primordios foliares hasta reducir la longitud de la yema a 1.0-1.5 cm. Las yemas se colocaron en el medio de cultivo propuesto por Salvi et al. (2002).
A los 20 días posteriores a la siembra se cuantificó el número de yemas sin contaminación microbiana visible y el número de yemas vivas. Con estos valores se calculó el porcentaje de desinfección y el porcentaje de supervivencia.
Efecto de la longitud de la yema en el establecimiento in vitro
El objetivo de este experimento fue evaluar la influencia de la longitud de las yemas terminales en el establecimiento in vitro de cúrcuma.
Se utilizaron yemas extraídas de rizomas principales, las cuales se desinfectaron superficialmente teniendo en cuenta el mejor resultado obtenido en el experimento de desinfección. En la cabina de flujo laminar, después de enjuagadas las yemas, se eliminaron varias capas de primordios foliares y se cortaron yemas de 0.5-0.7 cm, 0.8-1.0 cm y de 1.1-1.3 cm de longitud.
Se utilizó el medio de cultivo propuesto por Salvi et al. (2002).
A los 30 días posteriores a la siembra se cuantificó el número de yemas sin contaminación microbiana visible y el número de yemas vivas. Con estos valores se calculó el porcentaje de desinfección y el porcentaje de supervivencia. Además, se midió la longitud de los brotes (cm) con una regla desde la base del tallo hasta el ápice de la hoja superior totalmente extendida.
Efecto de 6-bencilaminopurina (6-BAP) en la multiplicación in vitro
Para desarrollar el ensayo se usaron plantas in vitro de cúrcuma de 30 días de establecidas. Se utilizaron 40 repeticiones por cada tratamiento. Se empleó el medio de cultivo basal propuesto por Salvi et al. (2002), al que se adicionaron diferentes concentraciones de 6-BAP (0.0, 2.0, 4.0, 6.0 mg.l-1).
Después de 30 días de cultivo se cuantificó el número de brotes por yema, el número de hojas por brote y el número de raíces por brote. Además, se midió la longitud del brote (cm).
Influencia de la concentración de las sales MS en la multiplicación in vitro
El medio de cultivo basal propuesto por Salvi et al. (2002) se complementó con 6-BAP 2.0 mg.l-1 y ANA 0.1 mg.l-1. Se utilizaron plantas in vitro de 30 días de establecidas. El tamaño de muestra utilizado fue de 40 plantas in vitro por tratamiento. Las sales MS se adicionaron al 25, 50, 75 y 100% (control).
Después de 30 días de cultivo se cuantificó el número de brotes por yema, el número de hojas por brote y el número de raíces por brote. Además, se midió la longitud del brote (cm).
Influencia del estado físico del medio de cultivo en la multiplicación in vitro
Se emplearon plantas in vitro de 30 días de establecidas. El medio de cultivo utilizado fue el propuesto por Salvi et al. (2002), con sales MS reducidas al 75% de su concentración y complementado con 6-BAP 2.0 mg.l-1 y ANA 0.1 mg.l-1. Se emplearon 40 plantas in vitro por cada tratamiento.
Los tratamientos evaluados fueron:
T1: Medio de cultivo líquido estático con soporte de papel de filtro.
T2: Medio de cultivo solidificado con agar E (BIOCEN) 6.0 g.l-1 (Semisólido)
Después de 30 días de cultivo se cuantificó el número de brotes por yema, el número de hojas
por brote y el número de raíces por brote. Además, se midió la longitud del brote (cm).
Análisis estadístico
Para el procesamiento estadístico de los datos, la normalidad fue comprobada por la prueba de Kolmogorov- Smirnov y homogeneidad de la varianza por la prueba de Levene. Los datos obtenidos al evaluar la desinfección, supervivencia y establecimiento expresados en porcentaje fueron procesados mediante un análisis de comparación de proporciones, según el paquete estadístico diseñado para ese fin en el Departamento de Matemática Aplicada del Instituto Nacional de Ciencias Agrícolas (INCA), La Habana.
Para el resto de las variables de los diferentes experimentos fue realizado un análisis de varianza simple. Se utilizó el paquete estadístico STATISTICA (1998) versión 6.0 sobre Windows. En todos los casos cuando existieron diferencias significativas entre las medias fue aplicada la prueba de comparación múltiple de rango de Tukey para p≤ 0.05.
RESULTADOS Y DISCUSIÓN
Desinfección
En los tratamientos utilizados no se presentaron explantes muertos, lo cual indicó que las concentraciones del desinfectante y los tiempos de exposición empleados no causaron daños letales al tejido interno de las yemas.
Los mayores porcentajes de yemas libres de contaminantes visibles se obtuvieron en el tratamiento con hipoclorito de sodio al 2% de cloro activo durante 25 minutos con el 87.5%, sin diferencias significativas con el tratamiento en que se empleó el hipoclorito de sodio al 1% durante 25 minutos, estos tratamientos difieren significativamente del resto de los tratamientos donde se alcanzaron valores de desinfección por debajo del 60%.
Los resultados se consideran aceptables para este cultivo, teniendo en cuenta que los rizomas son la fuente de los explantes. Los rizomas estuvieron durante un largo periodo de tiempo contacto con el suelo, por lo cual es de suponer que en su superficie existieran gran cantidad de microorganismos edáficos.
González y Terán (2004), utilizaron diferentes tratamientos para la desinfección de yemas de cúrcuma. Estos autores sólo obtuvieron éxito, al tratar los rizomas con hipoclorito de sodio al 1% durante 24 horas y luego desinfectar las yemas con cloro comercial al 0.5% durante 5 minutos, con el cual redujeron la contaminación a un 20%.
La respuesta obtenida en el presente trabajo indica que el aumento del tiempo de exposición al agente desinfectante, propició un mejor contacto del hipoclorito de sodio con los microorganismos contaminantes que pueden encontrarse en la superficie o tejidos de los explantes.
Los resultados coinciden con los informados por Sharma y Singh (1997), quienes lograron porcentajes de desinfección superiores al 90% al emplear hipoclorito de sodio al 1% de cloro activo durante 20 minutos en la desinfección de yemas de jengibre (Zingiber officinale Roscoe).
Efecto de la longitud de la yema en el establecimiento in vitro
Al analizar el porcentaje de desinfección, se observó que disminuyó a medida que aumentó la longitud de la yema (Tabla 1). Se obtuvieron valores significativamente mayores cuando se utilizaron yemas de 0.5-0.7 cm de longitud. Esta respuesta pudiera estar dada porque los explantes de menor tamaño están menos contaminados por los microorganismos, debido a que las capas interiores de primordios foliares están menos expuestas a los microorganismos contaminantes, además, las zonas meristemática y apical se caracterizan por una activa división celular y una alta actividad metabólica que dificultan el desarrollo de contaminantes.
En estudios realizados por Miguélez et al. (2001), al evaluar el efecto del tamaño del explante obtuvieron los mayores porcentajes de establecimiento, cuando utilizaron yemas de Dieffenbachia picta de 1.0-2.0 mm de largo, en comparación a cuando emplearon yemas de 5.0-6.0 mm.
El porcentaje de supervivencia fue mayor a medida que aumentó la longitud de la yema. Cuando se utilizaron yemas de 0.5-0.7 cm se obtuvo una supervivencia (68%) significativamente menor que en los demás tratamientos. La longitud del brote en los tratamientos 2 y 3 alcanzó valores de 2.08 y 1.91 cm respectivamente, sin diferencias entre ellos, pero significativamente superiores al tratamiento 1, en el cual los brotes alcanzaron una longitud de 1.25 cm, lo cual pudiera atribuirse a que las yemas más pequeñas disponen de menor cantidad de reservas, además, en ellas las cantidades de reguladores del crecimiento endógenos son menores que en los explantes de mayor tamaño.
En estudios realizados por Miguélez et al. (2001), cuando evaluaron yemas de diferentes tamaños en el establecimiento de Dieffenbachia picta, observaron que las yemas de 1.0-2.0 mm de largo manifestaron un crecimiento muy lento, mientras que yemas de un mayor tamaño mostraron un crecimiento vigoroso y más notable, resultados que coinciden con los obtenidos en el presente trabajo.
De igual forma, Blanco y Valverde (2004), para evaluar el efecto del tamaño del explante, se lograron porcentajes de supervivencia superiores al 90% durante el establecimiento in vitro de Philodrendrum sp. con el empleo de yemas de 0.5-2.0 cm de longitud. Estos mismos autores observaron que explantes de menor tamaño se necrosaron fácilmente.
Al realizar un balance entre la desinfección y la supervivencia, se concluyó que en el tratamiento donde se utilizaron las yemas de 0.8-1.0 cm de longitud se obtuvieron los mejores resultados, por lo que fue utilizado en los experimentos siguientes.
Efecto de 6-bencilaminopurina en la multiplicación in vitro
La adición de 6-BAP en el medio de cultivo provocó un aumento en el número de brotes por yema. Las concentraciones de 2.0 y 4.0 mg.l-1 proporcionaron los mayores valores (Tabla 2).
La longitud del brote disminuyó a medida que aumentó la concentración de 6-BAP. Cuando se utilizaron 4.0 y 6.0 mg.l-1 se obtuvieron brotes de 1.55 y 1.40 cm respectivamente, significativamente menores que en los demás tratamientos, resultados que pudieran estar relacionados con el efecto inhibidor de la dominancia apical que provocan las citoquininas.

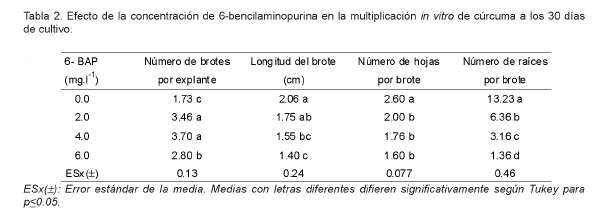
Igualmente, el número de hojas por brote disminuyó significativamente cuando se añadió 6- BAP al medio de cultivo, pero sin diferencias significativas entre las concentraciones utilizadas. El número de raíces por brote disminuyó significativamente al incluir 6-BAP en el medio de cultivo y mantuvo este comportamiento a medida que se aumentó la concentración de la citoquinina. A la concentración de 6.0 mg.l-1 el desarrollo de las raíces y su crecimiento fue prácticamente inhibido.
Los resultados del presente trabajo coinciden con referidos por Nayak y Pradeep (2006), quienes observaron que el aumento de la concentración de 6-BAP de 0.92 a 3.0 mg.l-1, resultó en un incremento del número de brotes y lograron un mayor número de brotes por yema, cuando utilizaron un medio de cultivo con 3.0 mg.l-1 de 6-BAP en la micropropagación de cúrcuma. El uso de concentraciones mayores de esta citoquinina provocó la disminución del número de brotes.
En estudios más recientes, Stanley y Keng (2007), lograron la multiplicación y regeneración de yemas de Curcuma zeodaria en un medio de cultivo constituido por las sales Murashige y Skoog (1962), y diferentes concentraciones de 6-BAP (1.0-5.0 mg.l-1) y kinetina (0.5-1.0 mg.l-1) y determinaron que la concentración de 5.0 mg.l-1 de 6-BAP fue la óptima para la multiplicación in vitro.
Influencia de la concentración de las sales MS en la multiplicación in vitro
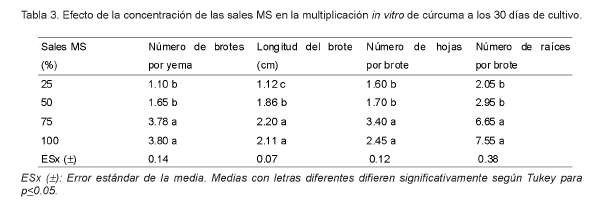
La concentración de sales MS en el medio de cultivo influyó en la multiplicación in vitro de cúrcuma. En la tabla 3 se observa la tendencia general a aumentar los valores de las variables evaluadas al incrementarse la concentración de las sales MS. Los mayores valores del número de brotes por yema correspondieron con los tratamientos en los cuales se utilizaron las mayores concentraciones de sales (75 y 100%), que difirieron de forma significativa del resto.
También los mejores resultados de la longitud de los brotes y el número de hojas y raíces por brote se lograron en los medios de cultivo con mayores concentraciones de sales (75 y 100%), con valores significativamente mayores a los obtenidos en los tratamientos donde se utilizaron las sales diluidas al 25 y 50% de su concentración.
Los resultados indican que la cúrcuma es un cultivo que requiere de altas concentraciones de sales inorgánicas para su desarrollo, y la disminución del contenido mineral en el medio de cultivo provoca retardos en su crecimiento y multiplicación.
Mroginski y Scocchi (1998), durante la conservación in vitro de meristemos de Paraíso (Melia azedarach), por un periodo de seis meses, observaron que la reducción de la concentración de las sales Murashige y Skoog (1962) hasta un 25%, provocó una reducción significativa en el crecimiento y desarrollo de las plantas.
Alvarado et al. (2000), en la micropropagación de ruda (Ruta graviolens), lograron un mayor número de yemas brotadas, mayor longitud de los brotes y mayor número de nudos cuando utilizaron sales MS al 100% de su concentración.
Influencia del estado físico del medio de cultivo en la multiplicación in vitro
En la tabla 4, puede observarse que el mayor número de brotes por yema se alcanzó en el medio de cultivo en estado semisólido con valores de 3.76 significativamente superiores a los producidos cuando se utilizó el medio de cultivo líquido.
Sin embargo, con el empleo del medio de cultivo semisólido, se obtuvieron brotes significativamente menores, con valores de 2.04 cm de longitud, en relación con los obtenidos en el medio de cultivo líquido, en el que se lograron brotes de 2.57 cm de longitud promedio.
El número de hojas por brote no mostró diferencias entre los tratamientos evaluados.
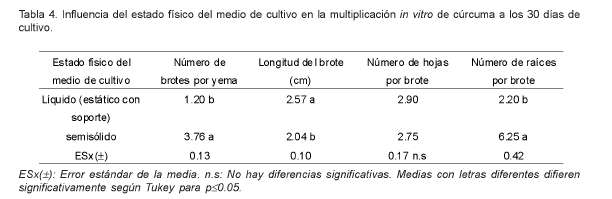
Cuando se utilizó el medio de cultivo líquido se redujo significativamente la formación y desarrollo de las raíces. En este tratamiento se registraron valores de 2.20 raíces por brote, significativamente menores a los obtenidos en el medio de cultivo semisólido, en el cual se alcanzaron valores promedios de 6.25 raíces por explante.
Salvi et al. (2002), utilizaron el medio de cultivo líquido, pero en agitación continua para la micropropagación de cúrcuma. En estas condiciones obtuvieron un mayor número de brotes por explante y brotes de mayor longitud en relación con el medio de cultivo semisólido, lo cual sugiere que la oxigenación sistemática del medio de cultivo cuando se encuentra en estado líquido es indispensable para lograr una buena respuesta en este cultivo.
Estudios realizados por Jiménez et al. (2002), en relación con la micropropagación de plátanos (Musa sp.), permitieron recomendar el empleo de medios de cultivo semisólidos para inducir brotes axilares en esta especie, debido a que se logra mayor cantidad de brotes por explante y de mejor calidad. Estos autores atribuyeron este resultados a que en el medio de cultivo semisólido se logra una mejor oxigenación de los explantes y con ello se reducen de los daños por hipoxia.
Los resultados de la presente investigación coinciden con los obtenidos por Chirangini y Sharma (2005), quienes evaluaron el efecto del estado físico del medio de cultivo en la micropropagación de jengibre y obtuvieron valores del número de brotes por explantes, significativamente superiores cuando utilizaron el medio de cultivo solidificado con agar 8.0 g.l-1.
CONCLUSIONES
Se comprobó que la longitud de la yema, el estado físico del medio de cultivo y la concentración de sales inorgánicas y reguladores del crecimiento influyen en el establecimiento y multiplicación in vitro de cúrcuma. De esta manera, se logró aumentar los valores de desinfección y establecimiento in vitro publicados para el cultivo, al utilizar yemas terminales con una longitud de 0.8-1.0 cm e hipoclorito de sodio al 2% de cloro activo durante 25 minutos. Durante la multiplicación in vitro se obtuvieron valores en cuanto al número de brotes por explante (3.80), longitud de los brotes (2.20 cm) y número de raíces por brote (6.65) similares a los publicados en la micropropagación de la cúrcuma, cuando se empleó el medio de cultivo con las sales MS al 75% de su concentración, con 2.0 mg.l-1 de 6-BAP y solidificado con agar-E 6.0 g.l-1.
REFERENCIAS
Alvarado, K, Cala M, Rodríguez R (2000) Efecto de la concentraciones de sales MS en el establecimiento in vitro de segmentos nodales de Ruda. En: Libro de resúmenes. XIII Seminario Científico. Instituto Nacional de Ciencias Agrícolas. La Habana. Cuba
Balachandran, SM, Bhat SR, Chandel K (1999) In vitro clonal multiplication of turmeric (Curcuma spp.) and ginger (Zingiber officinale Rosc.) Plant Cell Report 8: 521- 524
Bingwen, J, Ping, C (2007) Curcumin prevents lipopolysaccharide-induced atrogin-1/MAFbx up regulation and muscle mass loss. Journal of Cellular Biochemistry 100 (4): 960
Blanco, M, Valverde R (2004) Micropropagación de Philodendron sp. (posiblemente P. corcovadense.). Agronomía costarricense 28 (001): 39-46
Chainani, N (2003) Safety and anti-inflammatory activity of curcumin: A component of turmeric (Curcuma longa). The Journal of Alternative and Complementary Medicine 9 (1): 161-168
Chirangini, P, Sharma GJ (2005) In vitro propagation and microrhizome induction in Zingiber cassumunar (Roxb.) an antioxidant-rich medicinal plant. Journal of Food, Agriculture & Environment 3(1): 139-142
Cousins, M, Adelberg J, Chen F, Rieck J (2007) Antioxidant capacity of fresh and dried rhizomes from four clones of turmeric (Curcuma longa L.) grown in vitro. Industrial Crops & Products 25(2): 129-135
González, M, Terán Z (2004) Multiplicación in vitro de la Curcuma longa L. Alimentaria 352: 83-84
Hossain, M, Ishimine Y (2005) Growth, yield and quality of turmeric (Curcuma longa L.) cultivated in dark-red soil, gray soil and red soil in Okinawa. Plant Production Science 8(4): 482-486
INIVIT (2002) Descripción, caracterización y usos de la Curcuma spp. Plegable. Instituto de Viandas Tropicales. Santo Domingo. Villa Clara. Cuba
Jiménez, F, Ramírez A, Agramonte D (2002) Empleo de Biobrás-16 en la micropropagación del cultivar de plátano FHIA- 21 (AAAB). Biotecnología Vegetal 2(3): 131-136
Mesa, M, Ramírez M, Aguilera C, Ramírez A, Gil A (2000) Efectos farmacológicos y nutricionales de los extractos de Curcuma longa L. y de los cucuminoides. Ars Pharmaceutica 41(3): 307-321
Miguélez, Y, Trujillo R, Daquinta M, Concepción O, Nápoles, L (2001) Micropropagación de Dieffenbachia picta. Biotecnología Vegetal 1(1): 49-55
Mroginski, L, Scocchi A (1998) Conservación de germoplasma de Paraíso (Melia azedarach) mediante el cultivo de meristemos. Libro de resúmenes. III Encuentro Latinoamericano de Biotecnología Vegetal. Palacio de las Convenciones. Ciudad de la Habana. Cuba
Murashigue, T, Skoog, F (1962) A revised medium for rapid growth and biossays with tobacco tissue culture. Physiol. Plant. 15: 173-197
Nadgauda, R, Mascarenhas F, Hendre R, Jagannathan V (1978) Rapid clonal multiplication of turmeric (Curcuma longa L.) plants by tissue culture. Indian Journal Exp. Biol. 16: 120-122
Nayak, S, Pradeep KN (2006) Factors effecting in vitro microrhizome formation and growth in Curcuma longa L. and improved field performance of micropropagated plants. ScienceAsia 32: 31-37
Salvi, N, George L, Eapen S (2002) Micropropagation and field evaluation of micropropagated plants of turmeric. Plant Cell, Tissue and Organ Culture 68: 143-151
Sharma, R, Singh M (1997) High-frequency in vitro multiplication of disease-free Zingiber officinale Rosc. Plant Cell Reports 17: 68-72
Stanley, C, Keng K (2007) Micropropagation of Curcuma zedoaria Roscoe and Zingiber zerumbet Smith. Biotechnology 6(4): 555-560
Terán, Z (2002) Establecimiento de diferentes variantes agrotécnicas en el cultivo de la Yuquilla o Cúrcuma (Cúrcuma longa Lin), sin.(Curcuma doméstica) y de la Flor de Jamaica (Hibiscus sabdariffa Lin). Informe final. Proyecto de investigación. Instituto Nacional de Ciencias Agrícolas. Cuba
Vistel, M, Ríos I, Freire A, Silveira, D (2003). Curcuma longa L. Un estudio integrador. INFOGEST 2003. Cuba
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
