Comunicación Corta Biotecnología Vegetal Vol. 9, No. 1: 61 - 64, enero - marzo, 2009
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Control in vitro de Mycosphaerella fijiensis con bacterias aisladas de la filosfera de banano
Mileidy Cruz-Martín*, Yelenys Alvarado-Capó, Cynthia Sánchez-García, Mayra Acosta-Suárez, Berkis Roque, Michel Leiva-Mora. *Autor para correspondencia
Instituto de Biotecnología de las Plantas (IBP). Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: mileidy@ibp.co.cu
RESUMEN
En el estudio de comunidades microbianas asociadas a los cultivos han sido encontrados microorganismos con efectos beneficiosos para suprimir enfermedades. En la interacción Musa-M. fijiensis poco se conoce sobre el efecto de factores bióticos. El presente trabajo tuvo como objetivo: aislar, identificar y caracterizar cepas bacterianas con actividad antifúngica frente a Mycosphaerella fijiensis. Se realizaron los aislamiento bacterianos de la filosfera de bananos y se identificaron morfológica y bioquímicamente. Para la caracterización de la actividad antifúngica se determinó la produción de compuestos difusibles. De los aislados bacterianos fue seleccionado el CCIBP-B.1, ya que exhibió un marcado efecto inhibitorio del crecimiento de Mycosphaerella fijiensis y se identificó como perteneciente al género Bacillus. Los compuestos exudados al medio de cultivo mostraron un efecto inhibitorio en el crecimiento de M.fijiensis y produjeron deformaciones en las hifas. Estos resultados sugieren una excreción por parte de CCIBP-B.1 de metabolitos antifúngicos. Los resultados pudieran contribuir a profundizar en el conocimiento de la interacción planta microorganismo con el fin de trazar estrategias más eficientes de mejoramiento de Musa.
Palabras clave: bacteria, metabolitos antifúngicos, Sigatoka negra, biocontrol
ABSTRACT
Microorganisms with profitable effects to eliminate disseases have been found in the study of microbial communities associated with plants. Little is known about biotic factors in the interaction of Musa-M. fijiensis. This paper was aimed to isolate, identify and characterize bacterial strains with antifungal activity against Mycosphaerella fijiensis. Bacterial strains from phyllosphere were isolated and, morfologically and biochemically identify . The antifungal activity of bacteria were determined by the production of difusibles compounds in culture media. The isolate CCIBP-B.1 was selected because it showed a marked inhibitory effect in the micelial growth of Mycosphaerella fijiensis and it was identified as Bacillus.spp. The compounds exudated in culture media by CCIBP-B.1, showed an inhibitory effect on the micelial growth and produced malformation in hyphae of Mycosphaerella fijiensis. Results contribute with new approaches and perpectives in the biological control and management of M. fijiensis using the data known about Musa-M. fijiensis interactions to design more efficient Musa breeding strategies.
Key words: bacteria, antifungal metabolite, Black sigatoka, biocontrol
INTRODUCCIÓN
Las fermedades fúngicas que afectan a los plátanos y bananos, en particular la Sigatoka negra (Mycosphaerella fijiensis Morelet), tiene un gran impacto económico, social y ambiental. Los costos de manejo de esta enfermedad en plantaciones comerciales son muy altos, así como el daño al medio ambiente que conlleva el uso excesivo de productos químicos. La aparición de cepas de Mycosphaerella fijiensis menos sensibles o resistentes a los fungicidas usados tradicionalmentes así como el incremento mundial de las demandas por las medidas de bioseguridad ha propiciado un aumento en el interés de encontrar alternativas biológicas para el control de la Sigatoka negra (Marín et al., 2003).
Muchos son los microorganismos que se encuentran naturalmente asociados a las plantas, ya sean endófita o saprofíticamente, sin producir enfermedades, y a los cuales se le han demostrado efectos beneficiosos (Beattie, 2007). La resistencia a patógenos y la promoción del crecimiento han sido los más estudiados. Varias son las especies de bacteria que han sido seleccionadas, como posibles controles biológicos, por promover el crecimiento y la sanidad de los cultivos. En el patosistema Musa-M. fijiensis, poco se conoce sobre el efecto de factores bióticos en dicha interacción. El conocimiento de la biología de la interacción planta-microorganimo y microorganismo-microorganismo pudiera brindar nuevas estrategias para el mejoramiento génetico (Collinge et al., 2008).
Especies de bacterias tales como Pseudomonas spp. (González et al., 1996), Serratia entomophyla, Serratia marcescens y Bacillus cereus (Rivero et al., 2003) han sido estudiadas para el control de M. fijiensis. En particular, las especies del género
Bacillus poseen características especiales, tales como: la formación de endosporas termorresistentes a agentes perjudiciales como la desecación, la radiación, los ácidos grasos y los desinfectantes químicos (Setlow, 2006), así como una amplia gama de compuestos químicos que excretan al medio de cultivo con actividad antimicrobiana que les posibilita ocupar un lugar importante como agentes de control biológico (Chan et al., 2009; Ongena et al., 2005).
Teniendo en cuenta la necesidad de estudiar nuevas vías de control frente a M. fijiensis se realizó este trabajo con el objetivo de aislar, identificar y caracterizar cepas bacterianas de la filosferade banano con actividad antifúngica in vitro frente a M. fijiensis.
MATERIALES Y MÉTODOS
El aislado de M. fijiensis CCIBP-Pf-39 perteneciente a la colección de cultivos microbianos del Laboratorio de Fitopatología del Instituto de Biotecnología de las Plantas (IBP) fue empleado para todos los ensayos donde se utilizaron suspensiones miceliales (5.104 fragmentos de micelio.ml-1) como inóculo inicial.
Las bacterias fueron aisladas de la filosfera de plantas de banano (Grande naine, Musa AAA) mediante el método de lavado de las hojas (González et al., 1996) y empleando diluciones seriadas. Los aislados obtenidos fueron subcultivados y mantenidos en medio de cultivo Agar Nutriente (AN) a 4 ºC
Los ensayos de actividad antifúngica fueron llevados a cabo según el método de cultivo dual. Para ello, se distribuyó un mililitro de una suspensión micelial de M. fijiensis (CCIBP-Pf-39) en placas de Petri (90mm) con medio de cultivo Agar Papa dextrosa (PDA) y fueron incubadas por dos días, pasado este tiempo se aplicó en uno de los extremos de la placa una alícuota de 7ì l de suspensión bacteriana (5.109 ufc. ml-1) y se incubaron a 28 ºC durante 5 días.Se seleccionó una cepa y se evaluó su crecimiento y la producción de metabolitos secundarios. Esta cepa fue caracterizada morfológica y bioquímicamente siguiendo los criterios del Bergeys Manual of Systematic Bacteriology. Las cepas bacterianas sin actividad antifúngica fueron eliminadas.
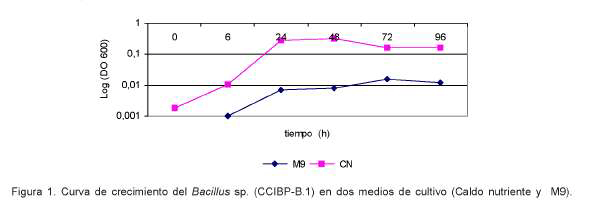
Se realizaron estudios de crecimiento en dos medios de cultivo, Caldo nutriente (CN) y M9 (NH4C (1g.l-1), Na2HP04 x 7H2O (11 g. .l-1) , KH2PO4 (3 g.l-1 ), NaCl (5 g.l-1), glucosa(4 g.l-1 ), MgSO4 (120 mg.l-1 ), CaCl2 (10 mg.l-1)), medio de cultivo salino empleado por Hou et al. (2006) para la obtención de metabolitos antifúngicos a partir de Bacillus subtilis. Para dicho esperimento se se utilizó, como inóculo inicial, una suspensión bacteriana con una D.O600nm=1. De esta suspensión se inoculó 1 ml en enlermeyer de 100ml de capacidad con 50 ml de medio de cultivo. Los frascos se incubaron en agitación durante cinco días, a 120 rpm y 26 ºC. Se incluyeron tres réplicas por medio de cultivo. Las evaluaciones se realizaron a las 0, 6, 24, 48, 72, 96 h en las cuales se midió D.O600nm.Como blanco se empleó medio de cultivo sin inocular. Además, se determinó actividad antifúngica con los filtrados de cultivos a las 96h de incubación mediante el método de dilución en agar.
Para la caracterizacion de la actividad antifúngica de la cepa bacteriana se determinó la produción de compuestos antifúngicos difusibles y se empleó el método descrito por Montealegre et al. (2003) con pequeñas modificaciones que se describen a continuación. En el centro de las placas de Petri de 70 mm de diámetro con medio de cultivo PDA, se colocó una membrana de filtro de 0.2-ìm (Millipore). En la mebrana se aplicó la suspensión bacteriana (5.109 ufc.ml-1). Las placas se incubaron por 72 horas a 30ºC pasado este tiempo se retiró la mebrana y se inoculó la suspensión micelial de M. fijiensis. Posteriormente se incubaron a 28ºC durante 7 días y observó la presencia de crecimiento fúngico (presencia o no de crecimiento visible del micelio). Se incluyó un control con agua desionizada estéril en lugar de la suspensión bacteriana. Se emplearon tres réplicas y se repitió al menos tres veces.
RESULTADOS Y DISCUSIÓN
De los aislados bacterianos obtenidos fue seleccionado el aislado CCIBP-B.1, ya que exhibió un marcado efecto inhibitorio del crecimiento del aislado de Mycosphaerella fijiensis. Se identificó como perteneciente al género Bacillus. Este género ha sido descrito en la literatura científica como productor de una amplia gama de compuestos con actividad antifúngica tales como subtilina, bacitracina, bacilina y bacilomicina, los cuales se encuentran dentro de la famila de las iturinas (Alippi y Mónaco, 1994) así como otro lipopéctido como fengicina, los cuales constituyen surfactantes y antibióticos con cierta especificidad (Chang et al., 2009). Además algunas proteínas con actividad antifúngica (glucanasas y quitinasas) han sido aisladas en este género bacteriano (Huang et al., 2005).
Se encontraron diferencias en cuanto a la velocidad de crecimiento en los medios de cultivo evaluados (Figura 1).
Al evaluar el efecto de los filtrados de cultivos de ambos medios de cultivo frente a M. fijiensis no se observó actividad antifúngica en el filtrado obtenido con el medio de cultivo M9. En la literatura científica se ha documentado ampliamente el efecto de las condiciones de cultivo y en particular la composición del medio de cultivo en en el crecimiento y la producción de compuestos por parte de las células bacteriana. Por ejemplo, Leifert et al. (1995) evaluaron ocho medios de cultivo para la produccion de antibióticos a partir de cepas de Bacillus pumillus y B. subtilis, y encontraron diferencias tanto a la velocidad como a la producción o no de los compuestos antifúngicos.
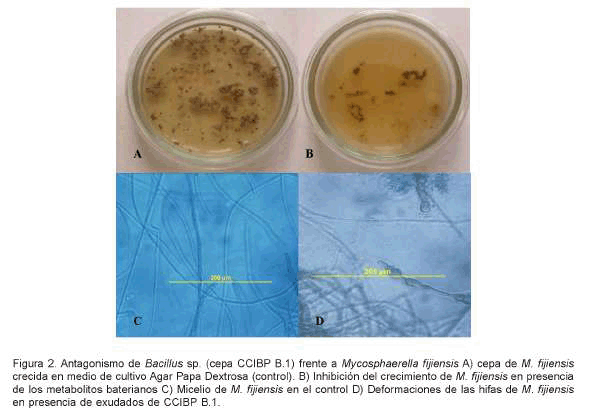
Los compuestos difundidos al medio de cultivo por la cepa CCIBP-B.1 mostraron un efecto inhibitorio en el crecimiento de M.fijiensis. No se apreció crecimiento micelial en las placas con presencia de metabolitos bacterianos excretados y el micelio añadido como inóculo se observó con consistencia acuosa. El daño causado por los metabolitos bacterianos en el crecimiento micelial fue observado microscópicamente. Estos estudios revelaron la presencia de hifas de aspecto anormal con deformación e hinchamiento en sus extremos (Figura 2).
Las transformaciones observadas en las hifas pueden corresponderse a una afectación en la pared celular, debido al efecto tóxico de los metabolitos que interfieren con los procesos normales de crecimiento. Según Huber et al. (1966) la apariencia vacuolar del micelio puede ser probablemente causada por la acción de los metabolitos bacterianos los cuales penetran a la célula y causan disolución protoplasmita y desintegración.
Podile y Prakash (1996) refirieron la lisis y disolución del micelio de Aspergillus niger por la acción de la cepa AF1 de Bacillus subtilis así como Daami-Ramada et al. (2006) lo refiere en Fusarium spp. También fue observado por Silva et al. (2001) como resultado del tratamiento de Rhizoctonia solani con B. subtilis y B. lentimorbus, tales deformaciones fueron achacadas a la secreción de antibióticos por estas bacterias ya que no fue detectada la presencia de enzimas involucradas en el biocontrol tales como glucanasas, proteasas y quitinasas.
Similares deformaciones fueron observadas por Basha y Kandasany (2002) en hifas de Curvularia lunata en presencia de la fracción proteica de exudados de Bacillus sp. cepa (BC 121) aislada de la rizosfera. Igualmente, observaciones de este tipo han sido realizadas en el antagonismo de cepas de Burkhorderia cepacia y Pseudomonas aeruginosa frente a Colletotrichum gloesporioides (Rahman et al., 2007).
Al transferir el micelio de M. fijiensis tratado con los metabolitos bacterianos a placas de Petri con medio de cultivo PDA libre de estos se observó al cabo de los 7 días que no hubo crecimiento visible del micelio y no cambió su aspecto. Este resultado demuestra el efecto fungicida de los metabolitos difundidos al medio de cultivo, traducido en un daño irreversible al micelio.
CONCLUSIONES
Este estudio básico condujo a que la cepa CCIBP-B.1 perteneciente al género Bacillus mostró propiedades antagonistas frente a M. fijiensis probablemente mediante la excreción de sustancias antifúngicas que inhiben el crecimiento micelial. Estas observaciones y estudios posteriores pueden contribuir al conocimiento de la interacción microorganismo-microorganismo con el fin de diseñar nuevas y más efectivas estrategias de mejoramiento genético de Musa y a la formulación de productos biológicos para el control de la Sigatoka negra.
REFERENCIAS
Basha, S, Kandasamy U (2002) Antagonism of Bacillus species (strain BC121) towards Curvularia lunata. Current science 82(12) 1457-1465
Beattie, G (2007) Plant-associated becteria: Survey, molecular phylogeny, genomics and recent advances. En: Gnanamanickan, SS (Ed) Plant-Associated bacteria, pp 1-56. Springer. Dordrecht
Daami-Remadi, M, Ayed F, Jabnoun-Khiareddine H, Hibar K, El Mahioub M (2006) Effects of some Bacillus sp. Isolates on Fusarium spp. in vitro and Potato tuber dry rot development in vivo. Plant Pathology Journal 5(3): 283-290
Chan, YK, Savard ME, Reid LM, McCormick WA, Segui C (2009) Identification of lipopeptide antibiotics of a Bacillus subtilis isolate and their control of Fusarium graminearum diseases in maize and wheat. BioControl 54:567574
Collinge, D, Lund O, Thordad-Christensen H (2008) What are the prospects for genetically engineered, disease resistant plants? Eur J Plant Pathol 121: 217-231
Hou, X, Boyetchko S, Brkic M, Olson D, Ross A, Hegedus D (2006) Characterization of the anti-fungal activity of a
Bacillus spp. associated with sclerotia from Sclerotinia sclerotiorum. Appl Microbiol Biotechnol 72: 644-653
González, R, Bustamante E, Shannon Ph, Okumoto S, Leandro G (1996) Selección de microorganismos quitinolíticos en el control de Sigatoka negra (Mycosphaerella fijiensis) en bananos. Manejo Integrado de plagas 40: 6-11
Huber, D, Andersen A, Finley A (1966) Mechanisms of biological control in bean root rot soil. Phytopathology 56: 953-956
Leifert, C, Li H, Chidburee S, Hamson S, Workman S, Sigee D, Epton H, Harbour A (1995) Antibiotic production and biocontrol activity by Bacillus subtilis CL27 and Bacillus pumillus CL45.Journal of applied bacteriology 78: 97-108
Marín, D, Romero R, Guzmán M, Sutton T (2003) Black Sigatoka: An increasing threat to banana cultivation. Plant disease 87(3): 208-222
Montealegre, J, Reyes R, Pérez L, Herrera R, Silva P, Besoain X (2003) Selection of bioantagonistic bacteria to be used in biological control of Rhizoctonia solani in tomato. Electronic Journal of Biotechnology 6(2): 115-127
Ongena, M, Jacques P, Touré Y, Destain J, Jabrane A, Thonart P (2005) Involvement of fengycin-type lipopeptides in the multifaceted biocontrol potential of Bacillus subtilis. Appl Microbiol Biotechnol 69: 2938
Podile, AR, Prakash A (1996) Lysis and biological control of Aspergillus niger by Bacillus subtilis AF 1. Can. J. Microbiol. 42(6): 533-538
Rahman, M, Kadir J, Mahmud T, Rahman R , Begum M (2007) Screening of Antagonistic bacteria for biocontrol activities on Colletotrichum gloeosporioides in Papaya. Asian Journal of Plant Science 6(1): 12-20
Riveros, A, Giraldo C, Gamboa A (2003) Microbial control of Black leaf streak disease. En: Jacome, L, Leoivre P, Marín D, Ortiz R, Romero R, Escalant V (eds) Mycosphaerella leaf spot disease of bananas, present status and outlook. pp. 287-298. Procceding of the Workshop on Mycosphaerella leaf spot disease held in San José, Costa Rica
Huang, CJ, Wang TK, Chung SC, Chen CY (2005). Identification of an antifungal chitinase from a potential biocontrol agent, Bacillus cereus 28-9. J Biochem Mol Biol 38(1):82-88
Setlow P. (2006) Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. Journal of Applied Microbiology 101(3): 514525
Silva, P, Montealegre J, Besoain X, Perez L (2001) Efecto de bacterias biocontroladoras sobre germinación y desarrollo de tomate y sobre expresión de proteínas de defensa. En: Congreso Sociedad Chilena de Fitopatología. pp 129. Santa Cruz, Chile
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
