Artículo Científico Biotecnología Vegetal Vol. 9, No. 2: 119 - 125, abril - junio, 2009
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Formación de embriones somáticos del cultivar FHIA-21 (Musa AAAB) en medios de cultivo líquido
Leyanis García-Águila*, Rafael G. Kosky, Yelenys Alvarado-Capó, Zoe Sarría, Maritza Reyes. *Autor para correspondencia.
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas, Carretera a Camajuaní km 5.5 Santa Clara, Villa Clara. Cuba, CP 54 830. *e-mail: leyanis@ibp.co.cu.
RESUMEN
El trabajo tuvo como objetivo desarrollar la formación de embriones somáticos (Es) de FHIA-21 (Musa AAAB) en medio de cultivo líquido, a partir de suspensiones celulares embriogénicas. Se estudiaron cuatro densidades de inoculación (0.5; 1.0; 1.5 y 2.0g de masa fresca (gMF) de agregados celulares embriogénicos) en Erlenmeyers de 250 ml de capacidad total, que contenían 30 ml de medio de cultivo. Las evaluaciones se realizaron a los 30 días de cultivo y se determinaron las variables siguientes: número de Es, longitud de los Es (mm) y características morfológicas e histológicas. Los resultados mostraron el efecto regulatorio de la densidad de inoculación en la formación y desarrollo morfológico de los Es. En este sentido, la baja densidad (0.5 y 1.0 gMF) trajo como consecuencia menor número de Es, de mayor tamaño y avanzado desarrollo ontogénico. Sin embargo, la alta densidad de inoculación (1.5 y 2.0 gMF) produjo mayor número de Es de tamaño uniforme y en etapa globular.
Palabras clave: densidad de inoculación, histología, medio de cultivo líquido, morfología
ABSTRACT
The study aimed to develop somatic embryos (Es) formation of cv. FHIA-21 (Musa AAAB) in liquid culture medium, from embryogenic cell suspensions. Four inoculation densities (0.5, 1.0, 1.5 and 2.0g of fresh mass (GMF) of embryogenic cell aggregates) in 250 ml Erlenmeyer capacity, which contained 30 ml of culture medium were studied. Evaluations were made within 30 days of culture. Tthe following variables were identified: number of Es, length (mm), and morphological and histological features. Results showed the regulatory effect of inoculation density on the formation and morphological development of Es. In this sense, the low density (0.5 and 1.0 GMF) brought about less amount of ES, which were larger and with more advanced ontogenetic development. However, the high density of inoculation (1.5 and 2.0 GMF) produced larger number of uniform size Es and in the globular stage.
Keywords: histology, morphology, liquid culture medium, inoculation density
INTRODUCCIÓN
El cultivar de plátano FHIA-21 (Musa AAAB) se introdujo en Cuba por su resistencia a la enfermedad Sigatoka negra y por sus características agronómicas y organolépticas (Orellana et al., 1999). Su propagación in vitro se ha efectuado a partir del cultivo de ápices meristemáticos. Sin embargo, el bajo coeficiente de multiplicación y el crecimiento de brotes en forma de rosetas (García et al., 2002) limitaron el empleo de este sistema de regeneración de plantas en la propagación masiva de este cultivar. La utilización de la embriogénesis somática pudiera solucionar esta problemática debido a su potencial ilimitado de multiplicación clonal, proporcionado por la capacidad de multiplicación secundaria o recurrente de los embriones somáticos (Es), aunque su principal desventaja radica en la formación asincrónica de Es en diferentes etapas de desarrollo ontogénico (Celestino et al., 2005).
En plátanos y bananos, el desarrollo de la embriogénesis somática ha tenido progresos significativos mostrados a través de diferentes artículos científicos. Entre los resultados está la formación de callos con estructuras embriogénicas a partir de flores masculinas inmaduras y el establecimiento de suspensiones celulares embriogénicas (Escalant et al., 1994; Côte et al., 1996; Grapin et al., 1998). Tomando como base estos resultados varios autores han anunciado la regeneración de plantas en diferentes cultivares de Musa. Por ejemplo, Khalil et al. (2002) regeneraron gran número (890) de plantas del cv. de banano Dwarf Brazilian (Musa AAB) a través de la multiplicación secundaria de embriones somáticos en medio de cultivo semisólido. En contraste, y en menor medida, se ha descrito la formación de Es en medios de cultivo líquido y entre los resultados más significativos se encuentran los de Kosky et al. (2002) en el cv. FHIA-18 (Musa AAAB) y los de Cabrera et al. (2002) en el cv. Navoleam (Musa ABB). Estos autores coinciden en que uno de los factores más importantes en la formación de Es tanto en medio de cultivo semisólido como líquido lo constituye la densidad inicial de inoculación.
El desarrollo de la embriogénesis somática en medios de cultivo líquido aumenta las ventajas de este sistema de regeneración de plantas, si se tiene en cuenta que incorpora beneficios adicionales como la reducción de los costos por la ausencia del agente gelificante y la posibilidad de automatización del proceso (Gupta y Timmis, 2005). Además, facilita las operaciones de renovación del medio de cultivo, la colecta de los embriones somáticos y el monitoreo de parámetros físicos (Ducos et al., 2007).
En el cv. FHIA-21, Daniels et al. (2002) desarrollaron un protocolo de transformación genética utilizando como sistema de regeneración la embriogénesis somática. Estos resultados sentaron las bases para la formación de Es en medio de cultivo semisólido; sin embargo el empleo de medios de cultivo líquido pudiera mejorar la eficiencia del proceso.
Teniendo en cuenta los aspectos anteriormente descritos, este trabajo tuvo como objetivo formar embriones somáticos de FHIA-21 en medio de cultivo líquido, para su posterior utilización en la propagación masiva.
MATERIALES Y MÉTODOS
Como material vegetal se utilizaron inflorescencias de FHIA-21 seleccionadas de plantaciones comerciales. Estas fueron colectadas inmediatamente después de emitida la última flor femenina (mano).
La extracción de las flores masculinas inmaduras para la formación de callos con estructuras embriogénicas se efectuó siguiendo el procedimiento descrito por Escalant et al. (1994) para el cv. Grande naine. Los callos con estructuras embriogénicas formados (Figura 1) fueron utilizados para el establecimiento de suspensiones celulares embriogénicas (SCE).
El procedimiento se realizó inoculando 150 mg de masa fresca (mgMF) del callo en Erlenmeyers (25 ml de volumen total) que contenían 3.0 ml del medio de cultivo líquido propuesto por Daniels et al (2002) para el establecimiento y multiplicación de SCE de este cultivar. Este medio de cultivo contenía las sales y vitaminas MS (Murashige y Skoog, 1962); 0.5 mg.l-1 de biotina, 100 mg.l-1 de L-glutamina; 100 mg.l-1 de extracto de malta; 3.0 mg.l-1 de ácido 2,4-dicloro fenoxiacético (2-4-D) y 45 g.l-1 de sacarosa. El pH fue ajustado a 5.3 previo a la esterilización.
A los 30 días de cultivo, las SCE fueron tamizadas por filtros de malla metálica de 0.5 mm de longitud de poro. La multiplicación de las SCE se efectuó inoculando 1.0 ml de agregados celulares embriogénicos (menores de 0.5 mm) en Erlenmeyer de 250 ml de capacidad total que contenían 30 ml de medio de cultivo. Después de cinco subcultivos cada 30 días, las SCE obtenidas en fase de multiplicación fueron utilizadas en el estudio de formación de los embriones somáticos en medio de cultivo líquido.

Efecto de la densidad de inoculación en la formación de embriones somáticos
El experimento tuvo como objetivo determinar el efecto de cuatro densidades de inoculación sobre la formación y diferenciación de Es en medio de cultivo líquido. Se adicionaron 0.5, 1.0, 1.5 y 2.0 g de masa fresca (gMF) de agregados celulares embriogénicos en Erlenmeyers de 250 ml de capacidad total, que contenían 30 ml de medio de cultivo. Se utilizó el medio de cultivo propuesto por Bieberach (1995) compuesto por el 100% de las sales inorgánicas SH (Schenk e Hildebrandt,1972), 100% de las vitaminas MS; 1.0 mg.l-1 de biotina, 100 mg.l-1 de extracto de malta, 100 mg.l-1 de L-glutamina, 230 mg.l-1 de L-prolina, 10 mg.l-1 de lactosa, 0.05 mg.l-1 de zeatina, 100 mg.l-1 de mio-inositol, 0.2 mg.l-1 de ácido naftalenacético (ANA), 0.2 mg.l-1 de isopenilaminopurina (2ip), 0.1 mg.l-1 de Kinetina y 45 g.l-1 de sacarosa. El pH se ajustó a 5.3 previo a la esterilización.
Los Erlenmeyers se colocaron en un agitador orbital (INFORS HT) a 90 rpm de velocidad, en oscuridad total y 27±2.0 ºC. Se establecieron cinco repeticiones por cada densidad de inoculación con un diseño experimental completamente aleatorizado.
Las evaluaciones se realizaron a los 30 días de cultivo y se determinaron las variables siguientes: número de Es, longitud de los Es (mm) y se describieron seis características morfológicas e histológicas.
Para cuantificar el número de Es se extrajeron 500 ì l de la suspensión celular embriogénica por Elenmeryers correspondiente a cada tratamiento y se adicionaron en un vaso de precipitado (50 ml de capacidad) que contenía 30 ml de una solución de Gelrite ® (SIGMA) (2.5 g.l-1) y agua. Luego el contenido se vertió en una placa de Petri de 70 mm de diámetro y se dejó solidificar. El conteo de los Es se realizó con la ayuda de un microscopio estereoscópico (WILD M8, LEICA).
Para describir las características morfológicas y medir la longitud de los Es (mm) se extrajeron 100 ì l de la suspensión celular embriogénica por Elenmeryers y se siguió el procedimiento descrito anteriormente. La longitud de los Es se determinó con una escala micrométrica y el empleo del microscopio estereoscópico.
Para realizar las secciones histológicas, los Es se colocaron durante 24 horas en una solución de fijación que contenía 37% de formaldehído, 100% de ácido acético y 70% de etanol, en una proporción 5:5:90. Posteriormente fueron deshidratados en un gradiente ascendente de etanol y embebidos en parafina. Se efectuaron cortes seriados de 0.9 a 1.0 mm de grosor con un micrótomo de rotación (Zeiss, Alemania). Los cortes se extendieron y fijaron en portaobjetos para realizar tinción con safranina al 0.5%. Las secciones histológicas de las diferentes muestras se examinaron en microscopio óptico (AXIOSKOP) y las imágenes fueron captadas con una cámara digital (CANON).
Los datos experimentales se procesaron mediante un análisis de varianza (ANOVA) de clasificación simple. La comparación de los valores medios se efectuó mediante la prueba de Dunnett C, con un nivel de significación de 0.05.
RESULTADOS Y DISCUSIÓN
Efecto de la densidad de inoculación en la formación de embriones somáticos
Se observó la formación de Es en los tratamientos con las cuatro densidades de inoculación (0.5, 1.0, 1.5, 2.0). A los 30 días de cultivo el mayor número de Es se obtuvo con las densidades de 1.5 gMF, y 2.0 gMF sin diferencias estadisticas entre ellos. En esta evaluación se observó un incremento del número de Es en la medida que aumentó la densidad de inoculación inicial (Tabla 1). En la Figura 2 se muestran los Es en suspensión formados en 1.5 gMF de densidad de inóculo.



Como consecuencia del efecto de la densidad de inoculación se observaron diferencias en el aspecto morfológico de los Es primarios y en su multiplicación secundaria. A los 30 días de cultivo los Es de mayor longitud se observaron en las menores densidades de inoculación (0.5 y 1.0 gMF). Estas densidades también presentaron mayor diversidad de longitudes, la cual varió de 0.2 a 1.0mm. No obstante, los mayores porcentajes de estos Es se enmarcaron entre 0.4 y 0.8mm (50.0 y 60.5%, respectivamente). Por otra parte, los Es formados en 1.5 gMF presentaron mayor uniformidad del tamaño. El 86.3% tenían de 0.2 a 0.4mm de longitud. Sin embargo, los Es obtenidos con 2.0 gMF las menores longitudes, distribuidos desde 0.1 a 0.4mm (Tabla 2). Las diferencias en la longitud de los Es de FHIA-21 (AAAB) pueden estar relacionadas con su desarrollo ontogénico.
A través del estudio histológico se observó la avanzada diferenciación de los Es de mayor longitud (0.4 y 0.8mm) formados en 0.5 y 1.0 gMF de densidad de inóculo inicial. El análisis de las secciones histológicas mostró la presencia de una protodermis definida y el comienzo de la formación de las bandas procambiables. Estas se identificaron en la región central del embrión con células organizadas en un tejido relativamente compacto (Figura 3).
La multiplicación de los Es en las menores densidades de inoculación se caracterizó por la formación de embriones secundarios en la base de los embriones primarios. Los Es cultivados en 1.0 gMF presentaron mayor número de embriones secundarios, con respecto a los cultivados en 0.5 gMF, agrupados en masas de embriones de apariencia globular (Figura 4).
El resultado de los estudios morfológicos e histológicos realizados a los Es formados en las menores densidades (0.5 y 1.0 gMF) evidenciaron una marcada asincronía en el desarrollo de los embriones. Esto se manifestó a través de la gran diversidad de tamaño de los Es, debido a las diferencias que se presenta entre el embrión primario y los secundarios.
Sin embargo, los Es formados con alta densidad de inóculo (1.5 y 2.0 gMF) mostraron mayor uniformidad en la longitud ya que su multiplicación secundaria se caracterizó por la formación de masas de proembriones y embriones globulares. Estos embriones secundarios mostraron similar aspecto morfológico que el embrión primario que les dio origen (Figura 5).


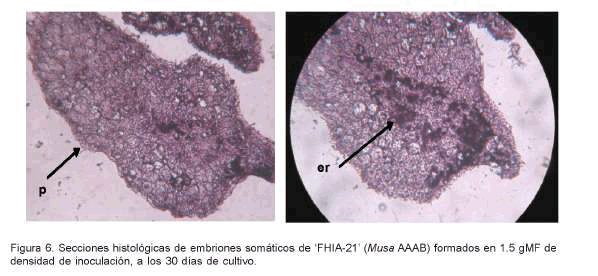
En la Figura 6 se muestran evidencias histológicas de los Es formados y multiplicados en 1.5 gMF de densidad de inóculo. Estas permiten inferir que los Es presentaban poco desarrollo ontogénico, característico de la etapa globular.
El análisis de las secciones histológicas de los Es cultivados en 1.5 gMF reveló una clara definición de la protodermis y la presencia de células meristemáticas con intensa actividad mitótica. Además, se observaron estructuras de reserva en células de la región central cercana a la base del embrión (Figura 6).
Se conoce que las etapas de desarrollo ontogénico de los Es en especies monocotiledóneas transitan rápidamente y este es el caso del género Musa. No obstante, el estudio morfológico a través de la determinación del tamaño y el análisis histológico de los Es de FHIA-21 permitieron identificar su grado de desarrollo. Además, se diferenció la densidad de inóculo que proporcionó mayor uniformidad del proceso de embriogénesis somática. Estos aspectos son importantes para el empleo de este sistema de regeneración en la propagación comercial de este cultivar.
En la literatura científica consultada se ha descrito para otros cultivares de bananos y plátanos la formación de Es en medio de cultivo líquido. Aunque existen diferencias en la densidad de inoculación que proporciona el mayor número de Es debido a la influencia del genotipo (Kosky et al., 2002; Cabrera et al., 2002). No obstante, estos autores apoyan el hecho que la densidad desempeña un papel importante en la formación de los Es a partir de suspensiones celulares embriogénicas. Sin embargo, estos estudios no describen el efecto de la densidad en la morfología, histología y desarrollo ontogénico de los Es.

Los resultados de Daniels et al. (2002) demostraron el efecto de la densidad inicial de inóculos en la formación y diferenciación de Es de FHIA-21 sobre medio de cultivo semisólido. Al igual que en este trabajo, estos autores observaron que los Es formados en las menores densidades eran de mayor tamaño con respecto a los formados en alta densidad.
Cabe destacar que la mayoría de los estudios histológicos en Musa sp. han sido con la finalidad de describir histológicamente los diferentes tipos de callos, haciendo énfasis sólo en aquellos embriogénicos (Escalant et al., 1994; Grapin et al., 1996; Grapin et al., 1998). Aunque, los resultados de Georget et al. (2000) constituyen un progreso en el estudio histológico de diferentes constituyentes de suspensiones celulares embriogénicas del cv. Grande Naine (Musa AAA) y de los Es regenerados de ellas, sobre medio de cultivo semisólido. Estos autores a pesar de no describir histológicamente las etapas de desarrollo de los Es, sus resultados coinciden con los obtenidos en este trabajo ya que a los 28 días de cultivo observaron la definición de la protodermis y un enriquecimiento de almidón vacuolar en las células cercanas a la base de los Es.
Al respecto, los principales estudios se han enmarcado en especies dicotiledóneas, en las cuales se pueden diferenciar con mayor facilidad las etapas ontogénicas de los embriones somáticos. Por ejemplo, Osuga y Komamine (1994) y Shigeta et al. (1996), en el cultivo de la zanahoria (Daucus carota L.) plantean que el cultivo en suspensión a baja densidad de inóculo desencadenó el proceso de histodiferenciación de los Es, con mayor número en etapa de torpedo y cotiledonal. Sin embargo, elevadas densidades de inóculo limitaron este proceso y posibilitaron la formación y multiplicación de gran número de Es en etapa globular. Resultados similares en el cultivo del café (Coffea arabica L.) fueron descritos por Barbón et al. (2003). Estos autores al inocular 5.0 gMF.l-1 observaron la formación de embriones somáticos en la etapa globular.
CONCLUSIONES
Los resultados de este trabajo demostraron el efecto regulatorio de la densidad de inoculación en la formación y desarrollo de morfológico de Es de FHIA-21. Los Es formados a baja densidad (0.5 y 1.0 gMF) presentaron menor formación de embriones secundarios lo cual trajo como consecuencia menor número de Es totales. Estos se caracterizaron por presentar mayor asincronía dado por la diversidad de tamaños. En estas densidades se presentaron los Es de mayor desarrollo ontogénico (etapa coleoptilar) evidenciado a través de las secciones histológicas. Sin embargo, los Es formados en alta densidad de inoculación (1.5 y 2.0 gMF) presentaron mayor formación de Es secundarios agrupados en masas. En estas densidades se produjo el mayor número de Es con mayor uniformidad de tamaño. Las secciones histológicas evidenciaron características de la etapa globular.
REFERENCIAS
Barbón, R, Jiménez E, Capote A (2003) Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv. Robusta. Biotecnología Vegetal 3(3): 131-135
Bieberach C (1995) Embriogénesis somática y regeneración de plantas en cultivares de Musa spp. Tesis presentada en opción al grado científico de Magister Scientiae. CATIE, Turrialba, Costa Rica. 86p
Cabrera, M, López J, Kosky RG, Montano N, Reyes M, Reinaldo D, Ventura JC, Medero V, Santos A, García M, Basail M, Espinosa E (2002) Multiplicación, histodiferenciación y regeneración de suspensiones celulares embriogénicas en plátanos vianda Navolean (AAB). Biotecnología vegetal 2(2): 115-117
Celestino, C, Hernández I, Carneros E, López-Vela D, Toribio M (2005) La embriogénesis somática como elemento central de la biotecnología Forestal. Invest Agrar: Sist Recur For, 14(3): 345-357
Côte, F, Domergue R, Monmarson S, Schwendiman J, Teisson C, Escalant JV (1996) Embryogenic cell suspensions from male flower of Musa AAA cv. Grande Naine. Physiol Plant 97:285-290
Daniels, D, Kosky RG, Vega M (2002) Plant regeneration system via somatic embryogenesis in the hibrid cultivar FHIA 21 (Musa spp. AAAB Gropl). In Vitro Cell. Dev. Biol 38:330-333
Ducos, JP, Lambot C, Pétiard V (2007) Bioreactors for Coffee mass propagation by somatic embryogenesis. International Journal of Plant Developmental Biology 1(1): 1-12
Escalant, JV, Teisson C, Cote F (1994) Amplified somatic embryogenesis from male flowers of triploid banana and plantain cultivars (Musa spp.). In vitro Cell Dev. Biol 30:181-186
García-Aguila, L, Pérez B, Sarría Z, Clavero J (2002) Alternativas para la propagación in vitro del cultivar híbrido FHIA-20. Infomusa 11(1):35-38
Georget, F, Cote F, Domergue R, Ferrière N (2000) Morphohistological study of different constituents of a banana (Musa AAA, cv. Grande naine) embryogenic cell suspension. Plant Cell Report 19: 748-754
Grapin, A, Schwendiman J, Teisson C (1996) Somatic embryogenesis in banana plant. In Vitro Cell Dev. Biol. 32:66-71
Grapin, A, Ortíz JL, Domergue R, Babeau J, Monmarson S, Escalant JV, Teisson C, Côte F (1998) Establishment of embryogenic callus and initiation and regeneration of embryogenic cell suspensions from female and male immature flower of Musa spp. INFOMUSA 7(1):13-15
Gupta PK, Timmis R (2005) Mass propagation of conifer trees in liquid cultures: Progress towards commercialization. En: Hvoslef-Eide AK, Preil W (Eds) Liquid Culture Systems for in vitro plant propagation, pp 231-242 Springer, Dordrecht
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Orellana, P, Alvarado P, Guijarro JM, Pérez J, Pérez L, Rowe P, Moreno E, Clavero J, Romero C, Hernández A (1999) Introducción y validación de híbridos tetraploides de Musa en Cuba. CORBANA 24(51):79-84
Osuga K, Komamine A (1994) Synchronization of somatic embryogenesis from carrot cells at high frequency as a basis for the mass production of embryos. Plant Cell, Tissue and Organ Culture 39:125-135
Kosky, RG, De Feria M, Pérez LP, Gilliard T, Martínez FB, Reyes M, Milian RC, Quiala E (2002) Somatic embryogenesis of the banana hybrid cultivar FHIA-18 (AAAB) in liquid medium and scaledup in a bioreactor. Plant Cell Tissue Organ Cult 68: 21-26
Schenk RU, Hildebrandt AC (1972) Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell culture. Canadian Journal of Botany 50:199-204
Shigeta, J, Sato K, Mii M (1996) Effects of initial cell density, pH and dissolved oxygen on bioreactor production of carrot somatic embryos. Plant Science 115:109-114
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
