Artículo Científico Biotecnología Vegetal Vol. 8, No. 2: 87 - 90, abril - junio, 2008
ISSN 1609-1841 (Versión impresa)
ISSN 2074-8647 (Versión electrónica)
Efecto de la adición de diferentes concentraciones de carbón activado sobre la multiplicación in vitro de ñame
Misterbino Borges García*, Yoandris Sosa Tabarez. *Autor para correspondencia.
Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma. Carretera Bayamo-Manzanillo km 17, Apdo 21, Bayamo. CP 85 100, Granma, Cuba. e-mail: borges@udg.co.cu
RESUMEN
La oxidación fenólica puede ocasionar serios problemas en el establecimiento, multiplicación y supervivencia de los explantes de la mayoría de las especies vegetales. El presente trabajo de investigación se desarrolló con el objetivo de evaluar el efecto de la adición de diferentes concentraciones de carbón activado en el medio de cultivo sobre la multiplicación in vitro de segmentos uninodales de ñame (Dioscorea alata L) clon Caraqueño. Se utilizó el medio de cultivo MS al 75% con vitaminas MS y sacarosa 30 g.l-1 y la adición de distintas concentraciones de carbón activado (0.5, 1.0, 1.5, 2.0 g.l-1). Se determinó a las 4, 5 y 6 semanas de cultivo el número de nudos de novo, el número de hojas y la longitud del vástago. Los resultados demostraron que la adición de carbón activado tuvo un efecto positivo sobre número de nudos, pero no afectó el número de hojas y longitud del vástago.
Palabras clave: cultivo in vitro, Dioscorea alata L, segmentos nodales
ABSTRACT
Phenolic oxidation can cause serious problems in the establishment, multiplication and survival of explants on most of plant species. The present investigation was developed toevaluate the effect of adding different concentrations of activated charcoal in the culture medium for the in vitro multiplication of uninodal segments of yam (Dioscorea alata L) caraqueño clone. Culture medium MS 75% with MS vitamins and sucrose 30 g.l-1 was used. Different concentrations of activated charcoal (0.5, 1.0, 1.5, 2.0 g.l-1) were also added to the culture medium. Number of novo nodes, leaves and length of shoots were determined after 4, 5 and 6 weeks of culture. Results demonstrated that the addition of activated coal had a positive effect to obtain higher number of nodes. Activated charcoal did not affect the number of leaves and length of shoot.
Key words: Dioscorea alata L., nodal cuttings, plant tissue culture
INTRODUCCIÓN
El ñame es oriundo de las regiones del sudeste asiático, donde se conoce la mayor diversidad de especies. De allí se extendió hacia las zonas tropicales de África y América donde constituye un importante renglón en la alimentación de los países de esta región. Su cultivo se realiza a gran escala por muchos pueblos de África Tropical, el Pacífico y las zonas del Caribe, debido a su abundante producción, alto valor nutritivo, alto contenido de almidón, aceptable contenido de vitaminas y su resistencia a la sequía, entre otros. Dioscorea alata es una de las especies más cultivadas de los trópicos por sus tubérculos comestibles (Malaurie y Trouslot, 1995).
El ñame se utiliza en la industria y la farmacología, tiene un alto valor nutritivo y sabor exquisito. Constituye un magnífico alimento, lo mismo que la papa, a la cual puede sustituir sin inconveniente alguno (González, 1999).
A diferencia de las técnicas tradicionales de cultivo, el cultivo in vitro de tejidos vegetales es una poderosa herramienta que permite la propagación de grandes volúmenes de plantas en menor tiempo; así como su manejo en espacios reducidos. Por otro lado, la técnica es de gran utilidad en la obtención de plantas libres de patógenos; plantas homocigóticas, en la producción de plantas en peligro de extinción, en estudios de ingeniería genética, etc.
Uno de los problemas más comunes en el cultivo in vitro de tejidos vegetales es la emisión de sustancias fenólicas al medio de cultivo, la cual provoca afectaciones en el desarrollo del explante (Silva et al., 1996). Una de las prácticas más comunes para contrarrestar el efecto de la oxidación fenólica, es agregar antioxidantes al medio de cultivo los que son inhibidores de la polifenoloxidasa o adsorbentes. Entre los más empleados se pueden citar los ácidos ascórbico, cítrico, málico y el carbón activado.
El cultivo in vitro del ñame, presenta la fenolización como un inconveniente importante durante la fase de multiplicación in vitro del material vegetal.
Tomando en consideración lo antes expuesto esta investigación tuvo como objetivo evaluar la influencia de la adición de carbón activado en el medio de cultivo sobre la multiplicación in vitro de segmentos uninodales de ñame (Dioscorea alata L) clon Caraqueño.
MATERIALES Y MÉTODOS
Se utilizó la especie Dioscorea alata L. clon Caraqueño. Los fragmentos de tubérculos sanos de 100 a 120 g fueron sembrados en condiciones semicontroladas dando lugar a plantas completas de las cuales se establecieron in vitro, a partir de dos meses de cultivo, segmentos nodales de 12 a 15 mm de longitud según la metodología descrita por De la Cruz et al. (1998). Para los experimentos se emplearon segmentos uninodales (12 a 15 mm) obtenidos de plantas cultivadas in vitro durante 5 semanas antes del segundo subcultivo.
El medio de cultivo utilizado estuvo compuesto por las sales MS al 75% (Murashige y Skoog, 1962), vitaminas MS, sacarosa 30 g.l-1 y diferentes concentraciones de carbón activado (0.5, 1.0, 1.5, 2.0 g.l-1). Este se distribuyó en frascos biotecnológicos (6 cm de ancho x 9 cm de altura con un diámetro de 5.7 cm) que contenían 20 ml de medio de cultivo. En cada frasco se colocaron cuatro segmentos uninodales.
La temperatura de incubación fue de 25 ± 1°C, humedad relativa del 70% e iluminación solar (fotoperíodo de aproximadamente 13 horas).
A las 4, 5 y 6 semanas se tomaron aleatoriamentes 40 explantes por cada tratamiento a los cuales se les determinaron las siguientes variables:
Longitud del vástago (mediante medición con una regla graduada, cm).
Número de nudos de novo por explante.
Número de hojas por explantes (hojas extendidas totalmente)
El tiempo de transferencia se determinó cuando el número de nudos de novo fue igual o superior a 2.5, que es el informado previamente para la multiplicación in vitro del ñame (Borges et al., 2004).
Diseño y análisis estadístico
Se aplicó un diseño experimental completamente aleatorizado con análisis de varianza de clasificación simple y prueba de comparación de medias de Tukey. El paquete estadístico utilizado fue el STATISTICA montado sobre plataforma WINDOWS XP Profesional versión 6.1 (StatSoft, 2003).
RESULTADOS Y DISCUSIÓN
Número de nudos de novo
El efecto de la utilización de distintas concentraciones de carbón activado en el medio de cultivo de multiplicación in vitro de ñame sobre el número de nudos de novo a las 4, 5 y 6 semanas se muestra en la tabla 1.
Los mejores resultados de la adición de diferentes concentraciones de carbón activado en el medio MS al 75% sobre el número de nudos de novo al cabo de 6 semanas, correspondieron a los tratamientos 1 y 2, los cuales no difierieron significativamente entre ellos pero sí con los demás tratamientos.
Estos resultados no coinciden con los logrados por Borges et al. (1999) durante el estudio del efecto de la adición de diferentes antioxidantes (cisteína 20 mg.l-1, ácido cítrico, ácido ascórbico y polivinilpirrolidona 100 mg.l-1) en el medio de cultivo para la micropropagación de ñame (Dioscorea alata L) sobre el número de nudos, donde mostraron la ausencia de diferencias significativas entre los distintos tratamientos evaluados.

Los valores del número de nudos de novo durante el transcurso del tiempo demuestran una tendencia a la disminución a medida que aumenta la incorporación de carbón activado en el medio de cultivo la que se hace significativa a partir de 2 g.l-1 de esta sustancia. Ello puede ser debido a que interfiere en la absorción de nutrientes esenciales para la formación de yemas en el cultivo in vitro de ñame clon Caraqueño, tales como el nitrógeno (presente en las sales macronutrientes o en las vitaminas) y hormonas endógenas. En este aspecto, Pan y van Staden (1998) señalan que el carbón activado puede ser usado como promotor o inhibidor de crecimiento in vitro, en función de la especie y del tipo de explante, establece condiciones de oscuridad, adsorbe inhibidores, reguladores de crecimiento o libera sustancias promotoras de crecimiento presentes en el medio o adsorbidas.
También es importante señalar que el índice de multiplicación adecuado para la transferencia del material vegetal del ñame, debe ser igual o superior a 2.5, el cual se alcanzó a las seis semanas de cultivo en los tratamientos 1, 2 y 3 (medio de cultivo MS al 75% con la adición de carbón activado a razón de 0.5, 1 y 1.5 g.l-1 respectivamente). Estos resultados no concuerdan con los referidos por De la Cruz et al. (1998) y Fernández (2005) en la micropropagación de germoplasma de ñame en un medio de cultivo con 20 mg.l-1 de cisteína como agente antioxidante donde lograron coeficientes de multiplicación iguales o superiores a 2.5 a las cuatro semanas de establecidos. Tampoco coinciden con los obtenidos por Borges et al. (2004) en la multiplicación in vitro de ñame clon Caraqueño en un medio de cultivo con 20 mg.l-1 de cisteína donde obtuvieron valores para el número de nudos superiores a 2.5 a las cinco semanas de cultivo de las plantas in vitro a partir de segmentos uninodales. Esto indica además, que la presencia de carbón activado en el medio de cultivo de multiplicación de ñame clon Caraqueño retarda el tiempo de transferencia del material vegetal hasta seis semanas debido principalmente al poder de absorción del carbón activado no solo de sustancias fenólicas tóxicas liberadas por el material vegetal al medio de cultivo, sino también posiblemente por la absorción de determinados nutrientes.
Número de hojas
Se puede apreciar que los resultados alcanzados no difierieron significativamente (p<0.05), para los tratamientos estudiados. Las distintas concentraciones de carbón activado adicionadas al medio de cultivo no tuvieron un efecto significativo diferencial en el número de hojas formadas en las plantas in vitro de ñame clon Caraqueño (Tabla 2).
Estos resultados coinciden a las cuatro semanas de cultivo con los alcanzados por St-Luce (2005) al comparar el medio de cultivo D-571 con el medio de cultivo MS al 100% de sus sales en la micropropagación del ñame clon Caraqueño, donde se demostró la ausencia de un efecto significativo para el número de hojas a las cuatro semanas de cultivo. No obstante, sí obtuvieron diferencias significativas a las cinco y seis semanas de cultivo.

Sin embargo, estos resultados no coinciden para estos mismos tiempos de cultivo con los logrados por Fernández (2005) al evaluar el efecto de la utilización de distintas formulaciones de vitaminas en el medio de cultivo de multiplicación in vitro del ñame (Dioscorea alata L.) clon Caraqueño sobre el número de hojas donde mostró diferencias significativas para esta variable entre los distintos tratamientos ensayados.
También se pudo notar que a medida que transcurría el tiempo a cuatro, cinco y seis semanas aumentaba la formación de nuevas hojas. Según Borges et al. (2003) esto es debido a que durante la propagación in vitro del ñame se presenta un crecimiento y desarrollo vegetativo continuo de las hojas expresado en la formación de nuevas hojas y yemas, producto a una importante actividad de crecimiento y diferenciación desplegada por los tejidos meristemáticos de las plantas in vitro en relación con el contenido nutritivo del medio de cultivo.
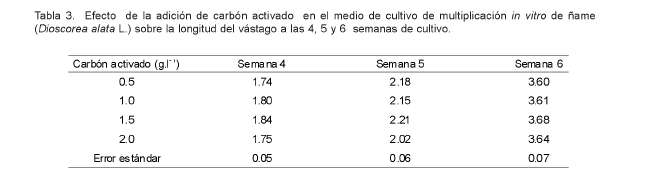
Longitud del vástago
En esta investigación la adición de las distintas concentraciones de carbón activado en el medio de cultivo MS al 75% no tuvo un efecto significativo en la longitud del vástago (Tabla 3). Se puede notar que no existieron diferencias significativas para esta variable entre los distintos tratamientos evaluados al igual que para el número de hojas. Estos resultados coinciden con los logrados por Borges et al. (1999) durante el estudio del efecto de la adición de diferentes antioxidantes en el medio de cultivo para la micropropagación de ñame (Dioscorea alata L) sobre la longitud del vástago, donde demostraron la ausencia de diferencias significativas entre los distintos tratamientos evaluados.
REFERENCIAS
Borges M, Aguilera N, Saborít G y Vázquez J (1999) Influencia de distintos antioxidantes en la micropropagación del ñame (Dioscorea alata L.). Centro Agrícola 26 (2): 69 71
Borges M, Meneses S, Vazquez J, García M (2003) Conservación in vitro de germoplasma de Dioscorea alata L. por crecimiento mínimo. Plant Genetic Resources Newsletter 133: 8-12
Borges M, Ceiro W, Meneses S, Aguilera N (2004) Regeneration and multiplication of Dioscorea alata L germplasm maintained in vitro. Plant Cell, Tissue and Organ Culture 76: 87-90
De la Cruz G, Borges M, Aguilera N, Saborit G, Labrada M (1998) Multiplicación acelerada del ñame (Dioscorea alata L.) en condiciones in vitro. Resúmenes. III Encuentro Latinoamericano de Biotecnología Vegetal, La Habana, Cuba, p.8
Fernández, D (2005) Efecto de distintas formulaciones de vitaminas en la multiplicación in vitro del ñame (D. alata L.) Trabajo de Diploma. Universidad de Granma. 64 pp.
González, O (1999) Estudio del género Dioscorea en condiciones tradicionales y de cultivo in vitro. Centro Agrícola 26 (2): 93-94
Malaurie B, Trouslot MF (1995) Les ignames. In Biotechnologies végétales Bv9d. Cned-Aupelf_ Uref, chapitre 10 : 49-60
Murashige, T, Skoog F (1962) A revised medium for rapid growth and biossays with tobacco tissue culture. Physiol. Plant 15: 473-497
Pan, MJ, Van Staden J (1998) The use of charcoal in in vitro culture A review. Plant Growth Regulation 26:155-163
Silva J, Acostar L, Revuelta D y Mon-tes S (1996) Evaluación de antioxidantes en la embriogénesis somática de cacao (Theobroma cacao L.), IV Coloquio Internacional de Biotecnología de las Plantas, Resúmenes, UCLV, Santa Clara, p. 55
StatSoft. (2003) Statistica for Windows. Release 6.1 Tulsa, UK
St.Luce H (2005) Efecto de diferentes medios de cultivo en la multiplicación in vitro del ñame (Dioscorea alata L). Trabajo de diploma. Universidad de Granma. 53 pp.
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
