Artículo Científico Biotecnología Vegetal Vol. 7, No. 3: 131 - 138 , julio-septiembre, 2007
ISSN 1609-1841 (Versión impresa) ISSN 2074-8647 (Versión electrónica)
Embriogénesis somática en Carica papaya L. var. Maradol rojo
Laisyn Posada-Pérez*, Rafael G. Kosky, Maritza Reyes *Autor para correspondencia.
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5 Santa Clara, Villa Clara, Cuba. CP 54 830 e-mail: laisyn@ibp.co.cu
RESUMEN
La variedad más importante de papaya en Cuba es la Maradol rojo. Sin embargo, es susceptible a las principales enfermedades virales que atacan al cultivo. Por esta razón se requiere establecer un método de regeneración de plantas vía embriogénesis somática que sirva de base al desarrollo de un protocolo de transformación genética para obtener plantas resistentes. El objetivo de este trabajo fue obtener embriones somáticos de papaya Maradol Rojo a partir de embriones cigóticos. Para ello, se evaluó el efecto de diferentes factores en la embriogénesis somática y la regeneración de plantas a partir de embriones cigóticos inmaduros. Los embriones somáticos se obtuvieron en un medio de cultivo MS con 5 mg.l-1 de 2,4-D. Además, el empleo de 2 mg.l-1 de este regulador del crecimiento tuvo un efecto positivo en la multiplicación secundaria de los embriones somáticos. La adición de 5 mg.l-1 de AIB promovió el enraizamiento de los brotes en un 78.0%, pero su longitud fue inferior a 1.85 cm. El cultivo de los brotes en medio líquido de elongación permitió que estos alcanzaran una longitud promedio de 3.05 cm y 4.50 hojas, lo cual propició su adecuada supervivencia en la fase de aclimatización.
Palabras clave: aclimatización, embriones cigóticos, papaya, multiplicación secundaria
ABSTRACT
The most important papaya variety in Cuba is Red Maradol. However, it is susceptible to the main viral diseases that attack this crop. For this reason, it is necessary to establish a method for plant regeneration via somatic embryogenesis as the base to develop a protocol for genetic transformation to obtain resistant plants. The objective of this work was to obtain somatic embryos of papaya Red Maradol starting from zygotic embryos. The effect of different factors in somatic embryogenesis and plant regeneration, starting from immature zygotic embryos, was evaluated. The somatic embryos were obtained in a culture medium MS with 5 mg.l-1 2,4-D. Also, the use of 2 mg.l-1 of this plant growth regulator had a positive effect in the secondary multiplication of somatic embryos. The addition of 5 mg.l-1 AIB favored the buds rooting (78.0%), but its longitude was inferior to 1.85 cm. The culture of buds in liquid elongation medium allowed them to reach an average longitude of 3.05 cm and 4.50 leaves, which permitted its appropriate survival in the acclimatization phase.
Key words: acclimatization, papaya, secondary multiplication, zygotic embryos
INTRODUCCIÓN
La papaya (Carica papaya L.) es originaria de América Central y se caracteriza por ser un cultivo que en corto tiempo y de forma continua durante todo un año es productivo desde el punto de vista económico. En el mundo, en el 2006 la producción ascendió a 7 789 551 toneladas (FAO, 2006).
Las técnicas de cultivo de tejidos como la micropropagación (Fitch et al., 2005) y la embriogénesis somática (Banerjee, 2002) se han puesto a punto para la propagación in vitro de esta especie.
En este sentido, la embriogénesis somática directa ha sido la vía más utilizada tanto para la propagación, como para el mejoramiento genético mediante la transformación genética (Cabrera-Ponce et al., 1995; Mahon et al., 1996; Castillo et al., 1998; Cai et al., 1999; Del Sol et al., 2001; Banerjee, 2002; Dhekney, 2004).
El explante más utilizado en este cultivo para lograr la embriogénesis somática, con independencia de la variedad, es el embrión cigótico (Cabrera-Ponce et al., 1995; Mahon et al., 1996; Cai et al., 1999; Del Sol et al., 2001). No obstante, también se han utilizado discos de hojas (CabreraPonce et al., 1996; Arrieta-Espinoza, 1996), segmentos de hipocotilo (Castillo et al., 1998; Zhu et al., 2004), raíces (Yu et al., 2001), así como ápices y segmentos de plantas in vitro (Gallardo et al., 2004).
La variedad más importante de papaya en Cuba sigue siendo la Maradol rojo, con un área total cultivada de 4 377 ha, y una producción de 51 659 toneladas cada año con un rendimiento de 17 t.ha-1. Sin embargo, es susceptible a las principales enfermedades virales que atacan al cultivo. Por esta razón, se requiere establecer un método de regeneración vía embriogénesis somática que sirva de base al desarrollo de un protocolo de transformación genética para obtener plantas resistentes.
El objetivo de este trabajo fue obtener embriones somáticos de papaya Maradol Roja a partir de embriones cigóticos.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon frutos inmaduros (obtenidos de flores hermafroditas elongata) de plantas de papaya var. Maradol Rojo que fueron colectados entre 90-120 días después de la antesis. Para su desinfección se siguió el método de Fitch y Manshardt (1990) que se describe brevemente. Después de seleccionados en campo, los frutos fueron lavados con detergente y posteriormente se sumergieron durante 30 minutos en una solución de hipoclorito de sodio al 1% con dos o tres gotas de Tween 20 por litro de solución. Finalmente, se lavaron dos veces con agua destilada estéril. A continuación fueron secados en la cabina de flujo laminar y se procedió a abrirlos con ayuda de una cuchilla de monte, se separaron las semillas y se cortaron después, para extraer los embriones cigóticos inmaduros.
Obtención de embriones somáticos
Efecto del 2,4-D
Con el objetivo de evaluar el efecto del ácido 2,4-diclorofenoxiacético (2,4-D) sobre la formación de embriones somáticos de papaya a partir de embriones cigóticos inmaduros se realizó este primer experimento.
Los embriones cigóticos extraídos fueron colocados en cuatro tratamientos (40 embriones cigóticos por tratamiento) con diferentes concentraciones de 2,4-D (3, 5, 10, 15 mg.l-1) e igual medio de cultivo basal, compuesto por las sales propuestas por Murashige y Skoog (1962) (MS) a la mitad de su concentración, vitaminas MS, mio-inositol 100 mg.l-1, L-glutamina 400 mg.l-1, sacarosa 60 g.l-1 y 5g.l-1 de agargel. El pH se ajustó a 5.8 antes de la esterilización.
Se colocaron cuatro embriones cigóticos por frasco de cultivo con capacidad de 250 ml y 30 ml de medio de cultivo. Estos se situaron a la oscuridad y 27 ± 2 °C durante 6 semanas. Después de este periodo de tiempo, se evaluó el número de embriones cigóticos que formaron embriones somáticos y el número de embriones somáticos totales formados por embrión cigótico.
Efecto de ANA y 6-BAP
Se determinó el efecto de diferentes concentraciones de ácido naftalen-acético (ANA) y 6-bencilaminopurina (6-BAP) sobre la formación de embriones somáticos. Las concentraciones fueron seleccionadas tomando como base resultados de la literatura científica consultada.
El medio de cultivo basal fue el anteriormente descrito, con ANA en concentraciones de 0.1, 0.2 y 0.4 mg.l-1 en combinación con 6-BAP a 0.2, 0.4 y 0.8 mg.l-1, además de la adición o no de 1 g.l-1 de carbón activado.
Fueron empleados 40 embriones cigóticos por tratamiento. Las condiciones de incubación de los frascos de cultivo y las evaluaciones fueron realizadas iguales al anterior experimento.
Multiplicación de embriones somáticos
Para lograr la multiplicación secundaria de los embriones somáticos formados se evaluó el efecto del 2,4-D y el ácido abscísico (ABA). Se definieron varios tratamientos con dos concentraciones de 2,4-D (2 y 5 mg.l-1), así como dos de ABA (0.2 y 0.5 mg.l-1) tomando como base lo informado por Chen et al. (1991) en el cultivo de la papaya. El medio de cultivo basal fue igual al acápite anterior.
Se emplearon 20 frascos como réplica por tratamiento y se situaron cinco grupos de embriones en cada uno. Estos fueron colocados en oscuridad y 27 ± 2 ºC. Las evaluaciones fueron realizadas a las 6 semanas mediante una escala visual de 3 grados, donde: el grado 1 correspondió a poco crecimiento; el 2 a crecimiento medio y el 3 abundante crecimiento.
Germinación de embriones somáticos
El objetivo de este experimento fue determinar el efecto de dos tipos de citoquininas en la germinación de los embriones somáticos de papaya.
Pequeños grupos de embriones somáticos formados por cuatro a seis embriones, ya que es imposible separarlos de forma individual debido a su pequeño tamaño, fueron subcultivados en un medio de cultivo compuesto por la mitad de la concentración de las sales MS, mio-inositol 100 mg.l-1, vitaminas MS, sacarosa 20 g.l-1; agargel 5 g.l-1, pH 5.8 antes de la esterilización, al que se añadieron diferentes concentraciones de kinetina (1, 2, 3, 4 y 5 mg.l-1) y 6-BAP (0.22 y 0.5 mg.l-1 ).
Los frascos de cultivo con capacidad de 250 ml y con 30 ml de medio de cultivo de los distintos tratamientos, fueron colocados en cámara de luz solar expuestos a una intensidad luminosa de 50-62.5 μ mol.m-1.s-1, 25±2 ºC y humedad relativa de 60±10%. Se emplearon 20 frascos como repetición por tratamiento. A las cuatro semanas se evaluó el número de embriones somáticos que germinaron en los diferentes tratamientos, así como el número de plantas obtenidas a los 30 días de cultivo.
Crecimiento de las plántulas in vitro
Tomando como base los resultados del experimento anterior fue necesario determinar el efecto del medio de cultivo recomendado por Fitch (1993) compuesto por las sales MS al 100%, tiamina 1 mg.l-1, mio-inositol 100 mg.l-1, 6-BAP 0.22 mg.l-1, kinetina 0.11 mg.l-1, sacarosa 30 g.l-1, en estado líquido estático y pH 5.8 previo a la esterilización. Este se comparó con la mejor variante del medio de cultivo para la germinación previamente obtenido en estado semisólido.
Fueron empleados 40 frascos por tratamiento con cinco plantas cada uno, las cuales provenían de un segundo subcultivo en el medio de cultivo para germinación. Los frascos de cultivo fueron colocados en las mismas condiciones de cultivo anteriormente señaladas. Se evaluó la longitud (cm) alcanzada por los brotes a los 30 días de cultivo, con auxilio de una regla graduada.
Inducción del enraizamiento
A partir de resultados de experimentos preliminares se comprobó que la mayoría de los embriones presentaban germinación parcial, con desarrollo solo de la parte aérea. Por esa razón, se diseñó un experimento para inducir el enraizamiento con ácido indolbutírico (AIB).
Se empleó un medio de cultivo base compuesto por las sales MS al 50%, tiamina 0.4 mg.l-1, sacarosa 40 g.l-1 y diferentes concentraciones de AIB (2, 3, 5, 6 y 4 mg.l-1control; medio de cultivo propuesto por Ortega, 1992).
El medio de cultivo fue solidificado con agar 7 g.l-1. Se colocaron cinco brotes por frasco, a los cuales previamente se les eliminó el callo basal. Se emplearon 20 frascos de cultivo como repetición por tratamiento. A los 30 días fue determinado el número de brotes con raíces (%), así como la longitud alcanzada por estos (cm).
Una vez obtenidas las plántulas con tres o más hojas y 2-3 cm de altura (provenientes del medio de cultivo de multiplicación), cada una fue lavada en su base para eliminar restos de agar y posteriormente fueron colocadas en bandejas con 10 mg.l-1 de ácido indol-acético (AIA) y 8 mg.l-1 de ácido indolbutírico (AIB) durante 24 horas. Para la aclimatización se emplearon bandejas de polieturano de 70 alveolos con 121 cm3 de volumen cada uno. Como sustrato se empleó una mezcla de compost de cachaza más arena, en una proporción de 4:1. La humedad relativa se mantuvo alta mediante riego por microaspersión dos veces al día. Semanalmente las plantas se fertilizaron mediante aplicación foliar de una solución de urea 10 g.l-1.
Análisis estadísticos de los datos
Los análisis estadísticos se realizaron con el uso del utilitario SPSS versión 11.5 Todos los datos fueron analizados estadísticamente mediante pruebas no paramétrica de Kruskall Wallis y Mann Whitney según correspondió para un nivel de significación de 5%.
RESULTADOS Y DISCUSIÓN
Obtención de embriones somáticos
Efecto del 2,4-D
Al utilizar como explante inicial embriones cigóticos inmaduros fue posible lograr desde el domo apical la formación de embriones somáticos en la variedad objeto de estudio.
En todos los tratamientos independientemente de la concentración de 2,4-D se formaron embriones somáticos, sin embargo, existieron diferencias significativas en cuanto a la frecuencia y el número de embriones formados en cada tratamiento (Tabla 1).
Se obtuvo una embriogénesis somática directa de alta frecuencia, sin la formación previa de callos en las menores concentraciones de 2,4-D. Atendiendo a los resultados se seleccionó la concentración de 5 mg.l-1 para la formación de embriones somáticos a partir de los embriones cigóticos inmaduros para la variedad Maradol rojo. En los embriones cigóticos que fueron cultivados en medio de cultivo con 15 mg.l-1 de 2,4-D se observó la formación de callos, estos tomaron una coloración pardo claro y a las 6 semanas se observó la presencia de los embriones somáticos.
Los resultados expuestos en la tabla 1 fueron similares a los obtenidos por otros autores (Fitch y Manshardt, 1990; Vegas et al., 1992; Dhekney, 2004), pero en otras variedades de papaya. En todos estos trabajos se destaca el papel del 2,4-D en la embriogénesis somática de esta especie. No obstante, Fitch y Manshardt (1990) alcanzaron los mejores resultados con una concentración de 10 y 15 mg.l-1 en cuatro variedades de papaya en Hawai.
Del Sol et al. (2001) emplearon 2,4-D para obtener embriones somáticos en papaya variedad INIVIT 2000 a partir de embriones cigóticos y obtuvieron los mejores resultados con concentraciones de 4.7 mg.l-1. Por su parte, Banerjee (2002) para obtener embriones somáticos de papaya utilizó concentraciones de 2,4-D desde 2 hasta 25 mg.l-1 e informa que a partir de 15 mg.l-1 existió una disminución significativa en cuanto al número de embriones y el porcentaje de explantes con embriones somáticos.
Otros autores como Vegas et al. (1992) han destacado la superioridad (100 veces mayor) de utilizar embriones cigóticos sobre los pecíolos de hojas, en cuanto a la frecuencia de aparición de embriones somáticos en este cultivo.
Los resultados de este trabajo apoyan lo informado por Ammirato (1983), el cual señala que embriones cigóticos inmaduros de varias especies de plantas pueden ser inducidos a la embriogénesis somática. Por otra parte, este mismo autor puntualiza que el 2,4-D tiene un papel significativo en la formación de embriones somáticos a partir de embriones cigóticos inmaduros en la papaya.
Efecto de ANA y 6-BAP
Al añadir al medio de cultivo las combinaciones de ANA y 6-BAP para inducir la embriogénesis somática a partir de embriones cigóticos los resultados alcanzados fueron muy bajos. Solamente se obtuvo respuesta en la combinación 0.2 mg.l-1 de ANA y 0.4 mg.l-1 de 6-BAP con una frecuencia de solo 12.5% de aparición de embriones somáticos a partir de los embriones cigóticos inmaduros. Estos resultados no coincidieron con lo referenciado por Chen et al. (1987), los cuales emplearon como explantes cotiledones, hojas, raíces y brotes y fue en éstos últimos donde tuvieron éxito. Tampoco con Chen et al. (1991) quienes utilizaron como explantes iniciales embriones cigóticos, pero de un híbrido interespecífico de papaya, el cual parece tener una mejor respuesta al cultivo in vitro.
Multiplicación de embriones somáticos
El mejor medio de cultivo para la multiplicación de los embriones somáticos fue el que tenía una concentración de 2,4-D de 2 mg.l-1 con diferencias significativas con el resto de los tratamientos (Tabla 2). En este se llegaron a formar grupos entre 200 a 400 embriones somáticos. Similares resultados señalan Fitch y Manshardt (1990) y Vegas et al. (1992) en papaya, los cuales multiplican los embriones en sucesivos subcultivos en medio de cultivo con 2,4-D. Estos resultados difieren con lo planteado por Chen et al. (1991) los cuales emplearon solamente ABA para la multiplicación de los embriones somáticos. En el presente trabajo éstos fueron los tratamientos que más baja tasa de multiplicación presentaron.


Germinación de embriones somáticos
Los embriones somáticos al ser colocados en los medios de cultivo con diferentes concentraciones y tipos de citoquininas para su germinación, avanzaron en las distintas fases de la histodisferenciación de la embriogénesis somática y posteriormente se elongaron.
En todos los tratamientos donde se utilizó kinetina en el medio de cultivo se obtuvo respuesta en el porcentaje de germinación. El mejor resultado se alcanzó con la concentración de 4 mg.l-1 con diferencias significativas con el resto de los tratamientos (Figura 1).
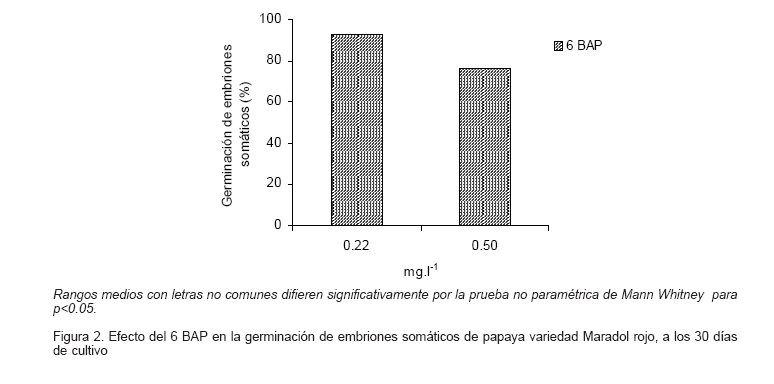
Respecto al uso del 6-BAP en el medio de cultivo el mayor porcentaje de germinación, se obtuvo al utilizar una concentraciones de 0.22 mg.l-1, el cual fue superior significativamente a la mayor concentración evaluada de esta citoquinina (Figura 2). Con la adición al medio de cultivo de 6-BAP se alcanzaron los mayores porcentajes de germinación (92.63%) en comparación con los tratamientos con kinetina.
Estos resultados difieren a lo señalado por Fitch y Manshardt (1990), los cuales emplearon para la germinación de los embriones somáticos 5 mg.l-1 de kinetina.
Respecto al número final de plantas obtenidas es de destacar que en el medio de cultivo con 0.22 mg.l-1 de 6-BAP fue donde mayor número de plantas se obtuvieron con valor superior a todos los tratamientos con kinetina y la concentración de 0.50 mg.l-1 de 6-BAP (Tablas 3 y 4).



En la literatura científica se señala el papel fundamental de las citoquininas para la germinación de embriones somáticos (Linz y Jarret, 1991; De García y Martínez, 1992). Estos resultados difieren con lo planteado por Fitch y Manshardt (1990) y Chen et al. (1991), los cuales emplearon un medio de cultivo sin reguladores del crecimiento para la obtención de plantas a partir de los embriones somáticos. Sin embargo, estos autores refieren solamente entre un 20-35% de germinación.
En el presente trabajo se lograron los mejores resultados con el uso de 6-BAP. Se observó un aumento en el vigor de los embriones somáticos, los cotiledones tomaron un color verde oscuro, con elongación del brote. Sin embargo, el desarrollo de la radícula fue pobre y en algunos casos nulo, debido a la formación de un callo en la base de los brotes. Similares resultados refieren Fitch y Manshardt (1990) y Chen et al. (1990) los cuales lograron el enraizamiento ex vitro.
Inducción de enraizamiento
La inducción del enraizamiento con 5 mg.l-1 de AIB resultó significativamente superior al resto de los tratamientos y al control (Tabla 5). Se alcanzó un 78.0 % de enraizamiento in vitro, las raíces formadas tenían una apariencia normal, así como los brotes tuvieron una media de 3.35 hojas por cada uno. Varios autores señalan el papel del AIB en el enraizamiento de esta especie (Ortega, 1992; Fitch, 1993). Sin embargo, la longitud alcanzada por los brotes en todos los tratamientos fue inferior a 2 cm, lo cual conllevó a buscar un medio de cultivo el cual estimulara un mayor crecimiento o elongación antes de pasar al medio de cultivo de enraizamiento.
Crecimiento de los brotes in vitro
Los brotes colocados en el medio de cultivo líquido alcanzaron una longitud media de 3 cm y 4-5 hojas trilobuladas; longitud adecuada para ser posteriormente subcultivados a medio de cultivo para el enraizamiento. En ambas variables los resultados fueron significativamente superiores a los de los brotes que crecieron en el medio de cultivo de germinación semisólido (Tabla 6). Estos resultados parecen estar dados por el estado físico del medio de cultivo más que por su composición. Autores con Reuveni et al. (1990) señalan el efecto del medio de cultivo líquido en la estimulación de la elongación de brotes de papaya.
Los resultados concuerdan con los señalados por Millar y Drew (1990); Reuveni et al. (1990) y Fitch (1993), quienes lograron con el empleo de este medio de cultivo de elongación de las plantas, con una altura entre 2-3 cm. Dichos autores destacan la importancia del vigor de los brotes para lograr que éstos formen raíces y que la supervivencia en la fase de aclimatización sea mayor. Señalan, además, que con un crecimiento vigoroso los brotes son capaces de desarrollar raíces en 1 a 2 semanas, mientras que los brotes con pocas hojas o que presentan una detención de su crecimiento no enraizaron fácilmente. Por otra parte, brotes que no enraizaron después de 4 semanas fueron transferidos al medio de cultivo de elongación, donde activaron su crecimiento y después enraizaron normalmente.


En la aclimatización de las plantas obtenidas de embriones se logró un 65.3% de supervivencia.
En la papaya resulta fundamental y merece mayor atención mantener una alta humedad relativa (cámara húmeda) durante los primeros 15 días en fase de aclimatización para lograr tener éxito en condiciones ambientales. Similares resultados obtuvieron Drew (1988), Rajeevan y Pandey (1983), Tovar (1989) citado por Ortega (1992), Chen et al. (1991) y Ortega (1992). En el caso de Chen et al. (1991) lograron un 72% de supervivencia de las plántulas obtenidas de embriones somáticos, utilizando para mantener una alta humedad relativa, un vaso de cultivo invertido sobre cada una de ellas.
Las plantas respondieron bien a la aplicación de fertilización con urea de forma foliar, tomando una apariencia vigorosa y mostrando hojas de un color verde intenso. A los 60 días de crecimiento en las bandejas de polieturano alcanzaron una altura de 10-12 cm y emitieron de 6-8 hojas, aptas para ser trasplantadas al campo.
CONCLUSIONES
Fue posible formar embriones somáticos de papaya variedad Maradol rojo a partir de embriones cigóticos inmaduros y regenerar plantas.
REFERENCIAS
Ammirato, PV (1983) Embryogenesis. En: Evans DA, Sharp WR, Ammirato PV, Yamada Y (eds) Handbook of plant cell
culture, vol. 1. Techniques for propagation and breeding, pp. 82-123.Macmillan, New York
Arrieta-Espinosa, G (1996) Embriogénesis somática in vitro a partir de láminas foliares de papaya (Carica papaya L.) provenientes de la multiplicación clonal con yemas axilares de plantas adultas y de plántulas germinadas in vitro. Tesis. Mag. Sc. Universidad de Costa Rica. Costa Rica.
Bhattacharya, J B (2002) Tissue culture and transformation studies in Indian cultivars of papaya (Carica papaya L.) Tesis de Doctorado, 325 pp. Universidad de Pune. India
Cai, W, Gonsalves C, Tennant P, Fermin G, Souza M, Sarindu N, Jan FJ, Zhu HY, Gonsalves D (1999) A protocol for efficient transformation and regeneration of Carica papaya L. In vitro Cell. Dev. Biol-Plant 35: 61-69
Cabrera-Ponce, J, Vegas A, Herrera L (1995) Herbicide resistant transgenic papaya plants produced by an efficient particle bombardment transformation method. Plan Cell Report 15: 1-7
Cabrera-Ponce J L, Vegas-García A, Herrera-Estrella L (1996) Regeneration of transgenic papaya plants via somatic embryogenesis induced by Agrobacterium rhizogenes. In vitro Cell. Dev. Biol-Plant 32: 86-90
Castillo, B, Smith M A L, Yadava U L (1998) Liquid system scale up of Carica papaya L. somatic embryogenesis. Journal of Horticultural Science and Biotechnology 73 (3):307-311
Castillo, B, Smith M A L, Yadava U L (1998) Plant regeneration from encapsulated somatic embryos of Carica papaya L. Plant Cell Reports 17: 172-176
Castillo, B, Smith M, Madhavi D, Yadava U (1998) Estimation of the proteolitic enzyme activity of Carica papaya L. somatic embryos in liquid system. Inter. J. Agric 15 (1-4): 45-51
Del Sol, L, García M, Gálvez D, Rodríguez S, Torres Y, Medero V, López J, Ventura J, Cabrera M, Rodríguez S, Álvarez M, Bauta M, García J (2001) Efficient plant regeneration from
somatic embryognesis in papaya cv. INIVIT-2000. Biotecnología Vegetal y Agricultura Sostenible. Resúmenes evento, 133 215. INIVIT.
Dhekney S (2004) Molecular investigations, cryopreservation and genetic transformation studies in papaya (Carica papaya L.) for cold hardiness. Tesis de Doctorado. 254 pp. University of Florida.
Drew, RA (1988) Rapid clonal propagation of papaya in vitro from mature field-grown trees. HortScience 23: 609-611
FAO (2005) El cultivo de la papaya (Carica papaya) [en línea] En: http://www.fao.org/newsroom/es/news/2004/ 41714/index. html [consulta: 6 de Diciembre 2005].
Fitch, M, Moore P, Leong T (1997) Progress in transgenic papaya research: transformation for broader resistance among cultivars and micropropagating selected hybrid transgenic plants. Proceedings of Int. Symp. Biotechnology of Tropical and Subtropical species. Queensland, Australia. 29 September3 October.
Fitch, MM, Leong T, Akashi L, Yeh A, White S, De la Cruz A, Santo, L, Ferreira S, Moore PH (2005) Growth and yield of clonally propagated and seedling-derived papayas. I. growth. II yield. Journal of Horticultural Science and Biotechnology 40(5): 1283-1290
Gallardo, J, Kosky R, Tejeda M, Posada-Pérez L, Herrera I, Reyes M, García L R, Freire-Seijo M (2004) Empleo de secciones de tallo de plantas in vitro de papaya (híbrido IBP 42-99) para obtener callos con estructuras embriogénicas. Biotecnología Vegetal 4(4): 213-216
Hossain, M, Rahman N, Islam S, Joarder O (1993) High efficient plant regeneration from petiole explants of Carica papaya L. through organogenesis. Plant Cell Reports 13: 99-102
Jordan, M, Velozo J (1996) Improvement of somatic embryogenesis in highland-papaya cell suspensions. Plant Cell. Tissue and Organ Culture 44: 189-194
Mauren, M, Fitch M (1993) High frequency somatic embryogenesis and plant regeneration from papaya hypocotyls callus. Plant Cell Tissue and Organ Culture 32: 205 212
Murashige, T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15: 437-497
Pedroso A F (1990) Estudio de algunas fases de la micropropagación de la fruta bomba (Carica papaya L.). Trabajo de Diploma; UCLV. Fac. Ciencias Agropecuarias. Santa Clara.
Pinzón A (2003) Embriogénesis somática y regeneración de plantas en cuatro selecciones colombianas de Carica papaya L. Resúmenes de trabajos de grado meritorios. Volumen 8 No. 1. 145 pp.
Pires de Almeida, E, Pedroso de Oliveira R, Loyola Dantas J L (2001) Inducao e desenvolvimento de calos e embrioes somáticos em mamoeiro. Sci. Agric. 58 (1): 25-31
Rajeevan, S M, Pandey, R M (1986) Lateral bud culture of papaya (Carica papaya L.) for clonal propagation. Plant Cell, Tissue and Organ culture 6: 181-188
Reuveni, O, DR Shlesinger, U Lavi (1990) In vitro clonal propagation of dioecious Carica papaya L. Plant Cell, Tissue and Organ Culture 2: 41-46
Yu, T A, Yeh S D, Yang J S (2001) Effect of carbenicillin and cefotaxime on callus growth and somatic embryogenesis from adventitious roots of papaya. Bot. Bull. Acad. Sin 42: 281-286
Zhu, YJ, Agbayani P, Moore H (2004) Green Fluorescent protein as a visual selection marker for papaya (Carica papaya L) transformation. Plant Cell Rep. 22: 660-667
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
