Respuesta de plantas in vitro de banano cv. `Grande
naine' (Musa AAA) al estrés
hídrico inducido con polietilenglicol
In vitro response of banana plants cv. `Grande naine' (Musa AAA) to water stress induced with polyethylene glycol
Leonardo J. Moreno-Bermúdez1*, Rafael G. Kosky1, Maritza Reyes1, Catherine Mbabazi2, Borys Chong-Pérez1, *Autor para correspondencia
1Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las
Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba.
CP 54 830.
2Facultad
de Ciencias Agropecuarias. Departamento de Agronomía. Universidad Central
Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara.
Villa Clara. Cuba. CP 54 830. e-mail: ljmoreno@ibp.co.cu
RESUMEN
Los plátanos y bananos se cultivan en las regiones tropicales y subtropicales del mundo. Son cultivos que requieren altas condiciones de humedad, por lo que el déficit hídrico afecta su crecimiento y productividad. Mediante técnicas biotecnológicas se podrían obtener nuevos genotipos tolerantes a la sequía. Estos pueden ser seleccionados desde las fases de cultivo in vitro, con el uso de agentes osmo-estresantes incorporados en los medios de cultivo. El objetivo del presente trabajo fue determinar la respuesta de plantas in vitro de banano cv. `Grande naine' (Musa AAA) al estrés hídrico inducido con polietilenglicol. Se determinaron variables morfológicas (altura y número de brotes por planta), fisiológicas (contenido relativo de agua y contenido de clorofilas totales) y bioquímicas (contenido de prolina, malondialdehído y de peróxido de hidrógeno) en plantas sometidas al estrés y control. En las plantas sometidas a estrés se observó una disminución en la altura y el número de brotes, así como un aumento en el contenido de prolina y malondialdehído. El contenido relativo de agua, de clorofilas totales y de peróxido de hidrógeno no se vio afectado por el estrés. Teniendo en cuenta estos resultados, el uso del polietilenglicol 6000 como agente inductor de estrés hídrico, podría permitir la selección de plantas in vitro de banano cv. `Grande naine', tolerantes a la sequía.
Palabras clave: malondialdehído, prolina, selección, sequía
ABSTRACT
Bananas and plantains are grown in tropical and subtropical regions of the world. These plants required high humid conditions; therefore water deficit affects their growth and productivity. Through biotechnology, new drought tolerant genotypes could be obtained. These genotypes can be selected from in vitro culture by adding osmo-stressor agents to the media. The aim of this work was to determine the response of in vitro banana plants cv. `Grande naine' (Musa AAA) to water stress induced by polyethylene glycol. Morphological (height and number of shoots per explant), physiological (total chlorophyll and relative water chlorophyll contents) and biochemical (proline, malondialdehyde and hydrogen peroxide contents) traits of water stress were determined on stressed and unstressed plants. On stressed plants, a decrease in height and number of shoots per explant, and the increase in proline and malondialdehyde contents were observed. However, total chlorophyll, hydrogen peroxide and relative water contents were not affected. These findings showed that polyethylene glycol can be used as osmo-stress inducer for in vitro selection of drought tolerant banana plants.
Key words: drought, malondialdehyde, proline, selection
INTRODUCCIÓN
Los plátanos y bananos constituyen el alimento fundamental para más de 400 millones de personas en todo el mundo. Se cultivan en las regiones tropicales y subtropicales del mundo y requieren de alta humedad para su crecimiento y desarrollo (Robinson, 1996). La producción anual en más de 130 países es de aproximadamente 102 millones de toneladas por hectárea (FAOSTAT, 2012).
El cambio climático ha provocado un aumento de la temperatura global del planeta y una reducción de las precipitaciones, en algunas temporadas del año. Esto trae consigo que estos cultivos se vean afectados por diferentes tipos de estrés ambientales como temperaturas elevadas y sequía, los cuales afectan su productividad (Surendar et al., 2013).
Teniendo en cuenta lo anterior, sería beneficioso contar con nuevos cultivares de plátanos y bananos tolerantes a estrés abiótico, particularmente a la sequía. Esto podría ser posible con el uso de técnicas biotecnológicas como la inducción de mutaciones y la transformación genética de plantas.
Antes de llevar a campo las plantas obtenidas por estas vías, se hace necesario determinar la tolerancia desde las fases de cultivo in vitro. Para ello generalmente se emplean varios agentes osmo-estresantes, entre los cuales, el polietilenglicol (PEG) es uno de los más utilizados. Este compuesto, incorporado en el medio de cultivo, reduce el potencial osmótico, dificulta la absorción de agua por parte de las plantas, y de esta manera se pueden seleccionar solo aquellas que resistan las condiciones de estrés.
Existen estudios sobre la tolerancia al estrés hídrico in vitro inducido con PEG y en la fase de aclimatización, en varios cultivares de plátanos y bananos (Shekhawat et al., 2011; Bidabadi et al., 2012; Ravi et al., 2013). Sin embargo, no se han encontrado referencias sobre el tema en el cultivar `Grande naine', el cual es altamente susceptible al déficit hídrico (Ravi et al., 2013) y es uno de los más cultivados a nivel mundial. El presente trabajo tuvo como objetivo determinar la respuesta de plantas in vitro de banano cv. `Grande naine' (Musa AAA) al estrés hídrico inducido con polietilenglicol.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron plantas in vitro de banano cv. `Grande naine' (Musa AAA) con tres hojas o más, multiplicadas vía organogénesis según el protocolo propuesto por Orellana (1998).
Medios de cultivo
Se utilizó un medio de cultivo semisólido, compuesto por: sales MS (4.3 g l-1) (Murashige y Skoog, 1962) (Duchefa), tiamina 1.0 mg l-1, 6-bencilaminopurina (6-BAP) 4.0 mg l-1, ácido indolacético (AIA) 5.0 mg l-1, mio-inositol 100 mg l-1, ácido cítrico 50 mg l-1, sacarosa 30 g l-1, Gelrite (Duchefa) 2.8 g l-1 y como agente inductor del estrés hídrico PEG 6000 a una concentración de 30 g l-1, seleccionada a partir de resultados de experimentos preliminares. El pH del medio de cultivo fue ajustado a 5.8 con NaOH 1N y HCl 1N antes de su esterilización. Se emplearon frascos de vidrio con capacidad total de 250 ml. A cada frasco se le adicionaron 30 ml de medio de cultivo y posteriormente se esterilizaron en autoclave a 121ºC y 1.2 kg cm-2.
Condiciones de crecimiento
Los frascos de cultivo con los brotes fueron colocados en una cámara de crecimiento con luz solar con una intensidad aproximada de 70-85 µmol m-2 s-1 a 27±2°C. La evaluación del experimento se realizó a los 28 días de cultivo.
Procesamiento estadístico
Para el análisis estadístico se empleó el programa SPSS ver. 18.0 para Windows. Para el procesamiento de los resultados se realizaron pruebas paramétricas y no paramétricas luego de analizar los supuestos de normalidad y homogeneidad de varianzas.
Determinación de la respuesta de plantas sometidas a estrés hídrico
Se evaluaron variables morfológicas (altura de la planta (cm) y número de brotes), fisiológicas (contenido relativo de agua y contenido de clorofila total) y bioquímicas (contenido de prolina, peróxido de hidrógeno y malondialdehído).
Para la determinación de las variables bioquímicas y el contenido de clorofila total, se emplearon 10 réplicas por cada tratamiento (plantas control y plantas sometidas a estrés hídrico inducido con PEG 6000). Cada réplica estuvo conformada por 20 plantas in vitro que se pulverizaron con nitrógeno líquido y se almacenaron a -80 ºC, para posteriormente tomar alícuotas y hacer las determinaciones; estas se realizaron por espectrofotometría, tres veces para cada réplica en ambos tratamientos.
Número de brotes y altura
Se determinó el número de brotes y se midió la altura (cm) de cada planta (medida con una regla graduada desde la base de la planta hasta el ápice de la hoja más joven). Se evaluaron 100 plantas por cada tratamiento.
Contenido Relativo de Agua
Se determinó el Contenido Relativo de Agua (CRA) de 30 plantas según Shekhawat et al. (2011). Para ello fue necesario obtener la masa fresca (g), la masa seca (g), y la masa del explante en estado de turgencia (g), como se describe a continuación: la masa fresca se obtuvo al pesar las plantas después de extraerlas de los frascos de cultivo. Posteriormente, las plantas se hicieron flotar en agua desionizada a 4ºC, durante toda la noche y se pesaron para obtener la masa del explante en estado de turgencia. A continuación las plantas se secaron a 60ºC en estufa, la masa seca se obtuvo tras pesarlas varias veces hasta mantener peso constante. Para el cálculo del CRA se utilizó la ecuación:
CAR = (Masa Fresca _ Masa Seca) / (Masa de Turgencia _ Masa Seca) x 100
Contenido de Clorofila Total (a+b)
Para determinar el contenido de clorofila total se empleó el protocolo descrito por Mahmood et al. (2012) con modificaciones que se describen a continuación: a 100 mg de tejido vegetal previamente pulverizado se le añadieron 1.7 ml de acetona al 80% con solución tampón fosfato de sodio 2.5 mM (pH 7.8), se agitó en vórtex durante 5 minutos. Luego se centrifugó a 4ºC durante 15 minutos a 1 157 g y a continuación se midió la absorbancia a 663 y 645 nm y para el cálculo se empleó la siguiente ecuación propuesta por Porra et al. (1989):
[Chl a+b]=17.76 E646.6 +7.34 E663.6
Contenido de Peróxido de Hidrógeno (H2O2)
El contenido de H2O2 se determinó según lo descrito por Mahmood et al. (2012). A 200 mg de tejido vegetal se les adicionó 1 ml de ácido tricloroacético (TCA) al 0.1% (m/v) y luego se centrifugó a 12 000 g por 15 minutos. Se tomaron 0.5 ml del sobrenadante y se adicionaron 0.5 ml de solución amortiguadora de fosfato de potasio 10 mM (pH 7.0) y 1 ml de yoduro de potasio 1 M disuelto en agua bidestilada. Inmediatamente se leyó la absorbancia a 390 nm utilizando como blanco TCA al 0.1%. El contenido de H2O2 se determinó por una curva de calibración previamente realizada con concentraciones conocidas de este compuesto.
Contenido de Prolina
El contenido de prolina se determinó según Shekhawat et al. (2011) como se describe a continuación: a 100 mg de tejido vegetal se le adicionaron 2 ml de ácido sulfosalicílico al 3% (m/v) y se calentó a 100ºC durante 15 minutos. Posteriormente, fue enfriado en agua corriente y se centrifugado a 10 000 g por 2 minutos. Se extrajeron 2 ml del sobrenadante y se adicionó 2 ml de ninhidrina en medio ácido (0.1561 g de ninhidrina + 3.75 ml de ácido acético glacial + 2.5 ml de ácido fosfórico 3 M; Moreno et al., 2010) y ácido acético glacial respectivamente. La mezcla anterior fue calentada a 100ºC durante 45 minutos y luego se enfrió en hielo para terminar la reacción. A continuación, se adicionaron 4 ml de tolueno, se agitó vigorosamente y se dejó reposar durante unos minutos para extraer el producto de reacción. Se leyó la absorbancia a 520 nm utilizando como blanco el tolueno. El contenido de prolina se determinó por una curva de calibración previamente realizada con concentraciones conocidas de este aminoácido.
Contenido de Malondialdehído (MDA)
El contenido de MDA se determinó según Shekhawat et al. (2011). Para ello, a 100 mg de tejido vegetal se le adicionaron 2.4 ml de una solución de etanol: metanol 80:20 (v/v) con hidroxitolueno butilado al 0.01% (m/v). Se centrifugó a 8 000 g durante cinco minutos a 4ºC y el sobrenadante fue diluido 1:2 en la solución antes mencionada. Posteriormente, a 1 ml del sobrenadante diluido se adicionó 1 ml de TCA al 20% (m/v) (solución: -TBA). Simultáneamente a 1 ml del sobrenadante diluido se adicionó ácido tiobarbitúrico (TBA) al 0.65% (m/v) en TCA al 20% (solución: +TBA). A continuación, se agitó vigorosamente y se calentó en un bloque térmico a 95ºC durante 20 minutos. Pasado este tiempo, se colocó hielo para detener la reacción. Finalmente, se centrifugó a 8 000 g por 10 minutos y se midió la absorbancia del sobrenadante a 440, 532 y 600 nm utilizando como blanco TCA al 20%. Los equivalentes de MDA se calcularon según Hodges et al. (1999) con el empleo de las siguientes ecuaciones:
A = [(Abs532+TBA) _ (Abs600+TBA) _ (Abs532-TBA _ Abs600-TBA)]
B = [(Abs440+TBA _ Abs600+TBA) 0.0571]
Equivalentes de MDA (nmol ml-1) = ((A - B)/ 157 000) 106
RESULTADOS Y DISCUSIÓN
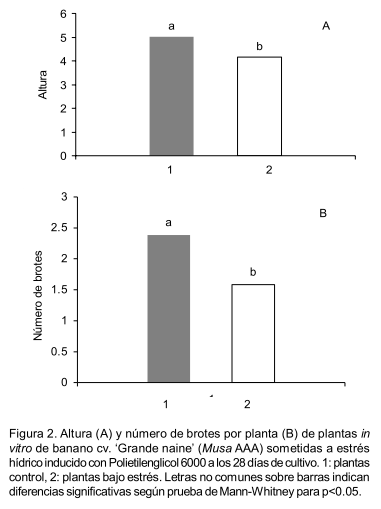
Se observaron diferencias en el número de brotes y la altura entre plantas sometidas a estrés hídrico y plantas control (Figura 1). Estas diferencias comenzaron a notarse a partir de los 15 días del período experimental, y fueron significativas al finalizar el experimento a los 28 días de cultivo (Figura 2).
Estos resultados demuestran que el PEG 6000 inhibió la proliferación de brotes y afectó negativamente el crecimiento de las plantas, ello concuerda con lo informado por Jaleel et al. (2009) quienes plantearon que el crecimiento de las plantas es uno de los procesos que se ven afectados por el estrés abiótico. Por su parte Mahmood et al. (2012) también observaron una disminución en el número de brotes en plantas in vitro de banano cv. `Berangan' (Musa AAA), sometidas a estrés hídrico inducido con PEG 6000.
Otro carácter morfológico que se vio afectado por la presencia de PEG en el medio de cultivo fue la disposición y las dimensiones de las hojas. Aunque no fue determinada el área foliar, a simple vista sí se pudo observar que las hojas de las plantas que crecieron en el medio de cultivo con PEG 6000, fueron más pequeñas que las de las plantas control y se dispusieron de forma vertical, a diferencia de estas últimas que crecieron de forma horizontal (Figura 1). Según lo informado por Paleg y Blumwald (2011) las plantas afectadas por estrés hídrico pueden mostrar cambios como estos.
En el CRA no se observaron diferencias significativas entre las plantas de los dos tratamientos, los valores estuvieron en un rango entre el 16.85 y 20.56%. Esta variable es muy utilizada para detectar la tolerancia de plantas al déficit hídrico. En plantas tolerantes se han observado mayores valores de CRA comparado con plantas susceptibles, debido a que pueden absorver mejor el agua y retenerla más fácilmente en sus tejidos. Por ejemplo, Shekhawat et al. (2011) obtuvieron plantas de banano cv. `Rasthali' (Musa AAB) tolerantes a déficit hídrico, que mostraron mayores valores de CRA comparado con plantas control, cuando fueron sometidas a estrés inducido con PEG. Para dicho estudio los autores citados utilizaron un PEG de mayor peso molecular (8000) a las concentraciones de 20 y 50 g l-1.
Por otro lado, Mahmood et al. (2012) utilizaron PEG 6000 a una concentración de 30 g l-1 y obtuvieron diferencias significativas en el CRA entre plantas de banano sometidas a estrés y control en el cultivar `Berangan', que pertenece al mismo grupo del `Grande naine' (Musa AAA).
En los dos trabajos antes mencionados, para la determinación de esta variable se utilizaron hojas de plantas, a diferencia del presente estudio en el que se emplean plantas in vitro completas. Este factor pudo haber influido en la diferencia entre los resultados que aquí se presentan y los citados, y se pudiera tener en cuenta en futuras determinaciones. Además, en la etapa de cultivo in vitro la humedad relativa dentro de los frascos de cultivo se mantiene elevada, lo cual hace que la pérdida de agua no sea significativa y por consiguiente el CRA no se vea muy afectado por el estrés, por lo que el ambiente gaseoso dentro de los frascos también podría haber incidido en los resultados presentados en este acápite.
El contenido de clorofila total no mostró diferencias significativas entre plantas sometidas al estrés y el control. Los valores de esta variable estuvieron entre 82.9 y 130.7 µg g-1 de masa fresca (MF). Contrario a estos resultados, Mahmood et al. (2012) obtuvieron mayores valores de clorofila en plantas sometidas a estrés hídrico en banano cv. `Berangan' cultivado in vitro. Sin embargo, Ravi et al. (2013) observaron una reducción del contenido de clorofila en plantas sometidas a déficit hídrico. Estos autores señalaron que la sequía afecta la función fotosintética en las plantas, y que esta afectación se hace más visible en los mecanismos del fotosistema II que en los del fotosistema I. La desconexión del transporte de electrones genera la foto-oxidación de la clorofila y por consiguiente la pérdida de la capacidad fotosintética.

Aunque se evidenció una afectación en altura y el número de brotes de las plantas sometidas a estrés, el hecho de que el contenido de clorofila total no se haya visto afectado pudiera estar dado por una mayor disposición de cloroplastos por unidad de área dentro del parénquima de las hojas de estas plantas, debido a la redución del área foliar que también se observó en ellas con respecto a las plantas control (Figura 1). No obstante pudieran hacerse más estudios en ese sentido como por ejemplo la determinación de clorofilas totales con el empleo de otros solventes como Dimetilsulfóxido (DMSO) y Metanol que han sido también sugeridos y empleados por otros autores (Porra et al.,1989).
El contenido de H2O2 no mostró diferencias significativas entre los dos tratamientos estudiados, los valores oscilaron entre 4.2 y 15.8 µmol g-1 MF. Sin embargo, otros autores han informado del incremento de H2O2 en plantas de Musa sometidas a estrés hídrico (Mahmood et al., 2012).
Para futuras investigaciones pudieran incluirse análisis enzimáticos, además de realizar evaluaciones del contenido de H2O2 en el tiempo, pues es posible que a los 28 días cuando se evaluaron las plantas, algunas de las enzimas mencionadas hayan contribuido a la disminución de esta molécula en las células.
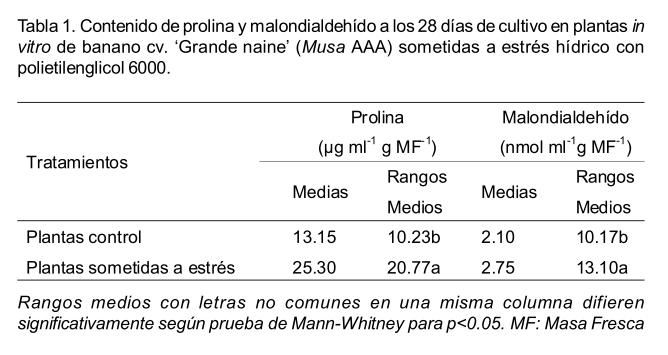
El contenido de prolina, se acumuló en mayor cantidad en las plantas sometidas a estrés con respecto a las controles. Según Díaz et al. (1999), la prolina se acumula en el citoplasma de las células de las plantas en concentraciones superiores a las normales, en respuesta a diferentes tipos de estrés como la salinidad y la sequía. A través de la acumulación de prolina y otros osmolitos compatibles (oligosacáridos, glutamato, glicina-betaína, sacarosa, manitol), las células vegetales disminuyen su potencial osmótico lo que hace que también descienda el potencial hídrico y de esta manera se favorece el movimiento del agua hacia el interior de las mismas. Otros autores han encontrado un aumento de prolina en el cultivo de plátanos y bananos sometidos a diferentes tipos de estrés como la salinidad y la sequía (Shekhawat et al., 2011; Mahmood et al., 2012).
Al igual que en el contenido de prolina en el de MDA se observaron diferencias significativas entre plantas con estrés hídrico inducido por PEG 6000 y plantas control (Tabla 1). El MDA es un indicador de daños celulares causados por estrés oxidativo, este es el producto final de la peroxidación lipídica, proceso que hace referencia a la degradación oxidativa de los lípidos tras sucesivas reacciones en cadena, ocasionadas por los radicales libres generados ante situaciones de estrés. Este proceso afecta el complejo de membranas de la célula, por lo que puede incidir de manera negativa en procesos celulares tales como la respiración (cuando afecta las membranas mitocondriales) y la fotosíntesis (cuando afecta las membranas de los tilacoidales en los cloroplastos) (Mahouachi et al., 2005). Por tanto, el aumento de MDA observado en las plantas sometidas a estrés en el presente estudio, evidencia el daño celular causado por el estrés oxidativo, producto del déficit hídrico ocasionado por el PEG 6000.
CONCLUSIONES
Las plantas de banano cv. `Grande naine' mostraron una respuesta variable al estrés hídrico inducido in vitro con PEG 6000. Se afectó negativamente la altura, el número de brotes por planta, el contenido de prolina y de malondialdehído. Sin embargo, no se afectó el contenido relativo de agua, de clorofila total y de peróxido de hidrógeno. Esta respuesta podría servir de base para emplear las variables afectadas por el estrés, como indicadores en estudios de tolerancia a la sequía en el cultivar de banano `Grande naine'.
REFERENCIAS
Bidabadi SS, Mahmood M, Baninasab B, Ghobadi C (2012) Influence of salicylic acid on morphological and physiological responses of banana (Musa acuminata cv. `Berangan', AAA) shoot tips to in vitro water stress induced by polyethylene glycol. Plant Omics Journal 5(1):33-39
Díaz P, Borsani O, Monza J (1999) Acumulación de prolina en plantas en respuesta al estrés osmótico. Agrociencia 3(1): 1-10
FAOSTAT (2012) Producción de cultivos [En línea] En: http://faostat.fao.org Consultado: 20 de enero de 2013
Jaleel CA, Riadh K, Gopi R, Manivannan P, Ines J, Al-Juburi HJ, Chang-Xing Z, Hong-Bo S, Panneerselvam R (2009) Antioxidant defense responses: physiological plasticity in higher plants under abiotic constraints. Acta Physiol Plant 31(3): 427_436
Hodges DM, John M, Charles FD, Forney D, Robert KP (1999) Improving the thiobarbiture acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Plant 202: 604-611
Mahmood M, Bidabadi SS, Ghobadi C, Gray DJ (2012) Effects of methyl jasmonate treatment on alleviation of polyethylene glycol-mediated water stress in banana (Musa acuminate cv. ´Berangan`, AAA) shoot tip cultures. Plant Growth Regul 68: 161-169
Mahouachi, J, Gómez-Cadenas
A, Primo-Millo E, Talón M (2005) Antagonistic Changes between
Abscisic Acid and Gibberellins in Citrus Fruits Subjected to a Series of Different
Water Conditions. J Plant Growth Regul. 24: 179-187
Moreno L, Crespo S, Pérez W, Melgarejo LM (2010) Pruebas bioquímicas como herramientas para estudios en fisiología. En: Melgarejo LM (Ed.) Experimentos en fisiología vegetal, pp. 187-248. Universidad Nacional de Colombia, Colombia
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant 15: 473-497
Orellana PP (1998) Propagación vía organogénesis. En: Pérez, JN (Ed). Propagación y mejora genética de plantas por Biotecnología, pp.151-177. IBP, Santa Clara
Paleg Z, Blumwald E (2011) Hormone balance and abiotic stress tolerance in crop plants. Curr Opin Plant Biol. 14(3): 290-295
Porra RJ, Thompson WA, Kriedemann PE (1989) Determination of accurate extinction coeficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectrometry. Biochim Biophys Acta 975: 384_394
Ravi I, Subbaraya U, Muthu M, Vaganan MM, Mustaffa MM (2013) Phenotyping bananas for drought resistance. Front Physio. 4:1-15
Robinson JC (1996) Bananas and Plantains. CAB International, Oxon
Shekhawat, UKS, Srinivas L, Ganapathi TR (2011) Musa DHN-1, a novel multiple stress inducible Sk3- type dehydringene, contributes affirmatively to drought and salt-stress tolerance in banana. Planta 234: 915-932
Surendar KK, Durga Devi D, Ravi I, Jeyakumar P, Velayudham K (2013) Water Stress affects plant relative water content, soluble protein, total chlorophyll content and yield of ratoon banana. Int J Hort. 3(17): 12-18
Recibido: 7-11-2013
Aceptado: 20-12-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
