Artículo Científico Biotecnología Vegetal Vol. 7, No. 3: 161 - 169, julio-septiembre, 2007
ISSN 1609-1841 (Versión impresa) ISSN 2074-8647 (Versión electrónica)
Evaluación del efecto de tres condiciones de cultivo in vitro en la calidad de plántulas de caña de azúcar propagadas en Biorreactores de Inmersión Temporal
Liuba Peñate1, O. Concepción2, C. Aragón2, R. Rodríguez2, J. L. González-Olmedo2, M. Escalona2, M. Cid2, D. Pina2. *Autor para correspondencia
1Departamento de Biología. Universidad Central Marta Abreu de las Villas. Santa Clara. Cuba. e-mail: liubapa@uclv.edu.cu
2Laboratorio de Cultivo de Células y Tejidos, Centro de Bioplantas. Carretera a Morón km. 9, UNICA, Ciego de Ávila, CP 69 450. Cuba.
RESUMEN
Las plantas micropropagadas poseen deficiencias estructurales y funcionales que comprometen su supervivencia durante la aclimatización. El objetivo de este trabajo fue determinar el efecto de tres condiciones de cultivo in vitro (autotrófica, mixotrófica y de mixotrofismo moderado) en el comportamiento morfo-fisiológico y bioquímico de plántulas de caña de azúcar propagadas en Biorreactores de Inmersión Temporal (BIT). Se evaluaron indicadores morfológicos, fisiológicos y enzimas clave del metabolismo del carbono. Las plántulas que se sometieron a condiciones autotróficas no lograron sobrevivir debido al estrés propiciado por la ausencia de sacarosa en el medio de cultivo. Por esta razón no pudieron ser evaluadas. Los mejores resultados se obtuvieron para la condición de mixotrofismo moderado. En este caso, las variables morfológicas altura de las plantas, masas fresca y seca respondieron positivamente. La respuesta de la fotosíntesis neta fue muy baja in vitro y aumentó notablemente a partir de la segunda semana de aclimatización. Para las plántulas con un desarrollo mixotrófico se observaron valores de transpiración y conductancia estomática muy elevados al inicio de la elongación y durante la primera semana de aclimatización. Este grupo de plántulas se tardó más que el resto en lograr el control de la pérdida de agua y en alcanzar una estabilidad funcional. Las plantas que mostraron una mayor actividad de la Piruvato Quinasa fueron provenientes de condiciones mixotróficas. La Fosfoenol Piruvato Carboxilasa tuvo un comportamiento totalmente inverso. Las actividades de la Sacarosa Sintasa y la Invertasa Neutra, al igual que la Piruvato Quinasa, fueron superiores para las condiciones mixotróficas.
Palabras clave: autotrofismo, enzimas, fotosíntesis, mixotrofismo
ABSTRACT
Structural and functional deficiencies that affect survival during acclimatization are present in micropropagated plants. The current study was carried out to determine the effect of three in vitro culture conditions (autotrophic, mixotrophic and moderate mixotrophic) on the morph-physiological and biochemical behavior of plantlets of sugar cane propagated in Temporary Immersion Bioreactors (BIT). Morphological and physiological indicators and key enzymes of carbon metabolism were evaluated. Plantlets that were subjected to autotrophic conditions did not survive due to the stress caused by the absence of sucrose in the culture medium. For this reason it could not be evaluated. The best results were obtained for the condition of moderate mixotrofical. In this case, the morphological variables, height of the plants, fresh weight and dry weight, responded positively. It was minimum the answer of the net photosynthesis in vitro and increased it notably from the second week of acclimatization. Plants with a mixotrophic growth showed very high values of transpiration and estomatic conductance at the beginning of the elongation and during the first week of acclimatization. This group of plants took a longer time than the rest in achieving the control of the loss of water and in reaching a functional stability. Plants that showed a bigger activity of pyruvate kinase were those coming from mixotrophic conditions. An inverse behavior was observed in the phosphoenolpyruvate carboxylase. The activities of syntase sucruse and the neutral invertase were superior for the mixotrofic conditions.
Key words: autotrofic, enzymes, mixotrofic, photosynthesis
INTRODUCCIÓN
La caña de azúcar (Saccharum spp. híbrido) por su importancia económica se encuentra entre los cultivos de mayor extensión a escala mundial. En Cuba constituyó desde el primer momento la principal industria capaz de aportar ingresos a la economía. Las técnicas de micropropagación han demostrado ser una importante alternativa para el cultivo de esta planta. No obstante, a pesar de sus ventajas, aún continúa la búsqueda de otros métodos para la propagación in vitro de la caña de azúcar (Bernal et al., 2002).
En este sentido, una de las más novedosas tecnologías que se utilizan son los Biorreactores de Inmersión Temporal. Su uso ha permitido alcanzar grandes niveles de proliferación durante la etapa de multiplicación en varias especies (Lorenzo et al., 1998; Aragón et al., 2005; Castro y González-Olmedo, 2005; Molina et al., 2005) y brinda la posibilidad de controlar las propiedades químicas y físicas en el ambiente de los recipientes de cultivo (Cejas et al., 2005). Además, soluciona las dificultades de los cultivos en medios líquidos incubados en condiciones estáticas y aumenta la eficiencia biológica del material vegetal propagado (Escalona et al., 2003).
El manejo de las condiciones de cultivo in vitro en los BIT juega un papel muy importante en la eficiencia del proceso de adaptación en la fase de aclimatización. Con ello se garantiza el desarrollo de plántulas que alcancen la calidad requerida para poder adaptarse en el menor tiempo posible a los cambios ambientales existentes en las casas de cultivo (Díaz et al., 2004).
Las tres tendencias a seguir en el mundo en relación con las condiciones de cultivo que pudieran establecerse en los BIT, teniendo en cuenta la intensidad lumínica, la concentración de CO2, así como la concentración de sacarosa en el medio de cultivo, se han definido como autotrófica, mixotrófica y de mixotrofismo moderado o atenuado (Afreen et al., 2002). Sin embargo, para la caña de azúcar aún se desconoce cuál de estas condiciones posibilita plántulas con una mayor capacidad adaptativa y su influencia en la fase de aclimatización. Los estudios morfo-fisiológicos y bioquímicos durante la última fase in vitro y la aclimatización de estas plántulas pueden ayudar a dilucidar esta problemática. El objetivo de este trabajo fue determinar el efecto de tres condiciones de cultivo in vitro (autotrófica, mixotrófica y de mixotrofismo moderado) sobre el comportamiento morfo-fisiológico y bioquímico de plántulas de caña de azúcar propagadas en Biorreactores de Inmersión Temporal.
MATERIALES Y MÉTODOS
Técnicas y procedimientos generales
Los experimentos se desarrollaron en el laboratorio de Cultivo de Células y Tejidos y el Área de Adaptación del Centro de Bioplantas de la Universidad de Ciego de Ávila (UNICA). Como material vegetal se utilizó la especie Saccharum spp. híbrido, variedad C90-317. Los explantes iniciales para el cultivo in vitro se colectaron a partir de plantas élites adultas cultivadas y seleccionadas en la Estación Provincial de Investigaciones de la Caña de Azúcar (EPICA) de Ciego de Ávila.
Condiciones de cultivo in vitro
Para las fases de establecimiento y subcultivo se utilizaron frascos de cultivo de 250 ml de capacidad, con un volumen de 25 ml de medio de cultivo semisólido MS (Murashige y Skoog, 1962) en cada uno. En todos los experimentos se colocaron siete explantes por frasco.
En la fase de proliferaron se utilizaron BIT según lo descrito por Lorenzo et al. (1998). El medio de cultivo que se empleó estuvo compuesto por sales MS (Murashige y Skoog, 1962), vitaminas Heinz, sacarosa 30 g.l-1, mio-inositol 100 mg.l-1, 6-Bencilaminopurina (6-BAP) 0.3 mg.l-1 y Paclobutrazol (PBZ) 1.0 mg.l-1. El pH se ajustó a 6.0 antes de esterilizar en la autoclave.
El sistema de BIT se ajustó a una frecuencia de inmersión de 4 min. cada 3 h y la fase de proliferaron se desarrolló durante 28 días. Las plántulas se incubaron a 25 ± 2°C y la luminosidad se logró con el empleo de tubos fluorescentes blancos, los que proporcionaron 35 ± 5 μmol fotones m-2.s-1 con un fotoperíodo de 16 h luz y 8 h oscuridad.
Durante la fase de elongación se ensayaron tres condiciones de cultivo in vitro: autotrófica, mixotrófica y de mixotrofismo moderado. Las condiciones de cultivo que se establecieron se especifican en la tabla 1.
Condiciones de aclimatización
La fase de aclimatización se desarrolló durante 42 d, según Rodríguez et al. (2003). Las bandejas empleadas poseían 52.5 cm de largo, 29.5 cm de ancho y 4.0 cm de alto con 144 pocillos. Las casas de cultivo mantenían una temperatura promedio según mediciones realizadas durante dos meses de 28 ± 1oC, una humedad relativa de 90% y condiciones atmosféricas de concentración de CO2 natural (375-400 μmol.mol-1).
Caracterización morfológica de las plantas propagadas en BIT durante la fase de aclimatización
Se determinaron diferentes indicadores morfológicos: altura de las plantas (cm), masa fresca (g), masa seca (g) y número de hojas. Las evaluaciones se realizaron a los 0, 7, 21, 35 y 42 d durante la fase de aclimatización.

La masa fresca y la masa seca se determinaron después de las medidas de intercambio de gas. La medición de la masa seca se realizó colocando las plántulas durante 72 h a 70oC en estufa de convección (HSA), hasta alcanzar una masa constante. En todos los experimentos se tomaron 30 plantas para la evaluación de los indicadores morfológicos, las cuales se consideraron como unidad experimental.
El porcentaje de supervivencia (%) se calculó por primera vez después de los 14 d de las plántulas ser transplantadas. Se continuaron realizando evaluaciones a los 21, 35 y 42 d de aclimatización.
Caracterización fisiológica de las plantas al inicio de la fase de elongación en BIT y durante su posterior aclimatización
Los indicadores fisiológicos que se midieron para realizar la caracterización fueron actividad fotosintética (µmol (CO2) m-2s-1), conductancia estomática (mmol (H2O) m-2s-1) y transpiración (mmol (H2O) m-2s-1). Las evaluaciones se realizaron al inicio de la elongación y a los 0, 7, 21, 35 y 42 d durante la fase de aclimatización.
Para la evaluación de la actividad fotosintética y la transpiración se emplearon siempre hojas completamente expandidas y fotosintéticamente activas (completamente verdes). Las mismas se tomaron entre las 9:00 am y 10:00 am. Estas actividades y la de conductancia estomática fueron medidas con el empleo de un Sistema Portátil de Fotosíntesis, Europe, PP Systems, UK (CIRAS-2), acoplado a una cubeta universal (PLC6). El área de la cubeta se cubrió totalmente (2.5 cm2) con las hojas jóvenes completamente expandidas. Se realizaron cinco mediciones en cada momento de evaluación, con diez repeticiones para un total de 50 valores.
Caracterización metabólica de las plantas al inicio de la fase de elongación en BIT y durante su posterior aclimatización
- Extracción y medición de la actividad enzimática para la Fosfoenol Piruvato Carboxilasa (FEPC) (EC 4.1.1.31) y Piruvato Quinasa (PQ) (EC 2.7.1.40)
Para la cuantificación de las enzimas se utilizaron 250 mg de segmentos de las hojas frescas, se colocaron inmediatamente en nitrógeno líquido y se maceraron en mortero. Las enzimas fueron extraídas resuspendiendo el material vegetal en 1 ml de 50 mmol.l-1 Hepes-KOH, 12 mmol.l-1 MgCl2, 1 mmol.l-1 EGTA, 1 mmol.l-1 EDTA, 1 mmol.l-1 DTT, 10% glicerol, 2 mmol.l-1 de benzamidina, 2 mmol.l-1 ácido n-amino capróico a pH 7.4 según Siegel y Stitt (1990). La reacción catalizada por la FEPC se acopló con la reacción de la malato deshidrogenasa y se ensayó a 25°C registrando la utilización de NADH a 340 nm en un espectrofotómetro (Pharmacia).
La solución de ensayo contenía 1 ml de solución (Le et al., 1991), 718 µl 50 mmol.l-1 Hepes-KOH, pH 7.6, 10 µl 1 mol.l-1 NaHCO3, 10 µl 20 mmol.l-1 NADH, 10 µl 1 mol.l-1 MgCl2, 1 µl 1 mol.l-1 DDT, 1 µl 1 mol.l-1 EDTA, 5 unidades de malato deshidroganasa, 20 µl 1 mmol.l-1 glucosa-6P y 25 µl del extracto. Las reacciones se iniciaron con 5 µl 1 mol.l-1 de fosfoenolpiruvato. La reacción de PQ se acopló con la reacción de la lactato deshidrogenasa y se ensayó a 25°C seguida por la utilización de NADH a 340 nm. La actividad de PQ se ensayó en tampón imidazol-HCl 50 mmol.l-1, 2 mmol.l-1 fosfoenolpiruvato, 2 mmol.l-1 ADP, 10 mmol.l-1 MgCl2, 30 mmol.l-1 KCl, 0.15 mmol.l-1 NADH y 2.5 unidades.ml-1 desalinizados de lactato deshidroganasa de músculo de conejo para un volumen final de 1 ml a pH 7.0.
Se utilizaron hojas de diferentes plántulas seleccionadas de forma aleatorizada. Se realizaron cuatro extracciones y se determinaron las actividades de cada una por triplicado, para un total de 12 valores.
- Extracción y medición de la actividad enzimática para la Sacarosa Sintasa (SS) (EC 2.4.1.13) e Invertasa Neutra (IN) (EC 3.2.1.26)
Para el análisis de las enzimas se emplearon 250 mg de masa fresca de hojas completamente expandidas, las cuales se homogenizaron en nitrógeno líquido con la ayuda de un mortero. Las enzimas se extrajeron según el método descrito por Geigenberger y Stitt (1991).
La actividad de la IN se determinó en una mezcla de reacción de 500 µl del volumen total que contiene enzimas libres de sales y 50 mmol.l-1 de sacarosa. Se utilizó un tampón (HEPES-KOH) a pH 7.5. La reacción se inició con la adición de la enzima, incubada previamente durante 20 min. a 30oC. La formación de hexosa se determinó enzimáticamente según la técnica descrita por Miron y Schàffer (1991), la que se expresó en µmol.h-1 g-1 mf.
La actividad de la SS se determinó por el mismo procedimiento descrito para las invertasas, pero con la adición de 10 µl de Uridin Difosfato (UDP) a 10 mmol.l-1 después que la reacción catalizada por la IN llegara a su completa verificación. La actividad enzimática se expresó en µmol.h-1g-1 mf según el método de Anguenot (2003).
Se utilizaron hojas de diferentes plántulas seleccionadas de forma aleatorizada. Se realizaron cuatro extracciones y se determinaron las actividades de cada una por triplicado, para un total de 12 valores.
Análisis estadístico
El análisis estadístico se realizó utilizando el procesador Statistical Software Package (SPSS versión 11.5 para Windows Copyright© SPSS, INC, 1998). Se comprobó la distribución normal y la homogeneidad de varianza de los datos mediante las pruebas Kolmogorov-Smirnov (p<0.05) y la prueba Levene (p<0.05), respectivamente. Se utilizaron las pruebas paramétricas T test para un valor de p=0.05. Todo el trabajo experimental se realizó bajo un diseño completamente aleatorizado.
RESULTADOS Y DISCUSIÓN
Caracterización morfológica de plantas de caña de azúcar propagadas en Biorreactores de Inmersión Temporal durante la fase de aclimatización
Las plántulas de caña de azúcar propagadas en BIT que crecieron bajo condiciones autotróficas no lograron sobrevivir. Es por ello que no fue posible realizarles ninguna de las evaluaciones determinadas para la caracterización morfológica durante la fase de aclimatización.
A las dos semanas después de establecidas las condiciones de cultivo se comenzó a observar en las plántulas daños en el follaje, caracterizado por un amarillamiento y marchitez del mismo (Figura 1). El medio de cultivo mostró cambios en su coloración, tornándose de color naranja intenso.
Los daños descritos en las hojas pudieron estar ocasionados, primero por la necesidad de sacarosa ante la imposibilidad de estas plántulas de poder realizar fotosíntesis in vitro y luego por un proceso de fotooxidación debido a los altos valores de flujo de fotones fotosintéticos. La coloración presente en el medio de cultivo presumiblemente fue causada por la presencia de compuestos fenólicos excretados por las plántulas, lo que pudiera constituir un indicador de la existencia de estrés.
En investigaciones realizadas por Ferreyra et al. (2002) se comprobó que los fenoles y antocianinas aumentan significativamente en los tratamientos con estrés hídrico. Otros estudios refieren que cualquier régimen deficitario provoca un aumento de los fenoles y en particular las antocianinas (Imbert, 2003).
De forma general, la muerte de las plántulas sometidas a condiciones autotróficas pudo estar relacionada con el estrés propiciado por la ausencia de sacarosa como fuente carbonada en el medio de cultivo. Estudios histológicos realizados por Rodríguez et al. (2003) demostraron que el pobre desarrollo de la anatomía Kranz de los órganos foliares de plántulas de caña de azúcar propagadas en BIT no permite realizar una actividad fotosintética, a través de la cual se pueda producir toda la sacarosa que se necesita para el desarrollo y la supervivencia de estas plántulas.

Las plántulas que crecieron en un medio de cultivo con 15 g.l-1 de sacarosa, aunque lograron sobrevivir, mostraron un pobre desarrollo. Para estas condiciones se pudo apreciar la misma coloración naranja intensa en el medio de cultivo que se observó en las plántulas sometidas a condiciones autotróficas. Teniendo en cuenta que las intensidades de luz y la concentración de CO2 para estas plántulas fueron iguales que para las analizadas anteriormente y lo único que varió para ambas fue la concentración de sacarosa, entonces se puede concluir al respecto que lo que limitó fundamentalmente el desarrollo de las mismas fue la cantidad de sacarosa exógena suministrada al medio de cultivo. Con esto se evidencia la importancia que tiene para las plántulas de caña de azúcar propagas en BIT este disacárido en el medio de cultivo que se utilice.
Las plántulas que crecieron bajo condiciones de mixotrofismo moderado presentaron muy buena apariencia. La transparencia del medio de cultivo sugirió que las condiciones donde se estaban desarrollando no les causaron un estrés tan notable.
El porcentaje de supervivencia es un indicador muy importante en la fase de aclimatización, pues de él depende la cantidad de plantas que pueden llevarse al campo posteriormente. Las plántulas que fueron transferidas a la fase de aclimatización alcanzaron, en la evaluación realizada a los 14 d de esta etapa, un 81.4% de supervivencia para las condiciones mixotróficas y un 93.5% para las condiciones de mixotrofismo moderado. Los valores referidos anteriormente se mantuvieron estables hasta el último momento de evaluación.
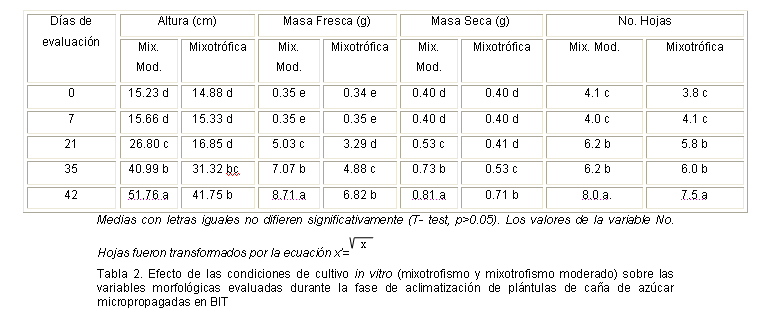
La tabla 2 muestra el comportamiento de las variables morfológicas evaluadas durante la fase de aclimatización de plántulas de caña de azúcar propagadas en BIT.
Las plántulas que presentaron mayor altura fueron aquellas que crecieron bajo condiciones de mixotrofismo moderado. A partir de los 7 d se observó un aumento notable de la altura de las mismas y los valores más elevados (51.76 cm) se obtuvieron a los 42 d. Sin embargo, para las condiciones mixotróficas el incremento de esta variable no se mostró hasta los 21 días.
Así como con la altura, los mayores valores de masa fresca y masa seca se obtuvieron en plántulas que crecieron bajo condiciones de mixotrofismo moderado. Hasta los 7 días estas plántulas manifestaron un típico período de transición, en el cual los incrementos de ambas variables fueron pobres. A partir de la segunda semana se observó una ascendente evolución en sus comportamientos, alcanzando valores de hasta 8.71 g de masa fresca y 0.81 g de masa seca a los 42 días. Por el contrario al comportamiento de las variables anteriores, el número de hojas por planta, no mostró diferencias significativas entre ambos tratamientos. En este caso sólo se observaron nuevas emisiones foliares a partir de la segunda semana durante el período evaluado.
A medida que la masa fresca de las plántulas aumenta, por el desarrollo de sus órganos, éstos son capaces de acumular mayores reservas que pueden ser empleadas en los días siguientes de su traslado a condiciones ex vitro, hasta que emitan el nuevo follaje y el sistema radical para establecer un comportamiento autotrófico. Esto indica que las plantas provenientes del medio de cultivo con 30 g.l-1 de sacarosa contaban con una mayor cantidad de reserva que las que fueron sometidas a las condiciones mixotróficas, lo que le permitiría una mejor adaptación a las condiciones ex vitro. Los porcentajes de supervivencia durante la fase de aclimatización lo corroboran.
Caracterización fisiológica de las plantas al inicio de la fase de elongación en Biorreactores de Inmersión Temporal y durante su posterior aclimatización
Al inicio de la fase de elongación no se apreció actividad fotosintética en las plantas sometidas a ambas condiciones experimentales. Durante todo el proceso de aclimatización la respuesta de la fotosíntesis neta fue significativamente superior para las plántulas que tuvieron un desarrollo mixotrófico moderado. La actividad fotosintética de estas plántulas fue muy baja en el momento de salida de las condiciones in vitro, con valores de 0.32 µmol (CO2) m-2s-1 (Tabla 3). Resultados similares fueron alcanzados por Rodríguez et al. (2003). Estos autores obtuvieron valores de 0.45 µmol (CO2) m-2s-1, lo que evidenció que las plántulas de caña de azúcar mientras se encuentran en los BIT realizan muy poca actividad fotosintética.
Durante el cultivo in vitro, se han observado bajas tasas de fotosíntesis neta en diferentes especies (Le et al., 2001). Valores tan pequeños de esta variable alcanzados en disímiles casos, indican la incapacidad de muchas plántulas de desarrollarse autotróficamente en condiciones in vitro y por tanto, durante los primeros días de aclimatización. Es por ello, que se hace tan importante la cantidad de sacarosa almacenada en las hojas durante este período. La aparición de nuevas emisiones foliares en la fase de aclimatización garantiza un mayor grado de autotrofismo que permita un incremento paulatino de la actividad fotosintética, pues estas hojas presentan un aparato estomático más desarrollado.
Durante la primera semana de aclimatización la fotosíntesis neta comenzó a aumentar tanto para las plantas que fueron sometidas a condiciones mixotróficas como las que se expusieron a las condiciones de mixotrofismo moderado. En la medida que surgieron nuevas hojas con mejores características el incremento de esta variable se fue haciendo más notable. A partir de los 7 d la fotosíntesis neta resultó ser significativamente mayor para las plántulas provenientes de condiciones de mixotrofismo moderado que para las que se desarrollaron mixotróficamente. Los niveles alcanzados por este último grupo de plantas a los 42 d de aclimatización (7.68 µmol (CO2) m-1s-1) no lograron superar los valores observados a los 21 d (13.16 µmol (CO2) m-1s-1) para las plantas que crecieron en un medio de cultivo con 30 g.l-1 de sacarosa. Tal diferencia entre ambos grupos de plantas sugiere que las que estuvieron sometidas a las condiciones de mixotrofismo moderado presentaron una mejor calidad metabólica en las hojas y por tanto, su actividad fotosintética va a ser mayor.
En la fase de elongación y hasta los 21 d de aclimatización la transpiración fue superior para las plantas que crecieron en un medio de cultivo con 15 g.l-1 de sacarosa, las cuales alcanzaron los mayores valores al final de la fase de elongación. A partir de este momento se observó una disminución gradual de la transpiración hasta los 21 d de aclimatización. Por el contrario, para las plántulas que tuvieron un desarrollo mixotrófico los niveles de esta variable se estabilizaron a partir de los primeros siete días. Esto evidencia que dicho grupo de plántulas fue capaz de lograr el control de la pérdida de agua con mayor rapidez. Los datos de conductancia estomática confirman lo analizado anteriormente con relación al comportamiento de la transpiración.

Caracterización metabólica de las plantas al inicio de la fase de elongación en Biorreactores de Inmersión Temporal y durante su posterior aclimatización
- Extracción y medición de la actividad enzimática para la Fosfoenol Piruvato Carboxilasa (FEPC) (EC 4.1.1.31) y Piruvato Quinasa (PQ) (EC 2.7.1.40)
La actividad de la PQ en las plantas refleja cómo ocurre en ellas la obtención de energía a través de la respiración. Para ambas condiciones, la mayor actividad se obtuvo durante la fase de elongación (Figura 2-A). Desde la primera semana hasta los 42 d de aclimatización se describió una disminución gradual de la actividad de esta enzima. Los mayores valores se registraron para las plantas provenientes de condiciones mixotróficas.
Por el contrario, la actividad de la FEPC se identifica con sus mayores niveles en plantas que estuvieron sometidas a condiciones de mixotrofismo moderado. Estas plantas, al igual que las que crecieron en un medio de cultivo con 15 g.l-1 de sacarosa mostraron una actividad muy baja durante la fase de elongación, lo cual está en correspondencia con los valores de fotosíntesis neta observados en la tabla 3. Luego de la salida de las plántulas a las condiciones ex vitro, dicha actividad aumentó durante toda la fase de aclimatización, obteniéndose los mayores valores a los 42 d (Figura 2-B). En este momento de evaluación las plantas provenientes de un medio de cultivo con 1.5 g.l-1 de sacarosa presentaron una actividad de la FEPC similar a la existente a los 21 d en las plántulas con 3.0 g.l -1 de sacarosa.
Esto indica que los procesos de fijación del CO2 a través de la FEPC fueron más eficientes en estas plantas que en las primeras.
En estudios realizados por Sima y Desjardins (2000) se obtuvieron resultados similares a los descritos anteriormente. Con la adición de sacarosa al medio se obtuvieron plantas con un mayor incremento de la actividad de la enzima FEPC.
La mayor actividad de PQ y los bajos valores de la FEPC observados durante los primeros siete días en condiciones ex vitro indican que los procesos catabólicos (respiración) se vieron más favorecidos que los procesos anabólicos (fotosíntesis). Esto pudo estar relacionado con que la PQ y la FEPC compiten por el mismo sustrato (fosfoenol piruvato). Si debido al estrés propiciado por el cambio de condiciones in vitro a ex vitro los procesos glucolíticos estaban ocurriendo en mayor medida para garantizar la obtención de energía en la planta, entonces la fijación de CO2 se pudo haber visto afectada.
- Extracción y medición de la actividad enzimática para la Sacarosa Sintasa (SS) (EC 2.4.1.13) e Invertasa Neutra (IN) (EC 3.2.1.26)
La actividad enzimática de la SS y la IN tuvieron comportamientos muy semejantes. Ambas mostraron un aumento significativo en los primeros siete días de expuestas las plántulas a las condiciones de aclimatización, seguido de un descenso continuo a través de todo el proceso (Figura 3-A y B). La mayor actividad para ambos casos se observó en plántulas sometidas a condiciones mixotróficas.

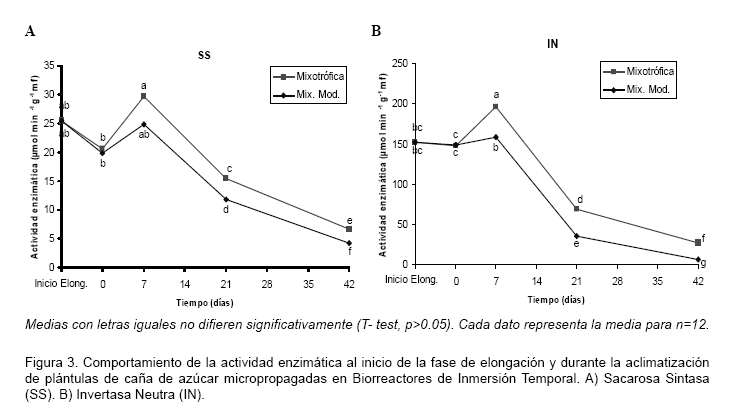
Las plántulas de caña de azúcar provenientes de la fase de elongación, durante los primeros momentos de la aclimatización utilizan las sustancias que han podido almacenar en sus órganos bajo estas condiciones de crecimiento (Rodríguez et al., 2003). Este hecho está en correspondencia con la alta actividad que presentó la enzima SS en los primeros siete días en aclimatización. Esta enzima deja de ser importante cuando las hojas comienzan a adquirir función autotrófica (Albrecht y Mustroph, 2003).
Las hojas de las plantas recién salidas de las condiciones de cultivo in vitro, si se han desarrollado en un medio de cultivo que contiene sacarosa, actúan como órganos de reserva hasta que la planta sea capaz de contar con un aparato estomático desarrollado que le permita realizar fotosíntesis eficientemente. Al existir durante este período una mayor cantidad de sacarosa almacenada la actividad de la SS se hace mayor por su función degradativa, con lo cual se ve favorecida la respiración. Además, en estos primeros siete días es cuando la planta tiene una mayor necesidad de transportar la sacarosa almacenada al resto de los órganos de la planta para garantizar su subsistencia mientras que no pueda tener un desarrollo autotrófico adecuado.
Se ha señalado que la actividad de las enzimas invertasas, al igual que la de la SS, está asociada con la degradación de la sacarosa, fundamentalmente en los órganos de almacenaje (Borroto et al., 2003). Aunque las hojas, como órganos fotosintéticos fundamentales, no necesitan de estas enzimas al ser capaces de abastecerse de fuentes carbonadas por sí solas; durante los primeros días de la aclimatización de las plántulas se requiere de la movilización de este disacárido presente como reserva en las mismas. Este hecho puede explicar la alta actividad de esta enzima en las hojas de las plántulas de caña de azúcar crecidas bajo condiciones mixotróficas, en los primeros días de la fase de aclimatización.
CONCLUSIONES
Las tres condiciones de cultivo in vitro estudiadas mostraron diferentes efectos sobre el comportamiento morfo-fisiológico y bioquímico de plántulas de caña de azúcar propagadas en BIT: la condición de cultivo autotrófica (250 μmol fotones m-2s-1, 1 200 µmol. CO2 mol-1, 0 g.l-1 de sacarosa) no mostró resultados favorables para la supervivencia de las plántulas durante la fase de elongación en BIT. Con la condición de mixotrofismo moderado (80 μmol fotones m-2s-1, 375 µmol CO2 mol-1, 30 g.l-1 de sacarosa) se obtuvieron los mejores resultados morfo-fisiológicos y bioquímicos, tanto en la fase de elongación en BIT como en la fase de aclimatización.
REFERENCIAS
Afreen F, Zobayed SMA, Kozai T (2002) Photoautotrophic culture of Coffea arabusta somatic embryos II: development of a bioreactor for the large-scale plantlet conversion from cotyledonary embryos. Ann. Bot. 9: 20-29
Albrecht G, Mustroph A (2003) Localization of sucrose synthase in wheat roots: increased in situ activity of sucrose synthase correlates with cell wall thickening by cellulose deposition under hypoxia. Planta 217 (2): 252-260
Anguenot R (2003) Protocoles, sucrose synthase. [En-línea][Consultado en enero, 2003]. Disponible en: (http:// www.agrobiotheque.ca/Protocoles/ enzymo/sucrose synthase.html)
Aragón CE, Escalona M, Capote I, Pina D, González-Olmedo J (2005) Plantain (Musa AAB) growth in Temporary Immersion
Bioreactor (TIB) and ex vitro acclimatization. Some aspects of physiology and carbon metabolism. Memorias Congreso Internacional Biotecnología y Agricultura (Bioveg 2005). Ciego de Ávila
Bernal A, Occeguera Z, Jiménez M, Rivera O, García L, Feria M (2002) Use of the Temporary Immersion Systems for sugar cane vitroplants´ production. Biotecnología Vegetal 2(4): 201-206
Borroto J, Blanco MA, Tambara Y, Capdesuñer Y, Golle JL, Balbé A, Rivas M, León A, Hormaza J, Peralta H (2003) Contenido de carbohidratos asociados al crecimiento y desarrollo de cuatro variedades de caña de azúcar (Saccharum sp). Agronomía Costarricense 27(1): 91-100
Castro D, González-Olmedo J (2005) Cultivo mixotrófico de Eucalyptus grandis Hill ex Maiden en Biorreactores de Inmersión Temporal. Memorias Congreso Internacional Biotecnología y Agricultura (Bioveg 2005). Ciego de Ávila
Cejas I, Capote I, Escalona M, Noceda C, Rodríguez R, Cañal MJ, Roels S, Sandoval J y Deberhg P (2005) Protocolo para la proliferación de plátano Musa AAB (CEMSA ¾) con el empleo de Meta-topolina en Biorreactores de Inmersión Temporal. Memorias Congreso Internacional Biotecnología y Agricultura (Bioveg 2005). Ciego de Ávila
Díaz LP, Medina LF, Latife J, Digonzelli PA, Sosa SB (2004) Acclimatation of micropropagation sugarcane plants using the earthworm humus. RIA, 33 (2): 115-128
Escalona M, Cejas I, González-Olmedo J, Capote I, Roels S, Cañal MJ, Rodríguez R, Sandoval J, Debergh P (2003) The effect of meta-topolin on plantain propagation using a Temporary Immersion Bioreactor. INFOMUSA. 12 (2): 28-30
Ferreyra ER, Selles G, Peralta AJ, Burgos RL, Valenzuela BJ (2002) Efectos de la restricción del riego en distintos períodos de desarrollo de la vid cv. Cabernet sauvignon sobre producción y calidad del vino. Agricultura Técnica 62(3): 406-417
Geigenberger P, Stitt M (1991) A futile cycle of sucrose synthesis and degradation is involved in regulating partitioning between sucrose, starch and respiration in cotyledons of germinating Ricinus communis L. seedlings when phloem transport is inhibited. Planta 185: 81-90
Imbert MC (2003) Efecto del estrés hídrico sobre la composición fenólica en bayas y vinos de cv Cabernet
sauvignon. [En-línea][Visitado en septiembre, 2003]. Disponible en: http://hdl.handle.net/1950/835
Le VQ, Lamaze T, Champigny ML (1991) Effect of light and NO3- on wheat leaf phosphoenolpyruvate carboxylase activity. Evidence for covalent modulation of the C3 enzyme. Plant Physiol. 97: 1476-1482
Le VQ, Samsom G, Desjardins Y (2001) Opposite effects of exogenous sucrose on growth, photosynthesis and carbon metabolism of in vitro plantlets of tomato (L. esculentum Mill.) grown under two levels of irradiance and CO2 concentration. Plant. Physiol. 158: 599-605
Lorenzo JC, González B, Escalona M, Teisson C, Espinosa P, Borroto C (1998) Sugarcane shoot formation in an improved temporary immersion system. Plant Cell, Tiss. and Org. Cult. 54(3): 197-200
Miron D, Schaffer AA (1991) Sucrose phosphate synthase, sucrose synthase and invertase activities in developing fruit of Lycopersicon esculentum Mill. Sucrose accumulation Licopersicon hirsutum Humb and Bonpl. Plant Physiol. 95: 623-627
Molina LA, Rodríguez R, Capote I, Huggins C, Pina D, Escalona M, González-Olmedo J (2005) Cultivo fotomixotrófico de la piña (Ananas comosus (L.) Merr.). Memorias Congreso Internacional Biotecnología y Agricultura (Bioveg 2005). Ciego de Ávila
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Plant Physiol. 15: 473-497
Rodríguez R, Cid M, Pina D, González JL, Desjardins Y (2003) Growth and photosynthetic activity during acclimatization of sugarcane plantlets cultived in temporary immersion bioreactors. In vitro Cellular and Development Biology Plant 39(6): 657-662
Siegel G, Stitt M (1990) Partial purification of two forms of spinach leaf sucrose-phosphate synthase which differ in their kinetic properties. Plant Sci. 66: 205-210
Sima BD, Desjardins Y (2000) The long-term effects of sucrose on anaplerotic carbon fixation and carbon nitrogen interaction in vitro Solanum tuberosum L. Acta Hort. 520: 249-262
Copyright (c) 2016 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
