Caracterización de la lámina foliar de plantas
de Agave fourcroydes Lem. obtenidas
por propagación asexual
Characterization of leaf area of Agave fourcroydes Lem. plants obtained from asexual propagation
Maryla Sosa del Castillo1*, Silvia Alemán García1, Yunel Pérez Hernández1, Enildo Abreu Cruz1, Daynet Sosa del Castillo2, Gerardo González Oramas1. *Autora para correspondencia
1Universidad
de Matanzas Camilo Cienfuegos. Autopista a Varadero km 3½. Matanzas. Cuba.e-mail:
maryla.sosa@umcc.cu
2Fundación
Instituto de Estudios Avanzados (IDEA). Carretera Nacional Hoyo de la Puerta.
Baruta. Caracas. 1080 Estado de Miranda. Venezuela.
RESUMEN
El henequén (Agave fourcroydes Lem.) es un cultivo de gran importancia económica. Este trabajo se propuso caracterizar la lámina foliar de plantas de la variedad `Sac Ki' o henequén blanco obtenidas por métodos de propagación asexual. Se emplearon plantas cultivadas in vitro, hijos de bulbillos de plantas in vitro, hijos de rizomas de plantas in vitro, hijos de bulbillos de plantas de campo e hijos de rizomas de plantas de campo. A los 7 y 15 meses de plantadas en vivero se caracterizó la epidermis a través del índice estomático y la densidad estomática. Además, se caracterizaron los haces conductores y paquetes de fibras en el mesófilo de la hoja. Se comprobó que la lámina foliar de plantas de henequén variedad `Sac Ki' obtenidas por diferentes métodos de propagación asexual presentaron estructuras anatómicas similares. Sin embargo, se observó que las plantas cultivadas in vitro se diferenciaron del resto en cuanto al índice estomático y la densidad estomática en los dos momentos de evaluación lo cual sugiere un acomodo a las condiciones ambientales.
Palabras clave: densidad estomática, índice estomático, plantas in vitro
ABSTRACT
The henequen (Agave fourcroydes Lem.) is a crop of great economic importance. This study was aimed to characterize the leaf surface of henequen plants variety `Sac Ki' obtained by asexual propagation methods. In vitro plants, shoots of bulbils of in vitro plants, shoots of rhizomes of in vitro plants, shoots of bulbils of field plants and shoots of field rhizomes were used. At 7 and 15 months after planting in the nursery, the epidermis was characterized through the stomatal index and stomatal density. Moreover, the conductor vessels and fiber bundles in leaf mesophyll, were characterized. It was found that the leaf surface of henequen plants variety `Sac Ki' obtained by different methods of asexual propagation showed similar anatomical structures. However, it was observed that in vitro plants were different from the rest in terms of stomatal index and stomatal density in both time points. It was suggesting a accommodate response to environmental conditions.
Key words: stomatic density, stomatic index, in vitro plants
INTRODUCCIÓN
El henequén Agave fourcroydes Lem. es una especie perenne de propagación vegetativa, altamente productiva en áreas ecológicas limitantes por la escasez de agua y suelo (Garriga et al., 2006). Tiene además alto potencial de uso como fuente de productos naturales como esteroides y detergentes a partir de sus saponinas (González et al., 2003) y celulosa a partir de su fibra (Abreu et al., 2007).
La ampliación de los mercados y las tendencias actuales, entre las que se destaca la conservación del ambiente, ofrecerán nuevos nichos de oportunidades para algunos cultivos. El henequén no es la excepción a esta situación y su futuro dependerá en gran parte de que pueda ser cultivado de manera más eficiente y con mayores beneficios económicos (Garriga et al., 2010).
La propagación del henequén se realiza mediante la reproducción sexual por semillas y asexualmente, por medio de los retoños producidos por los rizomas (hijos basales) y por bulbillos (yemas aéreas encontradas en el escapo floral) (González et al., 2011). Otra forma de propagación asexual es el uso de las técnicas de cultivo in vitro (Robert et al., 1992; Peña et al., 1997; González et al., 2007).
En las plantas obtenidas in vitro se han observado cambios en la anatomía de las hojas, tales como: un reducido desarrollo de la cutícula, cierre estomático anormal (Pospósilová et al., 1999), alta densidad estomática (Santamaría et al., 1995) y ausencia o reducido desarrollo de las células de empalizada (Dami y Hughes, 1995), los cuales conllevan a la incapacidad de las plántulas de controlar las pérdidas de agua después de ser transferidas a condiciones ex vitro. No obstante, en estudios realizados en Agave tequilana (Weber) Santamaría et al. (1995) refirieron que el cultivo in vitro no afectó la capacidad de las hojas de controlar las pérdidas de agua ni alteró la apertura estomática. Los estudios sobre características anatómicas de las hojas de plantas de henequén obtenidas por cultivo in vitro son escasos.
Según Días (1993) las plantas obtenidas a partir de bulbillos e hijos de rizomas de plantas propagadas convencionalmente necesitaron menos tiempo (20 meses) para alcanzar 35- 40 cm de altura (talla para ir a plantación comercial), que las provenientes de plantas cultivadas in vitro (28 meses). Por otra parte Peña et al. (1997) indicaron que el enraizamiento y desarrollo de hijos de rizomas de las plantas propagadas convencionalmente se comportaba de forma lenta. Por ello, todas estas vías de producir plantas de henequén requieren ser evaluadas para su empleo racional.
La transpiración
y la intensidad de la respiración están en razón directa
al número y apertura de los estomas y como las hojas son los principales
órganos de las plantas donde se realiza la fotosíntesis, el número
y distribución de los estomas influye directamente sobre la asimilación
clorofílica. Roth et al. (1986) plantearon que en
los estudios relacionados con la anatomía foliar, se deben considerar
características anatómicas individuales tales como el índice
estomático (IE) y la densidad estomática (DE) pues ambos están
influenciados por las condiciones ambientales y nutricionales.
Teniendo en cuenta estos antecedentes este trabajo se propuso caracterizar la lámina foliar de plantas de henequén obtenidas por métodos de propagación asexual lo cual puede contribuir al conocimiento de sus características en el establecimiento de viveros.
MATERIALES Y MÉTODOS
Esta investigación se desarrolló en el vivero de la Granja La Conchita perteneciente a la Empresa Henequenera de Matanzas Eladio Hernández y en el Centro de Estudios Biotecnológicos de la Universidad de Matanzas Camilo Cienfuegos. La preparación del material vegetal para la microscopía óptica se realizó en los laboratorios del IDEA y el INIA (Venezuela).
Material vegetal
Se utilizaron plantas de henequén de la variedad `Sac Ki' o henequén blanco denominada Línea 4 según evaluación molecular realizada por González et al. (2003), provenientes del banco de germoplasma de la Empresa Henequenera de Matanzas Eladio Hernández. Se conformaron cinco grupos según el origen del material vegetal: plantas cultivadas in vitro (V), hijos de bulbillos de plantas in vitro (BV), hijos de rizomas de plantas in vitro (RV), hijos de bulbillos de plantas de campo (BPC) e hijos de rizomas de plantas de campo (RPC). Las plantas empleadas se caracterizaron por mostrar un adecuado estado fisiológico y fitosanitario. Las plantas in vitro tenían 30 días de aclimatización y un mes en condiciones semi controladas (plena luz solar y riego) en la cual se mantuvieron también las plantas obtenidas a partir de rizomas y bulbillos para garantizar su correcto enraizamiento.
Como sustrato en los canteros se empleó pulpa de henequén descompuesta con 12% (m/m) de materia orgánica hasta una profundidad de 20 cm, donde se plantaron los distintos tipos de material vegetal. Se distribuyeron 400 plantas en cuatro parcelas diferentes, en las cuales se plantaron 20 individuos de cada tipo de material vegetal (100 plantas por parcela). El área estuvo ubicada a 20 msnm. Las evaluaciones se realizaron a los 7 meses periodo en que las plantas deben alcanzar la altura para iniciar su establecimiento en los viveros y a los 15 meses cuando presentan de 40 a 50 cm, para ser llevadas a plantación comercial. De cada planta se seleccionó la primera hoja.
Caracterización de la epidermis
Para la caracterización anatómica de la epidermis se realizaron desprendimientos por la técnica de maceración en hidróxido de potasio al 3.0% (m/v) descrita por Rodés y Collazo (2006), hasta la separación de la epidermis. Para ello se seleccionaron porciones de aproximadamente 1.5 cm2 de la zona central de la hoja más desarrollada en expansión, tanto de la superficie adaxial como abaxial y se evaluaron 10 campos por muestra a cinco hojas de cada tipo de material vegetal. Para la observación se utilizó un microscopio de contraste de fase (Olympus B), a un aumento de 400x y se tomaron microfotografías de las muestras.
El Índice Estomático (IE) se determinó utilizando la fórmula de Salisbury sugerida por Wilkinson (1979):
NE
Índice Estomático
= × 100
NCE + NE
en la cual, NE
es el número de estomas por campo de observación y NCE es el número
de células epidérmicas típicas en el campo de observación.
La Densidad Estomática (DE) se calculó según la siguiente fórmula:
Densidad Estomática = Número estomas por campo
(estomas/ìm2) Área del campo
Dónde:
Área del
campo4 (ìm2) = (Número de divisiones
del diámetro x 10)2
Caracterización de haces conductores y paquetes de fibras en el mesófilo de la hoja
Para el estudio del mesófilo las muestras se fijaron en solución FAA y fueron lavadas con agua destilada previo a realizar cortes transversales de la parte media de la lámina foliar (8 µm), con un micrótomo de congelación (Leica CM 1850) y se montaron en agua: glicerina (v/v), para la obtención de láminas semipermanentes. Por cada tipo de material vegetal se observaron cinco muestras en un microscopio óptico (Leica) con aumento de 400x y las imágenes se capturaron y procesaron con el programa Micrometrics SE Premium.
Los datos fueron procesados según el paquete Statgraphic plus 5.1. Se determinó el ajuste a una Distribución Normal mediante la prueba de Bondad de Ajuste Kolmogorov-Smirnov y la Homogeneidad de Varianza mediante las Pruebas de Bartlett. Se aplicó ANOVA de clasificación simple y la prueba de Duncan para comparación de medias.
RESULTADOS Y DISCUSIÓN
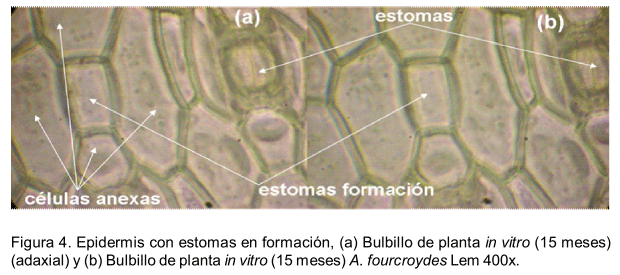
La epidermis en las hojas de los materiales vegetales analizados resultó ser del tipo anfiestomática que presenta estomas tanto por la superficie adaxial como abaxial (Figura 1). Se observaron células epidérmicas típicas de forma poligonal, aparato estomático constituido por cuatro células anexas asociadas a las células oclusivas del tipo tetracítico (Figura 2), con una cámara supraestomática y subestomática similar a la descrita en A. fourcroydes, A. tequilana, A. americana, A. salamina, A. angustifolia y A. victoriana reginae, con paredes celulares engrosadas, de cutícula gruesa característico de especies de ambientes xerófitos como lo es el género Agave (Álvarez de Zaya, 2009). Se observó que se desarrollaban primero las células anexas antes de las oclusivas, aspecto este no referido en los estudios de epidermis para Agavaceae.
La presencia de estomas en ambas epidermis es característico de plantas de ambientes secos (Roth, 1992).
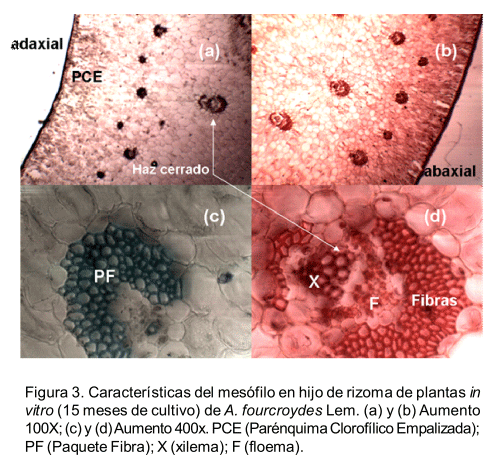
Los cortes transversales al mesófilo (Figura 3) mostraron para todos los tipos de material vegetal una estructura isolateral con parénquima en empalizada por ambas superficies, caracterizada por células alargadas, isodiamétricas, dispuestas transversalmente de manera ordenada, con abundantes cloroplastos y un parénquima lagunar esponjoso con células irregulares, escasos o ausentes cloroplastos y amplios espacios intercelulares. Los haces colaterales se observaron cerrados situados hacia el centro del mesófilo y paquetes de fibras hacia la superficie adaxial en mayor número que hacia la abaxial en disposición de zigzag con respecto a los haces conductores. La epidermis superior e inferior se observó monoestratificada.
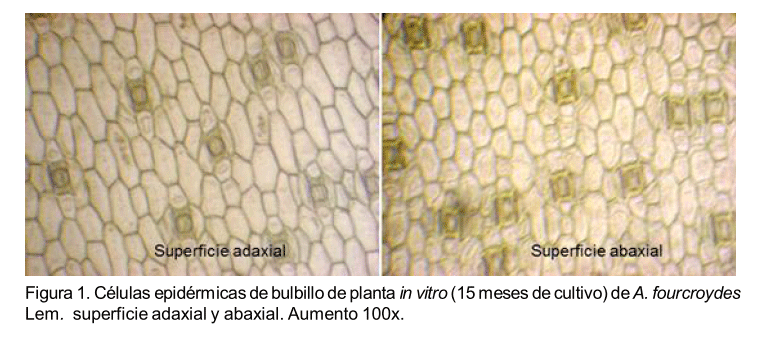
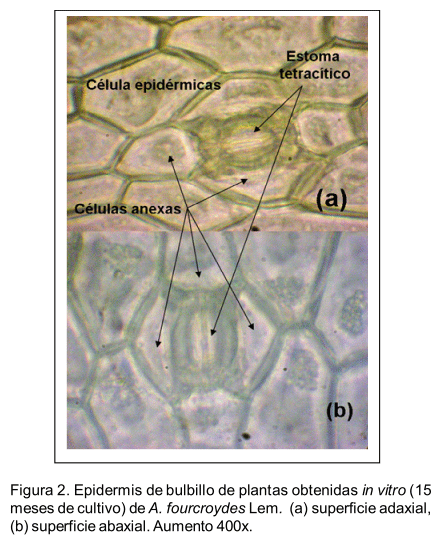
En todos los tipos
de material vegetal se observaron paquetes de fibras en el área floemática,
aspecto característico de esta especie según lo descrito por Macía
(2006). Las fibras están asociadas con los haces conductores donde aparecen
como cordones independientes en el mesófilo formando paquetes de fibras
(Figura 3 c y d).
Una comparación
de ambas superficies de la hoja, entre los diferentes tipos de material vegetal,
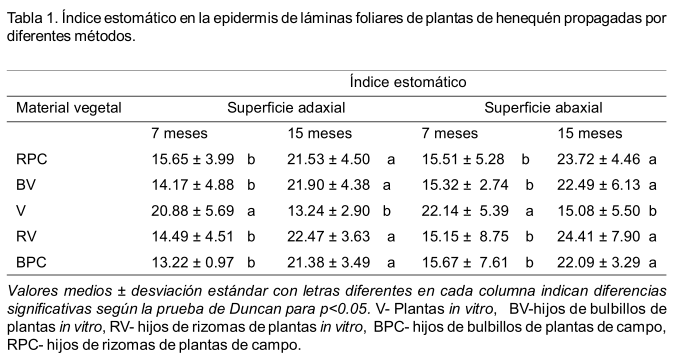
a los 7 meses, mostró un mayor IE (Tabla 1) en plantas in vitro,
valor el cual diferenció significativamente del resto de los tratamientos.
Por otra parte, a los 15 meses de cultivo en ambas superficies se encontró
un incremento del IE excepto para plantas in vitro que fue significativamente
inferior.
En este sentido, Schoch et al. (1980) refirieron que el índice estomático está en función de la radiación recibida y de las variaciones que experimenta durante los días precedentes a la diferenciación de los estomas de la hoja. En tal sentido ello sugiere, que el cambio de condiciones, indujo a la respuesta diferencial de las plantas in vitro que en el lprimer momento de evaluación (7 meses) presentaron el mayor IE y posteriormente (15 meses) el menor valor de IE. Esta variable representa el cociente entre el número de estomas y la cantidad de células epidérmicas por superficie foliar, y puede variar dentro de la misma hoja según la parte del limbo que se analice (ápice, media o base), posición de la hoja en la planta y también del ambiente ecológico, el cual puede ejercer cierta influencia sobre este carácter (Roth et al., 1986).
La evaluación de ambas superficies de la hoja, en los diferentes tipos de material vegetal reveló a los 7 meses, una mayor DE (Tabla 2) en las plantas in vitro, que se diferenció significativamente del resto de los tratamientos. Por otra parte, a los 15 meses en la superficie adaxial se encontró un comportamiento similar al observado para IE. En la superficie abaxial los mayores valores de DE se produjeron en BV y RV los cuales, no se diferenciaron significativamente entre ellos, pero sí del resto. El valor significativamente más bajo se obtuvo en las plantas in vitro.
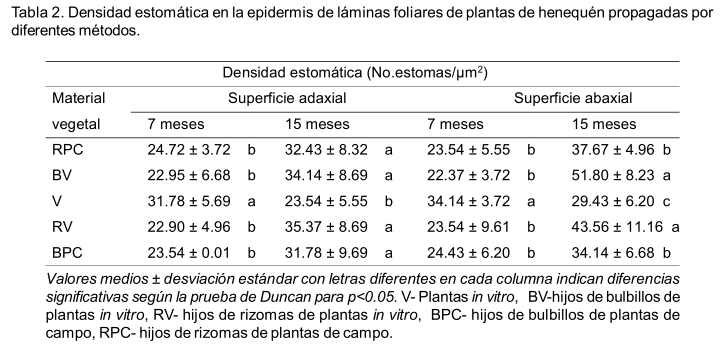
Atendiendo
a los resultados, el origen del material vegetal influyó en el número
de estomas. En las plantas in vitro al proceder de un medio controlado
tanto ambiental, como nutricional se favoreció la presencia de un mayor
número de estomas en la primera etapa evaluada (7 meses). Sin embargo,
posiblemente al no estar totalmente endurecidas, no contar con las reservas
necesarias y sufrir mayor pérdida de agua, se redujo el número
de estomas en ambas superficies para los 15 meses, lo que indica una respuesta
de acomodo de la planta a condiciones adversas para continuar su crecimiento
y desarrollo.
Varios autores han informado valores de densidad estomática para ambas superficies de la hoja en especies de Agave. Por ejemplo, estudios realizados por Arroyo et al. (2008) en diferentes especies de Agave indicaron para A. tequilana, una densidad estomática superior a la observada en este trabajo para A. fourcroydes, tanto por la superficie adaxial (99.55 µm2) como la abaxial (95.33 µm2) pero en plantas cultivadas en campo. Además, observaron que A. americana y A. tequilana presentaron una mayor densidad estomática por la superficie adaxial, no así A. angustifolia, el cual se considera ancestro de A. fourcroydes (Colunga, 1998). Estos autores plantearon que existe una relación entre la densidad estomática y la posición y grado de desarrollo de la lámina foliar. Atendiendo a lo anterior se pudiera considerar que al tiempo de cultivo muestreado (15 meses) las hojas continuaban en expansión. En relación con lo anterior en el análisis histológico se observaron estomas en formación en las superficies adaxial y abaxial de la epidermis, donde se apreció la formación de las cuatro células anexas antes de la formación de las células oclusivas (Figura 4). Estos resultados indicaron la necesidad de aumentar el periodo de evaluación de las plantas en vivero para constatar su completo desarrollo.
Las plantas in vitro a los siete meses de cultivo superaron al resto en las variables evaluadas (índice estomático y densidad estomática) sin embargo, a los 15 meses mostraron los menores valores. Se requieren otros estudios que permitan profundizar en la relación de estas características con las condiciones de cultivo en aclimatización y vivero y la posterior respuesta de las plantas en campo.
CONCLUSIONES
A partir del estudio realizado se comprobó que la lámina foliar de plantas de henequén variedad `Sac Ki' obtenidas por diferentes métodos de propagación asexual (plantas cultivadas in vitro, hijos de bulbillos de plantas in vitro, hijos de rizomas de plantas in vitro, hijos de bulbillos de plantas de campo e hijos de rizomas de plantas de campo) presentaron estructuras anatómicas similares. Sin embargo, se observó que las plantas cultivadas in vitro se diferenciaron del resto en cuanto al índice estomático y la densidad estomática en los dos momentos de evaluación lo cual sugiere un acomodo a las condiciones ambientales.
AGRADECIMIENTOS
Los autores agradecen a Dercy Parra, Carmen Camejo y Tomás Daniel Fariñas del INIA-Miranda, Venezuela, por la colaboración brindada en la realización de los cortes histológicos.
REFERENCIAS
Abreu E, G González, P Rodríguez, R Domech, M Garriga (2007) Evaluación de plantas in vitro de henequén (Agave fourcroydes) durante fase de aclimatización. ITEA- Producción Vegetal 103(2): 65-75
Álvarez de Zaya A (2009) El complejo estomático en la familia Agavaceae II. Epidermis adulta. Feddes Repertorium 101(3-4): 113-134
Arroyo J, F Matías, Espinosa S, Espinoza H, Peña A (2008) Estudio comparativo de las microestructuras foliares en Agaves de importancia económica. [En línea] En: http://www.amemi.org/congreso/BIOLOGIA/RNO3.pdf. Consultado mayo 2010
Colunga, PS (1996) Origen, variación y tendencias evolutivas del henequén (Agave fourcroydes Lem.). Tesis presentada para obtener el grado Científico de Doctora en Ecología. Universidad Nacional Autónoma de Mexico. DF
Dami L, Hughes HG (1995) Leaf anatomic and water loss of in vitro PEG treated Valliant grape. Plant Cell Tissue and Organ Culture 42: 179-184
Días, R (1993) Evaluación de material vegetativo de henequén proveniente de cultivo de tejidos. Plaza. En: Memorias Conferencia Nacional sobre el henequén y la zona henequenera de Yucatán, pp. 161- 164. INIFAP. Mérida
Garriga M, González G, Alemán S (2006) Comportamiento in vitro de la formación de brotes axilares en Agave fourcroydes Lem. Biotecnología Vegetal 6(1): 3-7
Garriga M, González G, Alemán S, Abreu E, Quiroz K, García-González R (2010) Management of auxin-cytokinin interactions to improve the micropropagation protocol of henequen (Agave fourcroydes Lem.). Chilean Journal of Agricultural Research 3: 245-250
Gentry HS, Sauck JR (1978) The stomatal complex in Agave: groups Deserticolae, Campaniflorae, Umbelliflorae. Proc. California Acad Sci 41: 371-387
González G, Alemán S, Abreu E, Figueroa H, Toapanta P, Doam C (2011) Evaluación de la cosecha de plantas seleccionadas de henequén (Agave fourcroydes Lem.) y propagadas in vitro. Revista Ciencia Amazónica 2(2): 13-16
González G, Alemán S, Garriga M, Ortíz R, de la Fe C (2007) Radiosensitivity to gamma rays (60Co) in shoot tips of henequen. Biotecnología Vegetal 7 (2): 115 117
González G, Alemán S, Infante D (2003) Asexual genetic variability in Agave fourcroydes Lem II: selection among individuals in clonally propagated population. Plant Science 165: 595-601
Hernández R, López R, Benavides A (2003) Micromorfologa de la epidermis foliar de Agave tequilana Weber. Agrofaz 3 (2003) 387-396
Lüttge U, Gustafsson MHG, Winter K, Bittrich V (2007) Diversity, Phylogeny and Classification of Clusia. Vol 194, pp. 95-116. Springer Berlin Heidelberg
Macía M J (2006) Las plantas de fibra. En: M Moraes R, B Ollgaard, L P Kvist, F Borchsenius, H Balslev (Eds.). Botánica Económica de los Andes Centrales, pp. 370-384. Universidad Mayor de San Andrés, La Paz
Peña E, González G, Berrillo A, Sosa D, Arteaga M, Rittoles D, Pérez D, Torriente Z (1997) Tecnología para la micropropagación del henequén a gran escala. Rev. Jardín Botánico Nacional 18: 169-176
Pospósilová J, Ticha I, Kadlecek P, Haisel D, Y Plzakova (1999) Acclimatization of micropropagate plants to ex vitro conditions. Biologia Plantarum 42 (4): 481- 497
Robert ML, Herrera JL, Chan JL, Contreras F (1992) Micropropagation of Agave spp. En: JPY Bajaj (Ed.) Biotechnology in Agriculture and Forestry, pp.306 -329. Springer-Verlag. Dordrecht
Rodés G, Collazo O M (2006) Manual de Prácticas de Fotosíntesis 1era ed. Universidad Autónoma de México. México DF
Roth I (1992) Leaf structure: coastal vegetation and mangroves of Venezuela. Gebrüder Borntraeger, Berlin
Roth I, H Lindorf (1986) Morfología y Anatomía foliar de plantas de la Selva Nublada de Rancho Grande. Parque Nacional Henry Pittier. El ambiente físico,ecología general y anatomía vegetal. Fondo Editorial Act. Cient. Venezolana. Caracas
Santamaría JM, Robert ML, Herrera JL (1995) Stomatal physiology of micropropagated CAM plant, Agave tequiliana (Wever). Plant Growth Regulation 16: 211-214
Schoch P, C Zinsou, M Sibí (1980) Dependence of the stomatal index on environmental factors during stomatal differentiation in leaves of Vigna sinensis L. Jour Exp Bot 31(124):1211-1216
Wilkinson H (1979) The plant surface (mainly leaf). En: C Metcalfe, L Chalk (Eds.) Anatomy of the dicotyledons, pp. 97- 165. Vol. I. 2da ed. Clarendon Press, Oxford
Recibido: 18-9-2013
Aceptado:
11-12-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
