ARTÍCULO
ORIGINAL
Caracterización de aislados de Macrophomina phaseolina por su respuesta a diferentes potenciales osmóticos y mediante AFLP
Characterization of Macrophomina phaseolina isolates by their response to different osmotic potentials and AFLP
Bárbara J. Gutiérrez Cedeño1*, Sandy L. Molina Moret2, Yelenys Alvarado-Capó3, Simón Pérez-Martínez2 *Autora para correspondencia
1Laboratorio
de Patología de Semillas, Instituto de Investigaciones Agrícolas
(INIA-CENIAP). Maracay. Venezuela. e-mail: barbaragutierrezc@gmail.com
2Laboratorio
Microbiología, Instituto de Estudios Avanzados (IDEA). Caracas. Venezuela.
3Instituto
de Biotecnología de Plantas (IBP). Universidad Central Marta Abreu de
Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba.
CP 54 830.
RESUMEN
La pudrición carbonosa de Phaseolus vulgaris es causada por el hongo Macrophomina phaseolina, esta enfermedad se asocia a altas temperaturas y estrés hídrico. El presente estudio tuvo como objetivo, caracterizar aislados de M. phaseolina por su respuesta frente a diferentes potenciales osmóticos y mediante AFLP. Se determinó el crecimiento de 11 aislados en agar papa-dextrosa a las 48 y 72h, en un gradiente de potencial osmótico inducido empleando NaCl, así como sus efectos en la germinación de los esclerocios. Se diferenciaron estadísticamente tres grupos hídricos, indicando respuesta diferencial al potencial osmótico y todos los esclerocios que crecieron bajo estas condiciones, germinaron entre las 24 y 48h. Hubo grupos de aislados que fueron tolerantes al déficit hídrico inducido. El genotipado AFLP permitió la formación de cinco grupos genéticos, mostrándose una amplia variabilidad genética. De los nueve iniciadores, CTA-AT mostró un alto grado de confianza en la identificación de genotipos de M. phaseolina y el CAA-AC fue el de menor capacidad discriminatoria. Estos resultados muestran que los aislados de M. phaseolina respondieron diferente al potencial osmótico y son genéticamente diferentes entre ellos. Aunque no hubo una clara correspondencia de los grupos genéticos con los grupos hídricos; estas respuestas son importantes características en la búsqueda de alternativas para el manejo del patosistema en caraota.
Palabras clave: déficit hídrico, marcador molecular, M. phaseolina
ABSTRACT
Charcoal rot of Phaseolus vulgaris is caused by the fungus Macrophomina phaseolina, the disease is associated with high temperature and water stress. The objective of this study was to characterize isolates of M. phaseolina by their response to different osmotic potentials and AFLP. The growth of 11 isolates was determined on potato dextrose agar at 48 and 72 h in a gradient of osmotic potential induced using NaCl as well as their effects on germination of sclerotia. Three water groups were statistically different indicating differential response to osmotic potential and all sclerotia grown under these conditions, germinated between 24 and 48h. There were groups of isolates that were tolerant to water stress induced. The AFLP genotyping allowed the formation of five genetic groups, showing a wide genetic variability. Of the nine starters CTA-AT showed a high degree of confidence in the identification of genotypes of M. phaseolina and CAA-AC had the lowest discriminatory power. These results show that M. phaseolina isolates responded differently to osmotic potential and are genetically different between them. Although there was a clear correspondence of genetic groups to water groups; these responses are important features in the search for alternative management in black bean pathosystem.
Keywords: molecular marker, M. phaseolina, water deficit
INTRODUCCIÓN
En Venezuela las plantas leguminosas representan el aporte proteico de más del 80% para la población, de la cual casi el 60% se cultiva una vez al año en secano, con bajo nivel tecnológico y en explotaciones pequeñas. La pudrición carbonosa causada por Macrophomina phaseolina (Tassi) Goid, se encuentra presente en diferentes zonas productoras de caraota (Phaseolus vulgaris L.), pero difícilmente existen registros de pérdidas o de incidencia de la enfermedad a nivel nacional. De manera general, se señala que la enfermedad puede causar daños entre 10-60% en relación con pérdidas de rendimiento del grano (Abawi y Pastor-Corrales, 1990). Experimentos en campo e invernadero han corroborado esta asociación positiva entre sequía e incidencia de la enfermedad (Díaz-Franco y Cortinas-Escobar, 1988). Posiblemente es debido, a la capacidad del agente causal de incrementar la producción de esclerocios en ambientes con déficit hídrico (Olaya y Abawi, 1996). M. phaseolina infecta plantas de caraota en todos los estados vegetativos de la planta y los daños pueden resultar en un pobre establecimiento de plántulas, muerte pre y post emergente, reducido vigor y baja productividad de plantas adultas (Olaya et al., 1996).
La mayoría de los estudios evidencian que no existe especialización patogénica ni geográfica de M. phaseolina ya sea por métodos tradicionales o de ADN (Gupta et al., 2010). Algunos autores coinciden en informar un alto polimorfismo, pero sin una clara asociación entre el genotipo de este patógeno con el origen geográfico o el hospedante (Linhai et al., 2011). No obstante, Mayek-Pérez et al. (2001) encontraron que los perfiles AFLP de 84 aislados del patógeno tendieron a agruparse por estas variables. Un estudio de este patosistema mostró que, al analizar aislados de México con otros cinco países de tres continentes, el origen geográfico tiene influencia en una posible especialización patogénica (Beas-Fernández et al., 2006), sin embargo esta misma relación no fue destacada al analizar solamente los aislados mexicanos. Otros autores, encontraron buena correlación entre el origen geográfico en la India y marcadores genéticos RAPD (Babu et al., 2010). Al parecer tanto la especialización subespecífica del patógeno por el hospedante o el lugar de origen estaría pendiente de dilucidar.
Por otra parte, el potencial hídrico (Øh) mantiene la presión de turgor de la célula fúngica, la cual es particularmente alta en los apresorios, estructura especializada de los hongos fitopatógenos para penetrar al hospedante. La capacidad de crecer, multiplicarse y reproducirse en bajos Øh pudiera determinar la capacidad de M. phaseolina de desarrollar epifitias de la pudrición carbonosa en condiciones de sequía y altas temperaturas (Olaya y Abawi, 1996). También se ha informado que el bajo Øh influye negativamente en el crecimiento, producción y la germinación de microesclerocios de M. phaseolina (Olaya y Abawi, 1996); así como en las dimensiones, forma y la pigmentación del micelio y los esclerocios (Cervantes-García et al, 2003). Estos últimos autores demostraron que M. phaseolina puede crecer vegetativamente a Øh relativamente bajo, lo que indica que el hongo dispone de mecanismos adaptativos para vivir en condiciones variables tanto del ambiente como de la planta. El Øh depende del potencial osmótico (Øo), el cual representa la presencia de solutos disueltos en el medio. Estos solutos, condicionan a una mayor o menor capacidad del agua de moverse y de su disponibilidad para cualquier organismo.
En Venezuela, las investigaciones sobre M. phaseolina han estado dirigidas a estudiar aspectos de la biología del hongo como el crecimiento in vitro en medios de cultivo (Higuera et al., 2003), o la influencia de la temperatura y humedad (Cardona, 2006). También se ha cuantificado el inóculo e incidencia de la pudrición carbonosa en Sorghum bicolor L. (González et al., 2007) y la distribución vertical de los esclerocios en suelos infestados naturalmente (Cardona, 2006). Recientemente, se informó de la caracterización fenotípica y molecular de aislados de M. phaseolina utilizando la técnica de RAPD, procedentes de una zona productora de ajonjolí (Sesamum indicum L.) (Martínez-Hilders y Laurentin, 2012). Indagar en la variabilidad M. phaseolina combinando marcadores fenotípicos y genéticos en las poblaciones venezolanas del hongo asociadas al cultivo de Phaseolus vulgaris L. contribuiría a direccionar con mayor acierto los programas de mejoramiento genético de la caraota para resistencia a la sequía, y por ende una enfermedad asociada como la pudrición carbonosa. Particularmente, el siguiente estudio tuvo como objetivo caracterizar aislados de M. phaseolina por su respuesta frente a diferentes potenciales osmóticos y mediante AFLP.
MATERIALES Y MÉTODOS
Aislados de M. phaseolina
Se emplearon 11 aislados de cultivos monoesclerócicos a partir de muestras de tejidos vegetales sintomáticos de plantas de caraota, colectadas en fincas productoras de los estados: Aragua (4), Barinas (1) y Portuguesa (6).
Efecto del potencial osmótico (Øo)
Se evaluó la respuesta al Øo inducido con diferentes concentraciones NaCl sobre el crecimiento in vitro del micelio y la germinación de esclerocios de los aislados. Se utilizó un Diseño Completamente Aleatorizado con tres concentraciones de NaCl a saber: 200, 400 y 800 mM, equivalentes a -932, -1 854, -3 728 J kg-1 de Øo y un tratamiento control sin NaCl, según metodología descrita por Cervantes-García et al. (2003). Aplicando esta metodología, se tomaron discos de PDA de 0.4 cm con 5 días de crecimiento fúngico de cada aislado, y se transfirieron a placas Petri con PDA ajustadas a las diferentes concentraciones de NaCl, con tres repeticiones por tratamiento. Las placas fueron selladas con envoltura plástica transparente para minimizar cambios en el Øo del medio de cultivo e incubadas a 28±2°C. Se midió el crecimiento radial de las colonias (cm) y se calculó el porcentaje de inhibición del crecimiento del micelio [PIC= (Crecimiento control Crecimiento tratamiento/Crecimiento control) x 100] en cada tratamiento con respecto al control a las 48 y 72 horas.
Para inducir la formación de esclerocios se utilizó la metodología descrita por Olaya et al. (1996). Para tal efecto, se colocaron palillos estériles sobre las colonias que crecían sobre PDA, estas placas fueron incubadas a 28±2°C en la oscuridad. Los esclerocios formados sobre los palillos entre los 10-15 días de incubación, se desinfectaron con hipoclorito de sodio (1%, 2 min) y posteriormente se lavaron con agua destilada estéril, y se secaron durante 2 días dentro de una campana de flujo laminar. La germinación se evaluó a los 10 días en medio de cultivo PDA.
Caracterización genética de los aislados
Para caracterizar genéticamente los aislados se emplearon marcadores AFLP (del inglés: Amplified fragment lenght polymorphism).
A partir del micelio y siguiendo el protocolo de Vos et al. (1995) modificado por Naranjo et al. (2007) se extrajo el ADN total por cada aislado. En cada caso se tomaron de 250 ng del ADN, la cual fue doblemente digerida en un volumen de reacción de 30 ìl con 5 unidades de MseI y EcoRI, respectivamente, la reacción se incubó durante 3 horas a 37°C. La ligación de adaptadores se realizó utilizando: 1 unidad de T4 DNA ligasa; 1x de tampón de ligación; 50 pmol del adaptador de doble cadena de EcoRI; 5 pmol del de MseI; se incubó a 22°C durante 12 horas; y se diluyó 1/10 en agua bidestilada estéril. Como molde para la preamplificación se utilizaron iniciadores con una base extra en el extremo 3' EcoRI (+A) y Mse I (+C) en 2 ìl de la dilución. La preamplificación se realizó en un volumen final de 20 ìl, utilizando: tampón PCR 1x; 2 mM de MgCl; 30 ng de cada iniciador; 0.5 unidades de Taq polimerasa (Promega Co. Ltd.); y 0.2 mM de cada uno de los dNTP. Las condiciones de amplificación fueron las siguientes: desnaturalización a 94°C/5 min, 24 ciclos de 94ºC/ 30 s; 56ºC/1min; 72ºC/1min, y una fase de extensión a 72ºC/7 min. La reacción de preamplificación fue diluida 1/25, 5 ìl fueron usados como molde para la amplificación selectiva, la cual se realizó en un volumen final de 20 ìl, utilizando: tampón PCR 1x; 2 mM de MgCl; 6.7 ng de iniciador MseI+2; 27,8 ng de iniciador EcoRI+2; 0.5 unidades de Taq polimerasa y 0.2 mM de cada uno de los dNTP. Las condiciones de amplificación fueron las siguientes: desnaturalización a 94°C/5 min, 12 ciclos de 94ºC/ 30 s; 65ºC (-0.7 x ciclo)/30 s; 72ºC/1min y 24 ciclos a 94ºC/ 30 s; 56ºC/30 s; 72ºC/1min. Todas las reacciones se realizaron en un termociclador iCycler (Bio-Rad). Las muestras se concentraron mediante aspiración por vacío en un Speedvac durante 20 min hasta llegar a un volumen de 4 ìl, luego se añadió el mismo volumen de tampón de carga (azul de bromofenol y formamida al 98%). Los productos amplificados se analizaron mediante electroforesis en geles de poliacrilamida al 6% en tampón TBE 1X pH 8.3, mediante comparación con un marcador de peso molecular (1kb plus (Invitrogen)), en una cámara de electroforesis vertical (Sequi-Gen GT Secuencing Cell BIO-RAD) con poder constante de 65 W y fueron visualizados mediante un escáner Typhoon (GE Healthcare). Antes de la corrida el producto de esta PCR fue desnaturalizado a 96°C durante 5 min e inmediatamente se sumergió en hielo. La visualización es posible por los iniciadores ECO RI de la PCR selectiva están marcados en su extremo 5' con el fluorósforo FAM.
Análisis estadístico
Se aplicó análisis de la varianza (ANAVAR) previa comprobación de los supuestos; a los datos de crecimiento radial de las colonias (cm) y porcentaje de inhibición del crecimiento (PIC), respecto al tratamiento control para los diferentes Øo. Las medias se compararon mediante la prueba Duncan. Para los análisis multivariados, se promedió por aislado el porcentaje de inhibición de crecimiento (PIC) en cada concentración de NaCl a las 48 y 72 h, y se obtuvo finalmente, una matriz 11x6. Esta matriz sirvió de insumo para el análisis de conglomerados y de Coordenadas principales (ACoP). A los datos de naturaleza binaria (AFLP) se les aplicaron también Análisis de Conglomerado y ACoP con los métodos y cálculos de las distancias correspondientes. Los detalles de cada análisis se indican al pie de figuras y tablas, en general fueron el método Promedio (Average linkage) y distancia Dice, para los datos binarios y Euclídea para los datos continuos. Se utilizaron los programas InfoStat ver. 2012p e InfoGen.
RESULTADOS
Efecto del potencial osmótico (Øo)
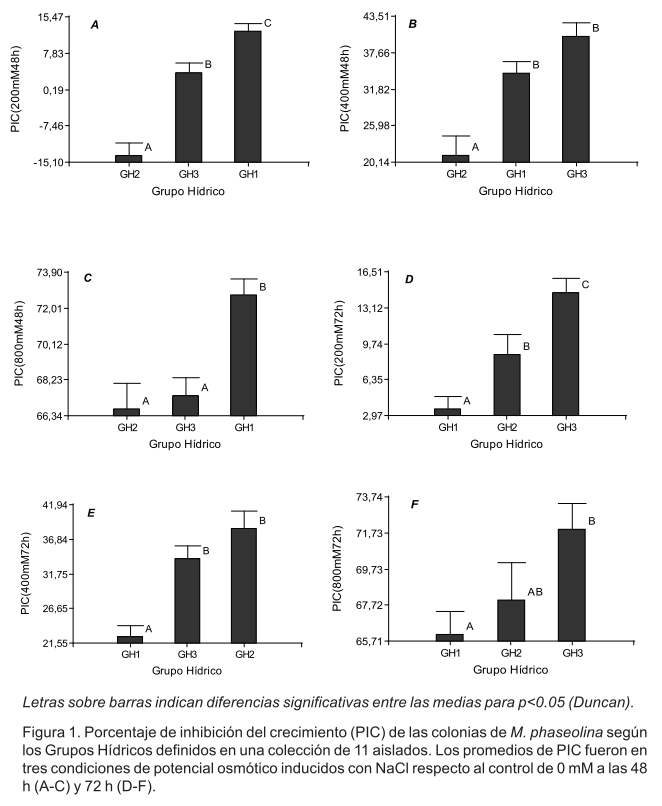
Los esclerocios de los 11 aislados germinaron a las 48 h, independientemente de las variaciones en el Øo a las que fueron sometidos previamente (datos no mostrados). Por el contrario, sí hubo un efecto inhibitorio diferencial en el crecimiento micelial, en función tanto del Øo, como del tiempo de evaluación. Todas estas diferencias individuales de los aislados fueron maximizadas para su representación mediante el análisis de conglomerados (ligamiento promedio, distancias Euclídea), el cual resultó en la formación de tres grupos hídricos denominados GH1, GH2 y GH3. La Figura 1 muestra las diferencias entre los grupos que representan a los 11 aislados analizados.
El perfil respuesta de los grupos hídricos mostró que a las 48h el GH2 tuvo los menores porcentajes de inhibición del crecimiento (Figura 1 A-C), independientemente del Øo. Los dos aislados de este grupo, tuvieron un PIC promedio de 13.71±2.67% al ser comparados con el tratamiento control sin NaCl (datos no mostrados). Este fue el grupo más tolerante al déficit hídrico inducido entre los -932 y los -3 728 J kg-1, con diferencias significativas respecto a los demás grupos. A las 72h de estar bajo las condiciones experimentales el GH1 se comportó como el más resistente al déficit hídrico; es decir, más resistente a los tres potenciales osmóticos (Figura 1 D-F). Al menor Øo las diferencias entre los GH fueron menores (Figura 1 C y F).
En el análisis de componentes principales (ACP), sus dos primeros componentes explicaron el 82.4% de la varianza total (Figura 2), de todas las variables continuas analizadas y su correlación cofenética fue de 0.964. La figura 2, muestra el ordenamiento de los aislados separados por GH y su relación con las variables. Las variables que mayor correlación mostraron con el CP1, aunque de signos contrarios, fueron PIC (800 mM/48 h) y PIC (400 mM/72 h) y fueron las de mayor peso para separar los grupos hídricos. El PIC (400 mM/48h) contribuyó mayormente a separar el GH2 del GH3, aunque estuvo correlacionada al componente principal (CP2) que menos aportó en la explicación de la varianza total. La variable tiempo fue fundamental en la separación de los grupos ya que estuvo asociada con la CP1, a la derecha del biplot se ubicaron las variables medidas a las 72h, y a la izquierda a las 48h, lo cual concuerda con los datos citados anteriormente. El GH1 se separa en la CP1 debido a su respuesta contenida en los PIC a los 800 mM y 200 mM a las 48h. Los GH2 y GH3 fueron más similares en su respuesta a las 72h, al ubicarse a la derecha del gráfico.
Caracterización
genética de los aislados
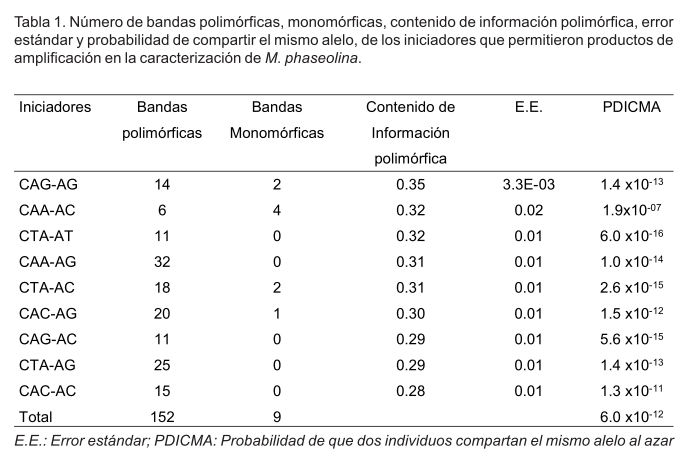
Las nueve combinaciones de iniciadores produjeron un total de 161 bandas de las cuales 152 (93.17%) fueron polimórficas (Tabla 1). Los valores de contenido de información polimórfica fueron obtenidos en los iniciadores CAG-AG, CAA-AC y CTA-AT, que fue más del 50% del rango teórico del contenido de información polimórfica (0.28-0.35) el cual es informativo. La menor probabilidad (6.0 x10-16) de que dos aislados compartan el mismo alelo por iniciador fue encontrada en CTA-AT. Esto indicó que dicho iniciador mostró un alto grado de confianza en la identificación de genotipos de M. phaseolina comparados simultáneamente. El iniciador CAA-AC fue el de menor capacidad discriminatoria con un valor PDICMA de 1.9x10-07. El iniciador GAG-AG aunque tuvo el mayor contenido de información polimórfica (0.35), su capacidad discriminatoria fue intermedia (1.4 x10-13) en comparación con los iniciadores anteriores.

Los perfiles AFLP obtenidos permitieron formar cinco grupos genéticos (GG) mediante el análisis de coordenadas principales (ACP). Las dos primeras dimensiones explicaron más del 50% de la variabilidad total (Figura 3). Además,la primera fue más del doble de la segunda, aspectos sugerentes de la buena calidad de la representación. En los dos primeros grupos existió una correspondencia con el origen geográfico y en el GG3, aislados de Aragua, Barinas y Portuguesa. Por otra parte, no hubo una clara definición en la relación entre los grupos hídricos y genéticos, siendo dispersa la correspondencia entre ellos (Tabla 2). Apoyando esta relación no se obtuvieron diferencias significativas entre el PIC de los aislados de los grupos hídricos, agrupados en función de los grupos genéticos.


Los perfiles AFLP obtenidos permitieron formar cinco grupos genéticos
(GG) mediante el análisis de coordenadas principales (ACP). Las dos primeras
dimensiones explicaron más del 50% de la variabilidad total (Figura 3).
Además, la primera fue más del doble de la segunda, aspectos sugerentes
de la buena calidad de la representación. En los dos primeros grupos
existió una correspondencia con el origen
DISCUSIÓN
Los resultados de este estudio muestran que M. phaselina puede crecer vegetativamente a bajos potenciales hídricos, a partir de diferentes potenciales osmóticos inducidos por NaCl. Hubo diferencias significativas en la respuesta del crecimiento del micelio con potenciales osmóticos entre ~-320 y ~-3 728 J kg-1. Estos resultados fueron similares a los informados por Olaya y Abawi (1996) y Cervantes-García et al. (2003) ya que se redujo el crecimiento radial de M. phaseolina cuando los valores del Øo disminuían (a mayores concentraciones de NaCl); sin embargo, hubo grupos de aislados que fueron tolerantes al déficit hídrico inducido, que mostraron un menor PIC a las 48 h (GH2) y a las 72 h (GH1). Estos aislados pudieran crecer y ajustarse en el tiempo a condiciones de bajo potencial hídrico; y con ello, la mayor posibilidad de tolerar condiciones de poca humedad. Olaya y Abawi (1996), indicaron que los valores mínimos de Øo que permitieron el crecimiento de M. phaseolina fueron entre -9 000 y -1 2000 J kg-1. El límite pudiese estar influenciado por el origen de los aislados y el genotipo, ya que aunque se considera a M. phaseolina una especie con reproducción asexual, existen evidencias de la naturaleza poligénica del micelio y de los esclerocios que incrementan la diversidad intraespecífica (Rayatpanah et al., 2009). Esto apoya las ideas de Abawi y Pastor-Corrales (1990), que señalaron que la capacidad de respuesta diferencial al gradiente del potencial osmótico, pudiera reflejar parte de la habilidad metabólica de los aislados para completar su ciclo de vida con falta de humedad en campo, y por ende, su relación con las epífitas en caraota.
En la formación de los GH de acuerdo con el ACP (Figura 2), donde las variables que mayor peso tuvieron en la separación de los grupos fueron el PIC (800 mM/48 h) y el PIC (400 mM/ 72 h), el tiempo de crecimiento fue también una variable importante, que se correlacionó con los aislados permitiendo la separación de los de Aragua (GH1) y de Portuguesa (GH2 y GH3). También cabe destacar, que la influencia de los diferentes potenciales osmóticos no afectó la germinación de los esclerocios que se produjeron bajo estas condiciones, siendo y capaces de germinar entre las 24 y 48 h después de la siembra en PDA. Similares resultados fueron obtenidos por Olaya y Abawi (1996) quienes refirieron que las condiciones ensayadas relativas a las variaciones de los potenciales osmóticos, no afectaron la estructura y conservación de los esclerocios.
Mediante la caracterización AFLP y el ACP (Fig. 3), se pudieron diferenciar cinco GG de los aislados de M. phaseolina; que evidencian variabilidad genética del hongo. Estudios previos realizados por Martínez-Hilders y Laurentin (2012) también encontraron variabilidad genética del patógeno, con una cantidad de aislados relativamente pequeña y procedente de un solo hospedante. Aunque los GG1 y GG2 estuvieron relacionados con su origen geográfico; esta relación no fue clara en los otros grupos. Estudios anteriores que encontraron un alto grado de diversidad genética, tampoco señalan relaciones claras de los grupos con el origen geográfico (Linhai et al., 2011).
CONCLUSIONES
Los resultados mostraron que los aislados de M. phaseolina respondieron diferente al potencial osmótico y fueron genéticamente diferentes entre ellos, aunque no hubo una clara correspondencia de los grupos genéticos con los grupos hídricos. Por lo tanto, es necesario resaltar la importancia de contar con aislados caracterizados fisiológica y genéticamente, como insumo para ensayos de selección de material vegetal obtenidos por mejoramiento genético, y de esta manera, continuar en la búsqueda de alternativas del manejo del patosistema en caraota.
AGRADECIMIENTOS
Este trabajo fue financiado parcialmente con fondos del Proyecto PEII N° 2012001033 del Ministerio del Poder Popular para la Ciencia, Tecnología e Innovación.
REFERENCIAS
Abawi,
GS, Pastor-Corrales MA (1990) Root Rots of Beans in Latin America and Africa:
Diagnosis, Research Methodologies, and Management Strategies; CIAT. Cali, Colombia
Babu, BK, Reddy
SS, Yadav MK, Sukumar M, Mishra V, Saxena AK, Arora DK (2010) Genetic diversity
of Macrophomina phaseolina isolates from certain agro-climatic regions
of India by using RAPD markers. Indian Journal of Microbiology 50: 199-204
Beas-Fernández, R, De Santiago-De Santiago A, Hernández-Delgado S, Pérez-Mayek N (2006) Characterization of mexican and no-mexican isolates of Macrophomina phaseolina base on morphological characteristics, pathogenicity on bean seeds an endoglucanase genes. J of Plant Pathol. 88: 53-60
Cardona, R (2006) Distribución vertical de esclerocios de Macrophomina phaseolina en un suelo infestado naturalmente en el Estado Portuguesa. Rev Fac Agron. 23: 285-293
Cervantes-García, D, Padilla-Ramírez JS, Simpson J, Mayek-Pérez N (2003) Osmotic potencial effects on in vitro growth, morphology and pathogenicity of Macrophomina phaseolina. J. Phythopathol. 151: 456-462
Díaz-Franco, A. y Cortinas-Escobar H. (1988) Effect of irrigation regimes on susceptibility of beam to Macrophomina phaseolina. Journal Rio Grande Valley Horticultural Society, 41: 4750
González, R, Pineda J, Graterol Y (2007) Cuantificación de inoculo en el suelo e incidencia de Macrophomina phaseolina sobre híbridos de sorgo en tres localidades de los llanos centroccidentales de Venezuela. Rev Fac Agron. (LUZ), 24: 227-241
Gupta, GK, Sharma SSK, Ramteke R. (2012) Biology, Epidemiology and Management of the Pathogenic Fungus Macrophomina phaseolina (Tassi) Goid with Special Reference to Charcoal Rot of Soybean (Glycine max (L.) Merrill). J. of Phytopathol. 160: 167-180
Higuera, A, Fontalvo J, Niño L, Sánchez J, Delgado A, Villalobos R, Montiel M (2003) Crecimiento de Macrophomina phaseolina y Fusarium oxysporum en medios de cultivo de harina de semillas de frijol Vigna unguiculata (L.) Walp., frijol chino Vigna radiata L. y quinchoncho Cajanus cajan (L.) Millsp. Ciencia, 11: 14-21
Linhai, W, Yanxin Z, Donghua L, Junbin H, Wenliang W, Haixia L (2011) Variations in the isolates of Macrophomina phaseolina from sesame in China based on amplified fragment length polymorphism (AFLP) and pathogenicity. African J. of Microbiol. Research. 5: 5584-5590
Martinez-Hilders, A y Laurentin H (2012) Caracterización fenotípica y molecular de Macrophomina phaseolina (Tassi) Goid. proveniente de la zona de producción de ajonjolí en Venezuela. Bioagro, 24(3): 187-196
Mayék-Pérez, N, López-Castañeda C, González-Chavira M, García-Espinosa R, Acosta-Gallegos J, Martínez de la Vega O, Simpson J (2001) Variability of Mexican isolates of Macrophomina phaseolina based on pathogenesis and AFLP genotype; Physiol and Mol Plant Pathol. 59: 257-264
Muñoz-Cabañas, R, Hernández S, Mayek-Pérez N. (2005) Análisis patogénico y genético de Macrophomina phaseolina (Tassi) Goid en diferentes hospedantes. Rev. Mexic. de Fitopatol. 23: 11-18
Naranjo, L, Urbina H, De Sixto A, León V (2007) Isolation of autochthonous non-white rot fungi with potential forenzymatic upgrading of Venezuelan extra-heavy crude oil. Biocatalysis and Biotransformation, 25 (2-4): 341-349
Olaya, G, Abawi GS, Barnard J (1996) Influence of water potential on survival of sclerotia in soil and on colonization of bean stem segments by Macrophomina phaseolina.Plant Dis.80: 1351-1354
Olaya, G and Abawi GS (1996) Effect of water potential on mycelial growth and on production and germination of sclerotia of Macrophomina phaseolina. Plant Dis. 80: 1347-1350
Rayatpanah, S, Nanagulyan SG, Alavi SV, Yasari E, Prof A, Carvil ON, Sinclair JB, Fakrudin B, Researches NR (2009) Phenotypic Variations of Isolates of Macrophomina phaseolina from Different Hosts in Northern Iran. Australian J. of Basic and Appl. Sci. 3: 2908-2913
Vos, P, Hogers R, Bleeker M, Reijans M, Van Delee T, Hornes M, Frijers A, Pot J, Peleman J, Kuiper M, Zabeau M. (1995) AFLP: a new technique for DNA fingerprinting; Nucleic Acids Research, 23: 4407-4414
Recibido: 9-10-2013
Aceptado: 10-12-2013
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
