ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 15, No. 3: 137 - 142, julio - septiembre, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES
Respuesta en campo de plantas in vitro de Dioscorea alata L. clon `Caraqueño' en distintos momentos de plantación
Field response of Dioscorea alata L. clone `Caraqueño' in vitro plants at different times of plantation
Misterbino Borges García1*, Rafael Gómez-Kosky2, Edil Estrada Abeal1, Diana Reyes Avalos3, Bernard Malaurie4, Reisel Destrada Batista5. *Autor para la correspondencia
1Centro
de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas.
Universidad de Granma. Carretera Bayamo-Manzanillo km 17, Apdo 21, Bayamo 85
100, Granma, Cuba. E-mail: mborgesg@udg.co.cu
2Instituto
de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las
Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba.
CP 54 830
3Filial
Universtaria Jiguaní, Jiguaní, Granma, Cuba
4Institut
de Recherche pour le Développement (IRD), UMR DIAPC, F-34 000 Montpellier,
France
5Biofábrica Granma. Carretera a Santiago de Cuba km 5. Bayamo. Granma. Cuba
RESUMEN
La utilización de métodos biotecnológicos del cultivo in vitro de tejidos vegetales para la producción de semilla categorizada de ñame (Dioscorea spp.) ha permitido el incremento de los rendimientos agrícolas de este cultivo. El presente trabajo tuvo como objetivo determinar la respuesta de plantas in vitro de Dioscorea alata L. clon `Caraqueño' en distintos momentos de plantación en campo. Los tratamientos consistieron en la plantación en campo de plantas in vitro previamente aclimatizadas, de junio a noviembre, una vez por mes. Como control se plantaron en junio fragmentos de tubérculos de 125 g de masa fresca. Después de 30 días de cultivo se evaluó en todos los tratamientos la supervivencia de las plantas (%), y en el momento de la cosecha (mes de enero) se tomaron 20 plantas por tratamiento a las cuales se les determinaron las variables agronómicas número de tubérculos por planta, masa fresca de tubérculos por planta (kg), masa fresca del tubérculo (kg) y masa seca de tubérculo (%). Los resultados demostraron que las plantas in vitro alcanzaron altos índices de supervivencia (96.5 a 99.5%), con los mayores valores para el número y masa fresca de tubérculos por planta en los meses de junio a agosto (3.3, 3.1 y 2.9), y junio y julio (3.5 y 3.1 kg) respectivamente en relación con el material vegetal de propagación convencional. Se demostró que las plantas in vitro pueden ser plantadas en campo desde junio hasta noviembre, con la producción de tubérculos que pueden alcanzar la categoría de comercial (junio hasta agosto) y la categoría de semilla básica (septiembre a noviembre).
Palabras clave: Dioscorea alata L., cultivo in vitro, producción de tubérculos
ABSTRACT
The use of biotechnological methods of in vitro plant tissue culture to produce categorized seed yams (Dioscorea spp.) has allowed increased agricultural yields of this crop. This study aimed to determine the response of in vitro plants of Dioscorea alata L. clone `Caraqueño' at different times of planting in the field. The treatments consisted in field planting of previously acclimatized in vitro plants, from June to November, once a month. In June were planted 125 g fresh weight fragments tubers as a control. After 30 days of culture in all the treatments the survival of plants was evaluated and at the time of harvest (January) 20 plants per treatment were taken and determined agronomic variables such us number of tubers per plant, fresh mass of tubers per plant (kg), tuber fresh weight (kg) and tuber dried mass (%). The results showed that the in vitro plants reached high survival rates (96.5 to 99.5%), with higher values for the number and fresh weight of tubers per plant in the months from June to August (3.3, 3.1 and 2.9), and June and July (3.5 and 3.1 kg), respectively in relation to the conventional plant material propagation. It was demonstrated that in vitro plants can be planted in field from June to November, with production of tubers that can reach the category of commercial (June to August) and the category of basic seed (September to November).
Key words: in vitro culture, tubers production, yam
INTRODUCCIÓN
La producción total de ñame (Dioscorea spp.) está distante de cubrir las necesidades de consumo local y de exportación. La escasez y el costo del material vegetal de plantación ha sido el principal problema que ha confrontado la producción de ñame en general (Asare-Bediako et al., 2007).
En Cuba, el cultivo de ñame está más extendido en las zonas montañosas de las regiones central y oriental. En esta última, existe mayor diversidad de especies. En particular, para estas zonas el ñame representa un importante alimento debido a su productividad y la posibilidad de su cultivo en sistemas intensivos y agroforestales (Borges et al., 2009).
La propagación tradicional aumenta el riesgo de propagar material vegetal afectado por plagas y enfermedades. Además, no garantiza los volúmenes de material vegetal de plantación con calidad fisiológica, sanitaria y genética en cortos períodos de tiempo. Por ello, el empleo de técnicas biotecnológicas para producir plantas in vitro y microtubérculos se ha extendido en varios países (Danso et al., 1998; Asare-Bediaco et al., 2007; Balogun et al., 2014).
A partir de 1990, dada la demanda de este tubérculo en Cuba se comenzaron a desarrollar metodologías de propagación in vitro de los principales clones comerciales (De la Cruz et al., 1998; Medero et al., 1999). Posteriormente, se obtuvo una metodología para la conservación in vitro de germoplasma (Borges et al., 2003) y su posterior micropropagación (Borges et al., 2004). Otros trabajos han sido llevado a cabo para la producción de minitubérculos a partir de microtubérculos obtenidos en Sistemas de Inmersión Temporal (Cabrera et al., 2010) y en la optimización de un medio de cultivo para plantas micropropagadas en D. alata (Borges et al., 2011).
En Cuba, Del Sol et al. (1999), Cabrera et al. (2010) y Borges (2011) han evaluado el rendimiento de plantas procedentes de cultivo de tejidos con respecto a plantas propagadas por métodos convencionales en D. alata. El clon 'Caraqueño' tiene gran importancia económica.Conocer la respuesta en campo de plantas in vitro en diferentes momentos de plantación en el año contribuiría al diseño de estrategias para la producción de semilla en el país. Este fue el propósito del presente trabajo.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron plantas in vitro previamente aclimatizadas durante 45 días y fragmentos de tubérculos de la propagación convencional, correspondientes a la especie Dioscorea alata L. clon `Caraqueño' provenientes del banco de germoplasma del Centro de Estudio de Biotecnología Vegetal de la Universidad de Granma.
Respuesta en campo de plantas in vitro aclimatizadas
Las plantas in vitro aclimatizadas se plantaron en campo una vez por mes desde junio a noviembre. Cada momento de plantación constituyó un tratamiento: junio (tratamiento 1), julio (tratamiento 2), agosto (tratamiento 3), septiembre (tratamiento 4), octubre (tratamiento 5), noviembre (tratamiento 6), y como control se plantaron en junio fragmentos de tubérculos de 125 g de masa fresca como material de propagación convencional (tratamiento 7). La cosecha se efectuó en el mes de enero independientemente del mes de plantación.
El diseño experimental utilizado fue un bloque al azar con siete tratamientos y cuatro réplicas en un suelo fluvisol (Hernández et al., 1999) con estacas como tutores. La distancia de plantación fue de 0.9 x 0.5 m. Las parcelas estuvieron formadas por siete hileras de montículos, con 50 plantas cada una.
El riego se realizó mediante sistema Microjet con una frecuencia de cuatro riegos diarios de 20 minutos cada uno a intervalos de 3 horas durante el primer mes, y en el segundo mes se redujo a dos riegos diarios con un intervalo de 6 horas, posteriormente se continuó según MINAG (2008). Las demás atenciones culturales y el control fitosanitario se realizaron según el Instructivo Técnico del Cultivo del Ñame (MINAG, 2008).
Los valores registrados de las variables climáticas fueron: temperatura media de 33 ± 2°C; humedad relativa 60 - 80% y fotoperiodo medio de aproximadamente 13 horas luz.
Se incorporó compost de cachaza descompuesta en el momento de la plantación, a razón de 3 kg por planta. La cosecha se efectuó en el mes de enero.
Al cabo de los 30 días de plantación se evaluó en todos los tratamientos la supervivencia (%), y en el momento de la cosecha (mes de enero) se tomaron 20 plantas por tratamiento a las cuales se les determinaron las variables: número de tubérculos por planta, masa fresca de los tubérculos por planta (kg) y masa fresca del tubérculo (kg). También se determinó la masa seca del tubérculo (%) según procedimiento descrito por Baah et al. (2009).
Análisis estadístico
Se aplicó un análisis de varianza de clasificación doble con prueba de comparación de medias de Tukey previa comprobación de los supuestos de normalidad y homogeneidad de varianzas. Todos los análisis estadísticos se procesaron con el paquete Statistica para WINDOWS, versión 10.0.
RESULTADOS Y DISCUSIÓN
Las plantas in vitro previamente aclimatizadas y plantadas en distintos momentos en campo mostraron altos porcentajes de supervivencia para todos los tratamientos a los 30 días de cultivo sin diferencias significativas (p<0.05) con el control de tubérculos. Se obtuvieron valores de 98.5% de supervivencia en junio, 98.0% en julio, 96.5% en agosto, 98.5% en septiembre, 97.0% en octubre y 96.5% en noviembre, mientras que para el control fue de 99.5%. Esto indicó que las plantas de ñame clon `Caraqueño' procedentes del cultivo in vitro mostraron una respuesta satisfactoria de adaptación en campo en las condiciones experimentales descritas. Ello brinda la posibilidad de contar con material vegetal de buena calidad para su plantación satisfactoria desde junio hasta noviembre.
Autores como Acheampong
(1998) han informado de buenos índices de supervivencia y desarrollo
de las plantas procedentes del cultivo in vitro de D. alata, D. rotundata
y D.
cayenensis durante el transplante a campo. Sin embargo, resultados inferiores
fueron descritos por Danso et al. (1998) quienes lograron 80% de supervivencia
de plantas in vitro aclimatizadas de Dioscorea spp. a los
tres meses de plantadas en campo, mientras que Cabrera et al. (2010),
obtuvieron 86.5% de supervivencia de plantas procedentes del cultivo in vitro
previamente aclimatizadas de D. alata clon `Pacala Duclos' a los 42 días
de plantadas en campo.
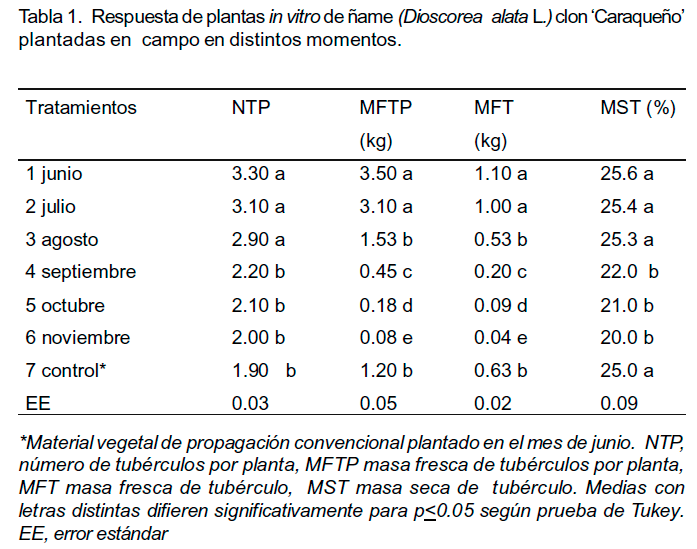
Las variables agronómicas de las plantas procedentes del cultivo in vitro fueron comparables con el control procedente de material vegetal de plantación convencional y se relacionaron con el momento de la plantación (Tabla 1).Se obtuvieron valores significativamente superiores para el número de tubérculos por planta en los tratamientos correspondientes a la plantación en los meses de junio, julio y agosto, con respecto al resto de los tratamientos. En los meses de septiembre, octubre y noviembre no se presentaron diferencias significativas para este indicador en relación con el control.
Los mayores valores significativos (p<0.05) de la masa fresca de tubérculos por planta y masa fresca de tubérculo se alcanzaron en los tratamientos correspondientes a junio y julio.
Estos resultados están en correspondencia con los obtenidos por Del Sol et al. (1999) y Cabrera et al. (2010). Estos autores demostraron la superioridad de plantas de Dioscorea alata procedentes del cultivo in vitro tanto para el número como masa fresca de los tubérculos por planta en relación con plantas propagadas por métodos convencionales, en la época tradicional de plantación de este cultivo (abril a junio).
Los mayores rendimientos agronómicos de las plantas procedentes del cultivo in vitro para los meses de junio y julio con respecto al material vegetal de propagación convencional puede ser debido al efecto de las técnicas de cultivo de tejidos sobre el rejuvenecimiento del material vegetal. En este sentido, Olmos et al. (2004) consideró que el mayor vigor de las plantas procedentes de métodos biotecnológicos puede estar dado por el rejuvenecimiento fisiológico, el no antagonismo con la macro y la microbiota que afecta a la planta en su hábitat natural y el saneamiento que se obtiene a través del cultivo de tejidos, por lo cual se hace difícil separar las tres causas, mientras que Yeung (2005), planteó que el rejuvenecimiento in vitro se produce al perder el tejido la señal que poseía de la planta de origen.
El porcentaje de masa seca de los tubérculos presentó valores significativamente superiores para los tratamientos que comprendieron la plantación de junio a agosto (tratamientos 1-3) sin diferencias significativas con el control (tratamiento 7). El desarrollo vegetativo de las plantas de ñame procedentes del cultivo in vitro y plantadas en campo durante los meses de septiembre, octubre y noviembre no permitió que el tubérculo alcanzara el contenido óptimo de materia seca, a diferencia del resto donde hay un mayor tiempo de cultivo (6-8 meses). En este sentido, Vaillant et al. (2005) informaron que la tuberización en D. alata se produce 12 semanas (3 meses) después del inicio de la brotación de las plantas a partir de estudios sobre el efecto del fotoperíodo sobre el desarrollo de plantas provenientes del cultivo in vitro.
La presente investigación demostró las potencialidades de las plantas procedentes del cultivo in vitro, las cuales alcanzaron una alta supervivencia en condiciones de campo, independientemente del momento de plantación. Como se aprecia en los meses de junio hasta agosto, se obtuvo una producción de tubérculos con valor comercial (0.53-1.1 kg) y de septiembre a noviembre una producción básica (0.04 0.20 kg), que puede ser utilizada para incrementar el material vegetal de propagación de este cultivo, a partir de semilla biotecnológica categorizada (Tabla 1, Figura 1). En este sentido, Ile et al. (2006) plantearon que los tubérculos de ñame tienen una función agrícola doble: primero como alimento, ya que constituyen la principal fuente de alimentación para millones de personas, y segundo como material vegetal de plantación.
Estos resultados son esenciales para diseñar una la estrategia de recuperación del cultivo del ñame, ya que como es conocido una de las limitantes de plantación por la vía convencional es la fecha de siembra, que se enmarca en los meses de marzo hasta junio, período en que se rompe la dormancia del tubérculo. Sobre ello, Ile et al. (2006) al evaluar las fases de dormancia en los tubérculos de ñame (D. rotundata) plantados entre febrero (en el bosque húmedo) y abril (en la sabana de Guinea) en África Occidental señalaron que el crecimiento de los tubérculos es anual cuando se realiza en este periodo, pero que puede estar muy influenciado por el momento de realización de la cosecha, ya que los tubérculos se pueden mantener en dormancia por un período de 30 a 150 días, dependiendo de la fecha de cosecha, especies y condiciones ambientales de crecimiento y almacenaje. Esto conduce en muchos casos a un único ciclo de cultivo por año.
Por otro lado, Ondo et al. (2007) señalaron que entre las limitantes del cultivo del ñame están los problemas fitosanitarios y la falta de material vegetal de plantación de buena calidad, lo que unido al ineficiente método de propagación convencional de plantación disminuyen su producción. En este sentido, plantearon que las técnicas de cultivo in vitro son las que permiten incrementar la multiplicación rápida para la producción de material vegetal libre de patógenos.
Los resultados demostraron que es posible la plantación de ñame en varias épocas del año a partir de plantas in vitro aclimatizadas. Ello permitiría potenciar el incremento de la producción sostenible del cultivo, en particular del clon `Caraqueño', el cual está sometido a un fuerte deterioro genético debido al ataque de plagas y enfermedades que han provocado la disminución de los rendimientos agrícolas en más de un 70% y su desaparición en muchas localidades y áreas cultivadas de la región (Borges et al., 2009) sobre todo en la Sierra Maestra donde es más extendido y cultivado. En relación con ello, Balogun et al. (2014) señalaron que la producción de ñame posee como principales inconvenientes la escasez de semilla sana libre de plagas y enfermedades, y su plantación en suelos de baja fertilidad, aspectos que provocan una pérdida de hasta un 90% de los rendimientos de este cultivo.
CONCLUSIONES
Las plantas in vitro de ñame clon `Caraqueño' aclimatizadas pueden ser plantadas en condiciones de campo desde junio hasta noviembre para obtener tubérculos que pueden alcanzar la categoría de comercial (junio hasta agosto) y la categoría de semilla básica (septiembre a noviembre).
AGRADECIMIENTOS
Esta investigación fue realizada satisfactoriamente gracias al proyecto internacional: Fomento de la agricultura urbana y periurbana para la producción de alimentos en la provincia Granma, República de Cuba financiado por la Diputación Foral de BizKaia y la asociación Euskadi-Cuba.
REFERENCIAS
Acheampong E (1988) Germplasm preservation of tuber crops by tissueculture methods. In The Use of Biotechnology for the Improvement of Cassava, Yams and Plantain in Africa. Meeting Reports Series 2: 17-18
Asare-Bediako E, Y Opoku-Asiama, FA Showemimo, JP Tetteh (2007) Evaluation of different methods and sterilizing sprouting media for in the control of miniset rot of white yam (Dioscorea rotundata Poir). American Journal of Food Technology 2(2): 95-99
Baah FD, B Maziya-Dixon, RA Asiedu, I Oduro, WO Ellis (2009) Nutritional and biochemical composition of D. alata (Dioscorea spp.) tubers. Journal of Food, Agriculture & Environment 7(2): 373 - 378
Balogun MO, N Maroya, R Asediu (2014) Status and prospects for improving yam seed systems using temporary immersion bioreactors. African Journal of Biotechnology 13(15): 1614-1622
Borges M (2011) Caracterización de la diversidad genética de D. alata y producción de plantas in vitro sanas como fuente de semillas. Tesis de Doctorado. Universidad de Antillas y de la Guyana, Guadalupe
Borges M, Y Alarcón, B Malaurie, Y Hernandez, JJ Silva (2009) Conservación in vitro de Dioscorea alata L. clon Caraqueño. Rev. Peru. Biol. 16(2): 20- 25
Borges M, W Ceiro, S Meneses, N Aguilera (2004) Regeneration and multiplication of Dioscorea alata L. germplasm maintained in vitro. Plant Cell, Tissue and Organ Culture 76: 87-90
Borges M, R Destrade, S Meneses, R Gómez, B Malaurie, P Hamon, LC Demenorval (2011) Optimización de un medio de cultivo para plantas micropropagadas de Dioscorea alata L. Revista Colombiana de Biotecnología XIII (2): 221-228
Borges M, S Meneses, J Vazquez, M García (2003) Conservación in vitro de germoplasma de Dioscorea alata L. por crecimiento mínimo. Plant Genetic Resources Newsletter 133: 8-12
Cabrera M, R Gómez, A Rayas, M De Feria, J López, V Medero, M Basail, G Rodríguez, A Santos (2010) Evaluación en campo de plantas de ñame (Dioscorea alata L.) obtenidas de los microtubérculos formados en Sistema de Inmersión Temporal. Rev. Colomb. biotecnol. 12(1): 47-56
Danso KE, HM Amoatey, RK Ahiabu (1998) Improving the tuber size and survival rate of tissue cultured yam (Dioscorea spp.): the effect of age, weaning substrate and nutrients on in vitro plantlets survival during acclimatization. Abstract. 7th Triennal Symposium of the International society for tropical root crops Africa branch (ISTRC AB). Cotonou, Benin
De la Cruz G, M Borges, N Aguilera, G Saborit, M Labrada (1998) Multiplicación acelerada del ñame (Dioscorea alata L.) en condiciones in vitro. Resúmenes. III Encuentro Latinoamericano de Biotecnología Vegetal, La Habana
Del Sol L A, E Espinosa, H Toledo, Y Tores, M Alvarez, J García (1999) Influencia del cultivo in vitro sobre los rendimientos en el clon de ñame Blanco o Pelú (Dioscorea alata L.). Taller Caribeño de Biotecnología vegetal (Biocat 99). Bayamo, Granma
Hernández A, JM Pérez, D Bosch, L Rivero (1999) Nueva versión de clasificación Genética de los Suelos de Cuba. Instituto de Suelos, AGRINFOR, La Habana
Ile EI, PQ Craufurd, NH Battey, R Asiedu (2006) Phases of Dormancy in Yam tubers (Dioscorea rotundata). Annals of Botany 97 (4): 497-504
Medero V, L A Del Sol, M García (1999) Metodología para la propagación del clon de ñame ´Blanco o Pelú´.En: Taller Caribeño de Biotecnología vegetal (Biocat 99). Bayamo, Granma
MINAG (2008) Instructivo Técnico del Cultivo del Ñame. SEDGRI/AGRINFOR. Ciudad de La Habana
Olmos S, G Luciani, E Galdeano (2004) Micropropagación. En: Echenique V, Rubinstein C, Mroginski L (Eds.), Biotecnología y Mejoramiento Vegetal, pp. 163-172. Ediciones INTA, Buenos Aires
Ondo Ovono P, C Kevers, J Dommes (2007) Axillary proliferation and tuberisation of Dioscorea cayenensis D.rotundata complex. Plant Cell. Tiss. Organ. Cult. 91: 107-114
Vaillant V, P Bade, C Constant (2005) Photoperiod affects the growth and development of yam plantlets obtained by in vitro propagation. Biologia Plantarum 49(3): 355-359
Yeung EC (2005) The structural organization of orchid embryos: a functional interpretation. Proc. 17th World Orchid Conference, Natural History Publications, pp. 123-126. Sabah, Malaysia
Recibido: 14-04-2015
Aceptado: 21-07-2015
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.