COMUNICACIÓN CORTA
Biotecnología
Vegetal Vol. 15, No. 3: 181 - 185, julio - septiembre, 2015
ISSN 2074-8647, RNPS: 2154 (Versión electrónica)
Instituto de Biotecnología de las Plantas. UCLV. MES.
Efecto del AIA en el enraizamiento in vitro de Gigantochloa
atter (Hassk.) Kurz.
Effect of IAA on in vitro rooting of Gigantochloa atter (Hassk.) Kurz.
Yudith García-Ramírez*, Marisol Freire-Seijo, Blanca Pérez. *Autora para correspondencia
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara. Cuba. CP 54 830. e-mail: yudith@ ibp.co.cu
RESUMEN
La propagación vegetativa de Gigantochloa atter (Hassk.) Kurz. se dificulta debido a su manejo, transportación y al pobre desarrollo radicular. Las técnicas de cultivo de tejidos permitirían incrementar el número de estas plantas en un corto período de tiempo. Con el objetivo de determinar el efecto del ácido indol acético (AIA) se ensayaron tres concentraciones (15, 20 y 25 mg l-1) en el enraizamiento in vitro y se incluyó un tratamiento control sin regulador del crecimiento. A los 20 días de cultivo se cuantificó el número de plantas con raíces, se midió la altura de las plantas (cm) y el largo de la raíz (cm). Las plantas se transfirieron a fase de aclimatización y después de 20 días de cultivo se determinó la supervivencia. Los resultados demostraron que el AIA influyó en el enraizamiento in vitro de G. atter. Al adicionar al medio de cultivo AIA (20.0 mg l-1) se obtuvieron los mayores porcentajes de formación de raíces (96.0%) y supervivencia ex vitro (60%).
Palabras clave: auxinas, bambú, medio de cultivo líquido, supervivencia ex vitro
ABSTRACT
Vegetative propagation of Gigantochloa atter (Hassk.) Kurz. It is difficult due to their handling, transportation and poor root development. The tissue culture techniques allow increasing the number of these plants in a short period of time. In order to determine the effect of indole acetic acid (IAA) three concentrations (15, 20 and 25 mg l-1) on in vitro rooting were tested and a control without growth regulator it was included. After 20 days of culture the number of plants with roots was quantified, the plant height (cm) and root length (cm) was measured. The plants were transferred to acclimatization phase and after 20 days of culture survival was determined. The results showed that the IAA influenced the in vitro rooting of G. atter. By adding to the culture medium IAA (20.0 mg l-1) the highest percentages of rooting (96.0%) and ex vitro (60%) were obtained survival.
Key words: auxin, bamboo, liquid culture medium, ex vitro survival
INTRODUCCIÓN
Gigantochloa atter (Hassk.) Kurz. es una especie de bambú de gran interés comercial. Su madera es ampliamente utilizada en la construcción, fabricación de muebles, artesanías e instrumentos musicales (Airlangga et al., 2015). Sin embargo, la propagación vegetativa de G. atter por rizomas o culmos se dificulta debido a su manejo y transportación. Por otra parte, las plantas obtenidas por este método no desarrollan un sistema radicular exitoso (Bisht et al., 2010).
La tala indiscriminada
de G. atter debido a su importancia económica ha disminuido las
reservas forestales. Lograr la propagación in vitro vía
organogénesis en esta especie, sería
una alternativa para incrementar el número de plantas en un corto período
de tiempo. No obstante, los protocolos con que se cuenta por esta vía
presentan una serie de limitantes como bajos porcentaje de enraizamiento in
vitro y de supervivencia ex vitro (Saikia et al., 2013).
El empleo de diferentes concentraciones de auxinas podría incrementar la emisión de raíces durante el enraizamiento in vitro de G. atter. En este sentido, autores como Sood et al. (2014) han estudiado el efecto del ácido indol-3-acético (AIA) y han logrado el enraizamiento in vitro en varias especies de bambúes. La presente investigación se desarrolló con el objetivo de determinar el efecto del AIA sobre la fase de enraizamiento in vitro de G. atter.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon plantas in vitro de G. atter en cuarto subcultivo de multiplicación (cada 20 días) en medio de cultivo compuesto por sales MS (Musrashige y Skoog, 1962), mio-inositol 100 mg l-1, sacarosa 20 g l-1, 3.0 mg l-1 de 6-bencilaminopurina y pH 5.8. Como explante se consideró un grupo de tres plantas in vitro con una altura entre cinco y seis centímetros (Figura 1).
Con el fin de determinar el efecto de diferentes concentraciones de AIA en la formación de raíces in vitro, se desarrolló un procedimiento en dos etapas durante 40 días. En la primera etapa, las plantas fueron colocadas en un medio de cultivo líquido compuesto por el 100% de las sales inorgánicas MS (Murashige y Skoog, 1962). Se adicionaron tres concentraciones de AIA (15.0, 20.0 y 25.0 mg l-1) y sacarosa (20.0 g l-1). Se utilizó, además, un tratamiento control con sacarosa (20.0 g l -1) sin regulador del crecimiento. Las plantas se mantuvieron en este medio de cultivo durante 20 días.
Posteriormente, en la segunda etapa, las plantas in vitro de cada tratamiento fueron transferidas a un medio de cultivo líquido compuesto por el 100% de las sales inorgánicas MS y sacarosa (20.0 g l -1), durante 20 días.
Se emplearon un total de 40 explantes de G. atter por cada tratamiento. Estos se distribuyeron a razón de cinco explantes por Erlenmeyer (250 ml de volumen) con 50 ml de medio de cultivo líquido en cada una de las etapas.
Los plantas se colocaron en cámaras de crecimiento con luz solar a 26±2.0 °C, el flujo de fotones fotosintéticos osciló entre 38.0-45.7 ìM m-2s-1.
A los 40 días de cultivo se cuantificó el número de explantes con raíces, además se midió la altura de las plantas (cm) desde la base hasta el punto de inserción de la primera hoja y el largo de la raíz (cm).
Posteriormente, las plantas in vitro con una altura entre 5.0-6.0 cm fueron transferidas a fase de aclimatización. El medio de cultivo se retiró, las plantas se individualizaron y se lavaron con agua destilada. Según su tratamiento se plantaron en bolsas de polietileno negro (5 cm x 10 cm), las cuales contenían un sustrato integrado por compost de cachaza descompuesta y zeolita en proporción 4:1. En la casa de cultivo se redujo la intensidad luminosa mediante una malla de sombreo. Se utilizó un sistema de riego automatizado por microaspersión para evitar los daños por desecación. La frecuencia de riego fue de 2 min de duración cada 20 minutos durante las dos primeras semanas de cultivo, a partir de la tercera semana la frecuencia se incrementó a 40 min. Durante el periodo experimental la temperatura media diaria fue de 30 ± 2 ºC y la humedad relativa del 70%.
A los 20 días se evaluó el número de plantas vivas y se calculó el porcentaje de supervivencia. El experimento fue repetido tres veces y los datos obtenidos fueron el resultado de la evaluación de 90 plantas por cada tratamiento.
Análisis estadístico
Se emplearon pruebas no paramétricas con un valor de significancia de p<0.05, previa comprobación de que los datos no cumplían los supuestos de normalidad y homogeneidad de varianza. Se empleó el programa estadístico SPSS (Statistic Package for Social Science) versión PASW Statistics 18.
RESULTADOS Y DISCUSIÓN
Los resultados indicaron que el AIA tuvo efecto sobre el enraizamiento in vitro de G. atter y que esta auxina estimuló la emisión de raíces.
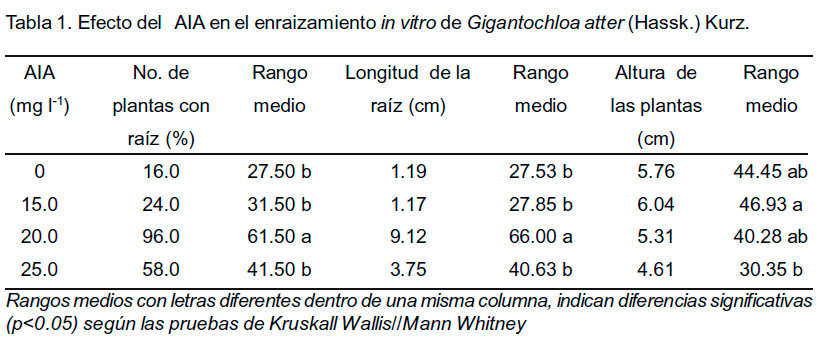
A los 10 días de cultivo se observó la presencia de raíces pequeñas en todos los tratamientos estudiados, independientemente de la concentración de AIA adicionada. Sin embargo, a los 20 días de cultivo se incrementó el número de plantas in vitro con raíces en el medio de cultivo líquido con AIA (Figura 2). Los mayores valores se alcanzaron al emplear 20.0 mg l-1 de AIA, con diferencias significativas respecto al resto de los tratamientos en las variables número de plantas con raíz y longitud de la raíz (Tabla 1).
El papel de las
auxinas en el desarrollo radicular ha sido bien documentado (Kumar et al.,
2014). Este estudio confirmó
resultados previos en otras especies de bambú informados por Bisht et
al. (2010) quienes refirieron el incremento de raíces en brotes de
Gigantochloa atroviolaceae Widjaja y Sharma y Sharma (2011) en
Bambusa balcooa.
En la literatura científica se hace referencia a las bajas tasas de enraizamiento como unas de las principales limitantes durante la propagación in vitro de bambúes (Mudoi et al., 2014). En este sentido, Kavitha y Kiran (2014) estudiaron el efecto de varias auxinas en el enraizamiento in vitro de Dendrocalamus brandisii Kurz, donde demostraron que el AIA tuvo un efecto positivo en la emisión de raíces lo cual coincide con los resultados de este ensayo.
Otros autores como Pratibha y Sarma (2014) emplearon dos etapas para realizar el enraizamiento in vitro de Bambusa nutan y describieron el incremento de raíces emitidas en un medio de cultivo libre de reguladores de crecimiento.
En cuanto a la altura de las plantas no se encontraron diferencias significativas entre los tratamientos desde 0 mg l-1 hasta 20 mg l-1 de AIA y sí entre 15 y 25 mg l-1.
La evaluación de la supervivencia de las plantas de G. atter durante la aclimatización mostró que el incremento de la concentración de AIA afectó el porcentaje de supervivencia ex vitro. La mayor supervivencia se obtuvo en las plantas procedentes del tratamiento con 20.0 de mg l-1 de AIA, con valores de 60%.
Varios autores hacen referencia al efecto del genotipo dependiente en diferentes especies de bambúes, ya que las concentraciones de reguladores del crecimiento varían en función de la especie (Wei et al., 2015). El empleo de AIA en la primera etapa y posteriormente el empleo del medio de cultivo MS libre de reguladores del crecimiento en la segunda etapa del enraizamiento in vitro estimuló la emisión de raíces in vitro en G. atter. Sin embargo, en otras especies como B. vulgaris se ha empleado el ácido indolbutírico en el enraizamiento in vitro con resultados satisfactorios.
Los resultados permiten seleccionar la concentración de 20.0 mg l-1 de AIA para el enraizamiento de plantas in vitro de G. atter, con lo cual se logró un incremento del número de plantas con raíces emitidas (96.0%) y 60% de supervivencia en la fase de aclimatización.
REFERENCIAS
Airlangga H, Safitri E, Arfarita N (2015) Observasi efek ekstrak etanol daun bambu jawa (Gigantochloa atter Hassk. Kurz) dengan parameter fisik dan fisiologi hewan uji tikus (Rattus sp.) yang diinduksi boraks. El-Hayah 5: 83-88
Bisht P, Pant M, Kant A (2010) In vitro propagation of Gigantochloa atroviolaceae Widjaja through nodal explants. J Am Sci 6: 1019-1026
Kavitha B, S Kiran (2014) An Efficient Technique for in vitro propagation of Dendrocalamus Brandisii Kurz using Nodal Segments. Global Journal of Microbiology and Biotechnology 2: 1-10
Kumar V, Banerjee M (2014) Albino Regenerants proliferation of Dendrocalamus asper in vitro. World Journal of Agricultural Sciences 10: 09-13
Mudoi K D, Saikia S P, Borthakur M (2014) Effect of nodal positions, seasonal variations, shoot clump and growth regulators on micropropagation of commercially important bamboo, Bambusa nutans Wall. ex. Munro. African Journal of Biotechnology 13: 1961-1972
Murashigue T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol. Plant 15: 473-497
Pratibha S, Sarma K (2014) In vitro propagation of Bambusa nutan in commercial scale in assam, India. Journal of Environmental Research and Development 9: 348
Saikia S P, Goswami A, Gogoi A, Bora D, Borthakur M (2013) Micropropagation of important bamboos: a review. African Journal of Biotechnology 12(20): 2770-2785
Sharma P, K Sarma (2011) In vitro propagation of Bambusa balcooa for a better environment. Proceedings of the International Conferences on Advances in Biotechnology and pharmaceutical Sciences (ICABPS'11), Bangkok
Sood A, Nadha H K, Sood S, Walia S, Parkash O (2014) Large scale propagation of an exotic edible bamboo, Phyllostachys pubescens Mazel ex H. De Lehale (Moso Bamboo) using seeds. Indian Journal of Experimental Biology 52: 755-758
Wei Q, Cao J, Qian W, Xu M, Li Z, Ding Y (2015) Establishment of an efficient micropropagation and callus regeneration system from the axillary buds of Bambusa ventricosa. Plant Cell, Tissue and Organ Culture 122: 1-8
Recibido: 15-01-2015
Aceptado:
05-05-2015
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.