Artículo original
Biotecnología Vegetal Vol. 16, No. 1: 21 - 29, enero - marzo, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del tiempo de cultivo y volumen de medio de cultivo por explante en la multiplicación de Gerbera jamesonii en Sistemas de Inmersión Temporal
Effect of culture time and culture medium volume per explant on Gerbera jamesonii multiplication in Temporary Immersion System
Osbel Mosqueda Frometa, Maritza M Escalona Morgado, Marcos A Daquinta Gradaille
Centro de Bioplantas, Universidad de Ciego de Ávila. Carretera a Morón, km 9. Ciego de Ávila. Ciego de Ávila. Cuba. CP 69450. e-mail: osbel71@gmail.com
RESUMEN
En la industria florícola mundial, Gerbera jamesonii Bolus ex Hooker f. se encuentra entre las diez plantas de flor de corte más comercializada. La especie puede propagarse a través de semillas, de forma vegetativa y mediante técnicas biotecnológicas. Esta última es la más utilizada. Con el objetivo de determinar el efecto del tiempo de cultivo y el volumen de medio de cultivo en la multiplicación in vitro de gerbera en Sistemas de Inmersión temporal se realizó este trabajo. Se compararon cuatro tiempos de cultivo (14, 21, 28 y 35 días) y tres variantes de volumen de medio de cultivo por explante (20, 30 y 40 ml). Se utilizó una frecuencia de inmersión cada 8 horas con ventilación adicional y como inóculo agregados de tres brotes. Se comprobó que las dos variables estudiadas influyen en la multiplicación de gerbera en SIT. Con 28 y 35 días de cultivo los brotes de gerbera mostraron mejor calidad morfo-fisiológica y mayor número de brotes por explante. El uso de 40 ml de medio de cultivo por explante incrementó el número de brotes, la masa fresca y el contenido de agua de los explantes.
Palabras clave: flor de corte, frecuencia de inmersión, micropropagación
ABSTRACT
In the world flower industry, Gerbera jamesonii Bolus ex Hooker f. is among the ten plants of cut flower more commercialized. The species can be propagated through seeds, vegetative and through biotechnological techniques. The latter is the most used. In order to determine the effect of culture time and volume of culture medium on the in vitro multiplication of gerbera in Temporary Immersion Systems, this work was performed. Four culture times (14, 21, 28 and 35 days) and three volume variants of culture medium per explant (20, 30 and 40 ml) were compared. A frequency of immersion was used every 8 hours with additional ventilation and as inoculum aggregates of three shoots. It was verified that the two studied variables influence the multiplication of gerbera in TIS. With 28 and 35 days of culture the gerbera shoots showed better morpho-physiological quality and a higher number of shoots per explant. The use of 40 ml culture medium per explant increased the number of shoots, fresh mass and water content of the explants.
Keywords: cut flower, immersion frequency, micropropagation
INTRODUCCIÓN
Gerbera jamesonii Bolus ex Hooker f. es una importante planta de flor de corte en la industria florícola global (Kanwar y Kumar, 2008). En los últimos años ha tenido un gran desarrollo en Europa occidental, donde se destaca a Holanda con extensos cultivos en invernadero (Bhatia et al., 2011). Su importancia económica está en que es una de las flores de corte que más se utiliza porque crece y se adapta a condiciones diferentes en varias áreas del mundo. Por sus atractivas flores debido a su gran rango de colores, es muy utilizada en arreglos florales.
La gerbera puede ser propagada por semilla, el problema de este método radica en el alto nivel de heterocigosis. El mercado de flor de corte se afecta por este problema, el cual requiere de una floración coordinada (Ludwing et al., 2010). También se puede reproducir por propagación vegetativa con el empleo de estacas de tallo o división del rizoma. Una de las principales debilidades de este método es la baja tasa de multiplicación que se alcanza (Son et al., 2011).
La propagación in vitro es la vía más utilizada. Se han obtenidos resultados satisfactorios en la propagación rápida de germoplasma élite con alta fidelidad genética (Kanwar y Kumar, 2008; Cardoso y Teixeira, 2013). La micropropagación de brotes de gerbera se ha establecido a partir de diferentes tipos de explantes que incluyen el cultivo de ápices meristemáticos (Cardoso y Teixeira, 2012), yemas axilares, hojas, peciolos, yemas florales, capítulo floral y óvulos (Cardoso y Teixeira, 2013).
Los bajos coeficientes de multiplicación que posee esta planta, el alto costo por mano de obra y la escasa posibilidad de automatización que presentan los protocolos de micropropagación hace necesaria la búsqueda de nuevas tecnologías asociadas con la semi-automatización del proceso. En este sentido, el desarrollo de protocolos con la técnica de inmersión temporal se utilizan con éxito en la micropropagación de especies ornamentales (Watt, 2012), de interés económico (Wilken et al., 2014) y leñosas (Akdemir et al., 2014). Sin embargo, hasta el momento, no se tiene información sobre el uso de la inmersión temporal para la propagación de Gerbera, aunque existen informes en otras plantas de la familia Asteraceae, como son Chrysanthemum sp. (Hahn y Paek, 2005) y Stevia rebaudiana (Bertoni) Bertoni (Alvarenga y Salazar, 2015).
Por la alta demanda en el mercado florícola mundial y el escaso material vegetal de propagación que tiene gerbera, se hace necesaria la introducción de técnicas de micropropagación más eficientes. Reducir los costos y aumentar la cantidad y calidad de los brotes en este proceso es imprescindible. El objetivo del presente trabajo fue determinar el efecto del tiempo de cultivo y el volumen de medio de cultivo en la multiplicación in vitro de Gerbera jamesonii en Sistemas de Inmersión Temporal (SIT).
MATERIALES Y MÉTODOS
Todos los experimentos se desarrollaron en el Laboratorio de Cultivo de Células y Tejidos del Centro de Bioplantas de la Universidad de Ciego de Ávila.
Material vegetal
Como material vegetal se utilizaron brotes de Gerbera jamesonii variedad E-5 procedentes del Laboratorio Comercial VITROALMA, México. Para el crecimiento del material vegetal previo a la inoculación en el SIT, se procedió a su subcultivo cada 21 días en medio de cultivo semisólido. Como explantes se utilizaron agregados con tres brotes cada uno.
Para la multiplicación de los brotes se empleó el medio de cultivo líquido MS (Murashige y Skoog, 1962) modificado, con reducción de los nitratos a la mitad, al que se adicionó nitrato de calcio 800 mg l-1, bencil adenina (BA) 1.0 mg l-1, ácido naftalen acético (ANA) 0.5 mg l-1, sacarosa: 30 g l-1, mio-inositol 100 mg l-1, Tiamina 0.4 mg l-1, Piridoxina 0.5 mg l-1, ácido nicotínico 0.5 mg l-1, glicina 2.0 mg l-1. En los medios de cultivo semisólido se utilizó agar (BIOCEN) 6.6 g l-1. El pH de los medios de cultivo se ajustó a 5.7 previo a la esterilización en autoclave (LDZX - 75KBS) a 1.2 kg cm-2. El tiempo de esterilización que se empleó fue de 20 y 40 minutos para medio de cultivo semisólido (25 ml) y los SIT (800 ml), respectivamente.
El cultivo se expuso a la luz blanca fluorescente (25-30 µmol m-2 s-1) a 25 ± 2ºC y un fotoperiodo de 16 horas de luz 8 horas de oscuridad.
Se trabajó con el Sistema de Inmersión Temporal (SIT) diseñado por Escalona et al. (1999). Este constó de dos frascos de vidrio de 1000 ml de capacidad, unidos entre sí por mangueras de silicona, compuesto además por un compresor de aire, electroválvulas y una válvula reguladora. Se utilizaron tres SIT por tratamiento con 20 agregados cada uno, cada agregado cuenta con tres brotes unidos.
Efecto del tiempo de cultivo
Para establecer el tiempo de multiplicación en el SIT se diseñó un experimento monofactorial con los siguientes tiempos de cultivo: 14, 21, 28 y 35 días. La frecuencia de inmersión fue de cada ocho horas, con ventilación adicional de un minuto cada dos horas y un tiempo de inmersión de cuatro minutos. Se utilizaron 20 ml de medio de cultivo por explante.
Efecto del volumen de medio de cultivo
Con el objetivo de determinar el efecto del volumen de medio de cultivo en el SIT, se diseñó un experimento donde se ensayaron: 20, 30 y 40 ml por explante, equivalente a 400, 600 y 800 ml de medio de cultivo en el SIT. La frecuencia de inmersión fue de cada 8 horas, con ventilación adicional de un minuto cada dos horas, tiempo de inmersión de 4 minutos y 28 días de cultivo.
Evaluaciones
Las evaluaciones realizadas para la fase de multiplicación fueron: número de brotes por explante inoculado, longitud de los brotes (cm), número de hojas por brote, masa fresca (g) y masa seca (g) de los brotes. Esta última se obtuvo pesando las plantas inicialmente, después se secaron por 72 horas en una estufa de calor seco a una temperatura de 60 oC. El contenido de agua de los brotes se determinó por la siguiente fórmula y se expresó en porcentaje: CA brotes=(MF-MS)/MF*100
Análisis estadístico
En el procesamiento estadístico de los datos se utilizó el SPSS (Versión 11.5 para Windows, SPSS Inc.). Se comprobó el ajuste a la distribución normal de los datos de cada tratamiento (Kolmogorov-Smirnov) y la homogeneidad de las varianzas (Levene). Se realizó el análisis de varianza (ANOVA) y prueba de rangos múltiples de Tukey para valores de p<0.05. En algunos casos fue necesaria la transformación de los datos para lograr los supuestos de las pruebas paramétricas realizadas las cuales aparecen descritas en los pie de las figuras y tablas.
RESULTADOS Y DISCUSIÓN
Efecto del tiempo de cultivo
El número de brotes por explante se incrementó en correspondencia con el aumento del tiempo de cultivo. Los mayores valores se encontraron a los 28 y 35 días, sin diferencias significativas entre ellos. Sin embargo, este último tampoco tuvo diferencia con respecto a los 21 días. A los 14 días se obtuvo el menor número de brotes (Figura 1).
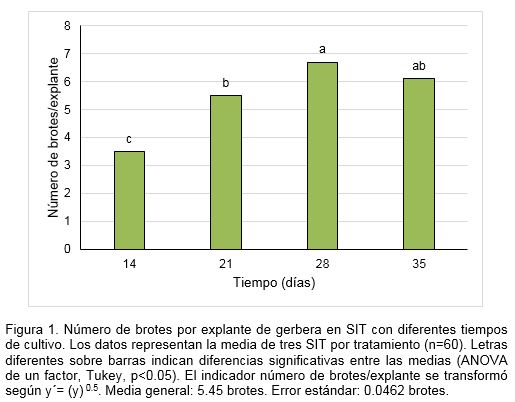
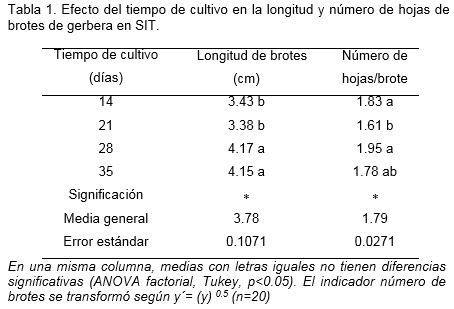
En los indicadores morfológicos, los brotes con mayor longitud se obtuvieron a los 28 y 35 días de cultivo, con diferencias significativas con el resto de los tratamientos. El número de hojas de los brotes, no tuvo diferencias entre 14, 28 y 35 días de cultivo, aunque este último tratamiento no tuvo diferencias con respecto al tratamiento de 21 días (Tabla 1).
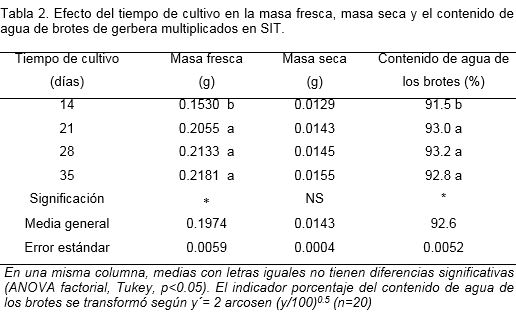
El incremento del tiempo de cultivo no produjo un aumento de la masa fresca y el contenido de agua. A partir de los 21 días de cultivo, estas variables mantuvieron una tendencia similar, y los valores oscilaron entre 0.1530- 0.2181 para la MF y de 91.5-93.2 para el contenido de agua. En cuanto a la masa seca no se encontraron diferencias significativas entre los diferentes tratamientos (Tabla 2).
Se observó que la duración del tiempo de cultivo es un factor que tiene influencia en el aumento del coeficiente de multiplicación y la calidad de los brotes durante la fase de multiplicación en SIT. En la micropropagación convencional (semisólido y líquido) esta fase se prolonga entre 21–45 días en dependencia de la especie. Generalmente el subcultivo se realiza por agotamiento de los nutrientes en el medio de cultivo cuando este se encuentra todavía en la fase exponencial de la morfogénesis, es por ello que evaluar la influencia de este factor en la multiplicación de los brotes es importante para mejorar la eficiencia de la micropropagación (Escalona, 2006).
Los resultados de este estudio concuerdan con los informados en otros cultivos. Autores como Díaz y Castro (2011) en el cultivo de bananos en SIT informaron un aumento del coeficiente de multiplicación con la duración del periodo de cultivo. El mayor coeficiente de multiplicación se logró a los 50 días de cultivo. Resultados similares describieron Basail et al. (2013) para plátano cultivar ‘INIVIT PV-2011’ donde a partir de los 18 días se mantuvo estable este indicador con valores de 8.15. También, en Psidium guajava L. este factor fue determinante en el aumento del coeficiente de multiplicación y calidad morfológica de los brotes cultivados en SIT (Nápoles et al., 2015).
Por su parte trabajando con Chrysanthemun Hahn y Paek (2005) lograron aumentar el número y longitud de los brotes, con incremento en el coeficiente de proliferación respecto a la micropropagación en medio de cultivo semisólido.
En la micropropagación cuando se prolonga el tiempo de formación de brotes, generalmente se provoca un incremento en la multiplicación, debido entre otros factores a un aumento en los niveles de citoquininas endógenas. Este regulador se acumula sólo en forma de sus conjugados, y estimula la proliferación de los brotes (Blakesley y Constantine, 1992). Aspecto este que pudiera explicar el aumento en el número de brotes de gerbera en los SIT en correspondencia con la duración del tiempo de cultivo.
La prolongación del tiempo de cultivo también favoreció la calidad morfológica de los brotes, a partir de los 28 días se observaron brotes más largos y con mayor número de hojas. De igual forma, aumentó la masa fresca de los brotes, lo que estuvo muy relacionado con un incremento en el contenido de agua (Tabla 2). Sin embargo, al evaluar la apariencia de los brotes en su morfología no se encontraron hiperhídricos. Este resultado, en un futuro, debiera ser confirmado a través de determinaciones anatómicas, bioquímicas y fisiológicas. Los brotes a los 35 días de cultivo mostraron una ligera pérdida de coloración (Figura 2), esto pudo deberse al agotamiento de los nutrientes en el medio de cultivo, o tal vez a pérdida de clorofila, aspecto este que soporta la necesidad de otro tipo de evaluaciones. En Bambusa vulgaris el alto contenido de agua de los brotes en cultivos líquidos estáticos provocó disminución de la concentración de fenoles totales, el contenido de ligninas y de clorofilas (García-Ramírez et al., 2014).
A partir de estos resultados se seleccionó 28 días como el tiempo de cultivo adecuado para la multiplicación in vitro de la gerbera en SIT.

Efecto del volumen de medio de cultivo
Durante la fase de multiplicación de los brotes de gerbera en SIT, el volumen de medio de cultivo tuvo influencia en el número de brotes por explante. El volumen de 40 ml /explante incrementó este indicador con diferencias significativas con el resto de los tratamientos (Figura 3A).
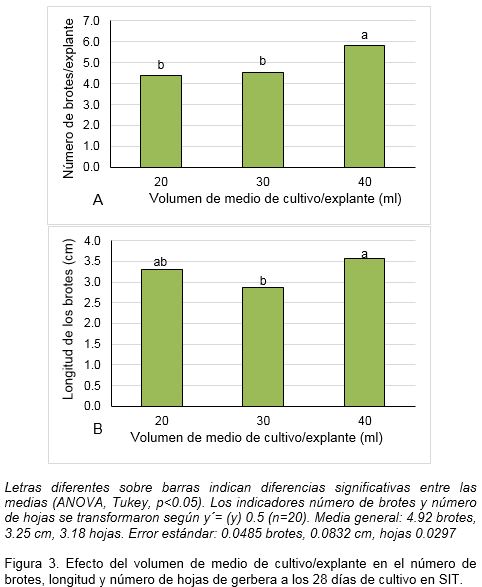
En cuanto a la longitud, los brotes mayores se presentaron en los tratamientos de 20 y 40 ml/explante sin diferencias significativas entre ellos y sí entre el de 30 y 40 ml/explante (Figura 3B). No se encontraron diferencias significativas en el número de hojas/brote en los diferentes volúmenes de medio de cultivo que se ensayaron.
Al analizar los indicadores fisiológicos de calidad de los brotes no se encontró un aumento proporcional en función del volumen de medio de cultivo como era esperado. El mayor valor de masa fresca se encontró con el volumen 40 ml/explante con diferencias significativas con el resto de los tratamientos (Tabla 3). La masa fresca y el contenido de agua fueron significativamente menores en el volumen de 30 ml de medio de cultivo/explante. En cuanto a la masa seca de los brotes, no se encontraron diferencias significativas entre los diferentes tratamientos y el contenido de agua de los brotes fue significativamente mayor en el volumen de 40 ml/explante (Tabla 3).
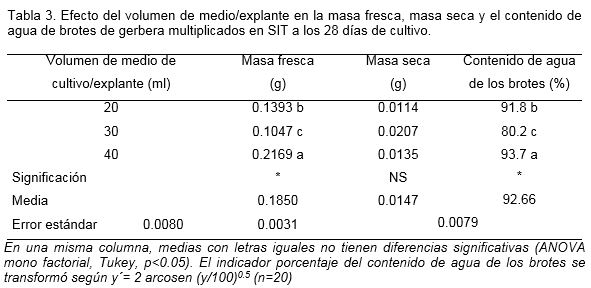
El volumen de medio de cultivo es un factor que en la propagación in vitro permite mejorar la morfogénesis e indicadores de calidad de los brotes. Emplear una relación adecuada medio de cultivo por explante, generalmente conlleva a un aumento en el número de brotes y a un mejor desarrollo de los mismos, teniendo en cuenta que existe una mayor disponibilidad de los nutrientes, para que estos puedan desarrollarse adecuadamente (Escalona, 2006).
Este factor debe ser optimizado cuando se emplean Sistemas de Inmersión Temporal, es un aspecto a tener en cuenta para una mayor multiplicación según Etienne y Berthouly (2002) y Georgiev et al. (2014). Lorenzo et al. (1998) determinaron un volumen óptimo de 50.0 ml/explante para la proliferación de los brotes de caña de azúcar en el SIT con incrementos en el coeficiente de multiplicación a los 30 días de cultivo. Escalona et al. (1999) determinaron un volumen óptimo de 200 ml/explante en la proliferación de piña (Ananas comusus L.). En otros cultivos como el plátano (Musa spp.), Roels et al. (2005) informaron que el volumen de 30 ml/explante aumentó no solo el coeficiente de multiplicación (13.8 brotes/explante) sino los indicadores morfológicos de calidad como la altura, número de hojas y número de raíces de los brotes. En bananos (Musa spp.), Basail et al. (2012) con 50 ml/explante incrementaron el coeficiente de multiplicación (11.82) así como el diámetro del pseudotallo (0.99 cm) y el número de hojas (3.03) de los brotes.
Resultados similares a los descritos anteriormente se encontraron en la multiplicación de gerbera con el empleo de 40 ml de medio de cultivo/explante donde no solo aumentó el número de brotes sino masa fresca y contenido de agua (Figura 4). El efecto de este factor en la multiplicación y calidad de los brotes en el SIT, debe estar relacionado con la cantidad de nutrientes que aporta. El contenido de nutrientes en el medio de cultivo puede variar debido a cambios en la concentración o por cambios en el volumen de medio a una concentración fija de nutrientes (Kozai et al., 1995). A partir de este resultado se podría considerar que el volumen de medio por explante que se determinó en el SIT para la gerbera, garantizó al final de la fase de multiplicación la suficiente cantidad de nutrientes esencial para el máximo crecimiento de los brotes. Los brotes provenientes de este tratamiento fueron los que mostraron mejores características en todos los indicadores, además del color y el grosor de los tallos y hojas (Figura 4C).

En el cultivo in vitro, la fuente de iones es limitada y de una amplia composición. Sin embargo, la asimilación de los mismos depende de la cantidad y forma en que se encuentran disponibles a los brotes existiendo un equilibrio entre el proceso de asimilación y la excreción de compuestos al medio proveniente de los brotes (William, 1995). Esto pudiera explicar porque los brotes que proliferaron con un volumen de medio de 30 ml/explante no mejoraron los indicadores morfológicos y fisiológicos de calidad, ellos pudieron asimilar menor cantidad de nutrientes como se evidenció en la disminución en la masa fresca y el bajo contenido de agua.
La nutrición in vitro es un proceso complejo y ha sido poco estudiado no solo para el cultivo en inmersión temporal sino para la micropropagación por métodos convencionales por lo que pudiera resultar interesante en investigaciones futuras. De acuerdo con los resultados alcanzados en este experimento, se seleccionó 40 ml de medio de cultivo/explante como adecuado para la proliferación in vitro de la gerbera en el SIT.
CONCLUSIONES
Se puede multiplicar gerbera en SIT, mostrando mejor calidad morfo-fisiológica, y mayor número de brotes/explantes a los 28 días de cultivo. Por otra parte con la inoculación de 40 ml/explantes, se logra un aumento del número y la longitud de los brotes, así como de la masa fresca.
REFERENCIAS
Akdemir H, Süzerer V, Onay A, Tilkat E, Ersali Y, Ozden Y (2014) Micropropagation of the pistachio and its rootstocks by temporary immersion system. Plant Cell, Tissue and Organ Culture 117(3): 65-76; doi: 10.1007/s11240-013-0421-0
Alvarenga S, Salazar T (2015) Micropropagación masiva de Stevia rebaudiana Bertoli en Sistema de Inmersión Temporal. Cultivos Tropicales 36(3): 50-57
Basail M, Medero V, Torres M, López J, Santos A, Rayas A, Bauta M, Beovidez Y, Ortega A (2013) Nueva alternativa para la micropropagación en inmersión temporal del cultivar de plátano vianda ‘INIVITPV-2011’ (AAB). Revista Colombiana de Biotecnología 15(1): 98-107
Basail M, Mederos V, Ventura J, López J, Otero E, Santos A, Torres M, Cabrera M, Rayas A, Bauta M, Beovidez Y (2012) Multiplicación del clon de banano ‘FHIA-18’ (AAAB) en Sistema de Inmersión Temporal. Revista Colombiana de Biotecnología 14(1): 8-19
Blakesley D, Constantine D (1992) Uptake and metabolism of 6- benzyladenine in shoot culture of range of species. Plant Cell, Tissue and Organ Culture 28(2): 183-186; doi: 10.1007/BF00055515
Cardoso JC, Teixeira JA (2012) Micropropagation of Gerbera using chloride dioxide (CLO2) to sterilize the culture medium. In vitro Cellular Developmental Biology Plant 48(3): 362-364; doi: 10.1007/s11627-011-9418-8
Cardoso JC, Teixeira JA (2013) Gerbera micropropagation. Biotechnology Advances 31(8): 1344-1357; doi: 10.1016/j.biotechadv.2013.05.008
Díaz J, Castro D (2011) Propagación clonal in vitro de plantas de banano (Musa AAA) clon Giant cavendish en biorreactores de inmersión temporal. Revista Universidad Católica de Oriente 31: 31-41
Escalona M (2006) Temporary immersion beats traditional techniques on all fronts. Prophyta annual 50: 48-50
Escalona M, Lorenzo JC, González B, Daquinta M, Borroto C, González JL, Desjardines Y (1999) Pineapple (Ananas comosus L. Merr) micropropagation in temporary immersion systems. Plant Cell Reports 18(9): 743-74; doi: 10.1007/s002990050653
Etienne E, Berthouly M (2002) Temporary Immersion Systems in plant micropropagation. Plant Cell, Tissue and Organ Culture 69(3): 215-23; doi: 10.1023/A:1015668610465
García-Ramírez Y, González M, Quiala E, Freire M, La O Cárdenas M, Moreno-Bermúdez L, Hurtado O (2014) Effect of BA Treatments on Morphology and Physiology of Proliferated Shoots of Bambusa vulgaris Schrad. Ex Wendl in Temporary Immersion. American Journal of Plant Sciences 5(2): 205-211; doi: 10.4236/ajps.2014.52027
Georgiev V, Schumann A, Pavlov A, Bley T (2014) Temporary immersion systems in plant biotechnology. Engineering in Life Sciences 14: 607-621; doi: 10.1002/elsc.201300166
Hahn EJ, Paek KY (2005) Multiplication of Chrysanthemum shoots in bioreactors as affected by culture method and inoculation density of single node stems. En: AK Hroslef-Eide, W Preil (eds). Liquid Culture Systems for in vitro Plant Propagation, pp. 143-153.Springer, Berlin; doi: 10.1007/1-4020-3200-5
Kanwar JK, Kumar S (2008) In vitro propagation of Gerbera – A Review. Hort Sci 35(1): 35–44
Kozai T, Kitaya Y, Fujiwara K, Smith M, Aitken-Crhistie J (1995) Environmental measurement and control systems. En: Aitken-Christie J, T Kozai, M L Smith (Eds). Automation and environmental control in plant tissue culture, pp. 539-574. Kluwer Academic Publishers, Dordrecht; doi: 10.1007/978-94-015-8461-6
Lorenzo JC, González JL, Escalona M, Teisson C, Espinosa P, Borroto C (1998) Sugarcane shoot formation in an improved temporary immersion system. Plant Cell, Tissue and Organ Culture 54(3): 197-200; doi: 10.1023/A:1006168700556
Ludwing F, Guerrero AC, Fernández DM, Villas Bôas, RL (2010) Análise de crescimento de gérbera de vaso conduzida em diferentes substratos. Horticultura Brasileira 4: 28-70; doi: 10.1590/S0102-05362010000100013
Murashige T, Skoog F (1962) A revised medium for rapid growth and bio-assay with tobacco tissue cultures. Physiologia Plantarum 15: 473–479
Nápoles L, Escalona M, Trujillo R, Concepción O (2015) Propagación in vitro del guayabo (Psidium guajava L.) cv. EEA 18-40 con el uso de los Biorreactores de Inmersión Temporal (BIT®). Memorias del 10mo congreso Internacional de Biotecnología Vegetal. Ciego de Avila, ISBN: 978-959-16-2390-4.
Son NV, Mokashi AN, Hegde RV, Patil VS, Lingaraju S (2011) Response of Gerbera (Gerbera jamesonii Bolus) varieties to micropropagation. Karnataka J Agric Sci 24(7): 354
Wilken D, Jiménez E, Gerth A, Gómez-Kosky R, Schumann A, Claus D (2014) Effect of immersion systems, lighting and TIS designs on biomass increase in micropropagating banana (Musa spp. cv. 'Grande naine' AAA). In vitro Cellular Developmental Biology Plant 50(5): 582-589; doi: 10.1007/s11627-014-9605-5
Recibido: 22-09-2015
Aceptado: 30-11-2015
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
