Artículo original
Efecto de antibióticos en la propagación in vitro de Agave fourcroydes Lem
Effect of antibiotics on Agave fourcroydes Lem in vitro propagation
Enildo Abreu, Maryla Sosa del Castillo, Gerardo Ascunce del Sol, Gerardo González
Facultad de Agronomía. Universidad de Matanzas. Autopista a Varadero km 3 ½. Matanzas. Matanzas. Cuba. CP 44740. e-mail: enildo.abreu@umcc.cu
RESUMEN
La elevada contaminación microbiana en la propagación in vitro del henequén (Agave fourcroydes Lem) reduce la eficiencia. Este trabajo tuvo como objetivo determinar el efecto del uso de antibióticos en el control de contaminantes bacterianos de este cultivo. Se identificaron los contaminantes bacterianos y se determinó su susceptibilidad a diferentes antibióticos. Los dos antibióticos de mejores resultados se adicionaron al medio de cultivo de propagación y se cuantificó el número de explantes contaminados con bacterias y necróticos. El antibiótico y la concentración que no ocasionó fitotoxicidad a los explantes y donde se obtuvo el menor porcentaje de contaminación se empleó para continuar la propagación de las plantas. Estas se transfirieron a la fase de aclimatización y a los 30 días de cultivo se cuantificó el número de plantas vivas y el número de raíces por planta. Además, se midió la longitud de las raíces (cm) y se calculó el área foliar. Se comprobó la presencia Micrococcus spp., Pseudomonas spp., Agrobacterium spp., Bacillus subtilis y Bacillus licheniformis. Los antibióticos ensayados inhibieron el crecimiento in vitro de los contaminantes aislados y los mejores resultados se obtuvieron con Ticar y Cefotaxima. Adicionados al medio de cultivo de propagación de las plantas, Ticar fue fitotóxico por encima de 50 mg l-1 y cefotaxima puede utilizarse a 100 mg l-1 sin ocasionar daños a los explantes. Los resultados demostraron que las plantas que provenían del medio de cultivo con cefotaxima 100 mg l-1 mostraron un incremento significativo de las variables evaluadas en la fase de aclimatización.
Palabras clave: betalactámicos, henequén, micropropagación
ABSTRACT
High microbial contamination on henequen (Agave fourcroydes Lem) in vitro propagation reduces its efficiency. This work aimed to determine the effect of the use of antibiotics in the control of bacterial contaminants of this culture. Bacterial contaminants were identified and their susceptibility to different antibiotics it were determined. The two best-acting antibiotics were added to the propagation medium and the number of explants contaminated with bacteria and necrotics was quantified. The antibiotic and concentration that did not cause phytotoxicity to the explants and where the lowest percentage of contamination was obtained it was used to continue the propagation of the plants. These were transferred to the acclimatization stage and at 30 days of culture the number of live plants and the number of roots per plant were quantified. In addition, the length of the roots (cm) was measured and the leaf area was calculated. Micrococcus spp., Pseudomonas spp., Agrobacterium spp., Bacillus subtilis and Bacillus licheniformis were found. The antibiotics tested inhibited the in vitro growth of the isolated contaminants and the best results were obtained with Ticar and Cefotaxime. Added to the plant propagation medium, Ticar was phytotoxic over 50 mg l-1 and cefotaxime could be used at 100 mg l-1 without causing damage to the explants. The results showed that the plants that came from the culture medium with cefotaxime 100 mg l-1 showed a significant increase of the variables evaluated in the acclimatization stage.
Key words: betalactamic, henequen, micropropagation
INTRODUCCIÓN
Agave fourcroydes Lem. es una especie perenne, de propagación vegetativa, se cultiva en áreas ecológicas con limitado suministro de agua y suelos pobres (Garriga et al., 2010; Kulus, 2014). Tiene, además, alto potencial de uso como fuente de productos naturales como esteroides y detergentes a partir de sus sapogeninas (Sosa et al., 2014).
Para satisfacer las demandas del mercado de plantas de Agave se han aplicado herramientas biotecnológicas en diferentes especies (Madrigal et al., 1990; Robert et al., 1992; González et al., 2000; González et al., 2002; González et al., 2011; Robert et al., 2006; Garriga et al., 2010). Sin embargo, al igual que en otras plantas, se presentan dificultades entre las que se encuentran el bajo potencial de regeneración, la hiperhidricidad de los explantes y la presencia de contaminantes endofíticos o asociados a errores humanos durante la transferencia de los cultivos (Kulus, 2014).
Entre los contaminantes microbianos, las bacterias causan pérdidas elevadas en el cultivo in vitro de plantas (Leifert y Waites, 1992). El uso de antibióticos incorporados al medio de cultivo es una de las alternativas para disminuirlas aunque su aplicación se ve restringida debido a sus posibles efectos fitotóxicos sobre el material vegetal (Robert et al., 2006; Fang y Hsu, 2012; Mbah y Wakil, 2012; Sabale et al., 2015).
En una de las especies de agave más trabajadas por cultivo in vitro; Agave tequilana Weber, Castillo-Campohermoso (2002) informó que se presentaron problemas de contaminación bacteriana, pero no pudieron ser controlados de manera efectiva con antibióticos. Sin embargo, el empleo de un extracto comercial de toronja (Citrus grandis Osbeck) con conocida actividad antimicrobiana resultó factible para el control de los microorganismos contaminantes (Obledo-Vázquez et al., 2004).
La propagación in vitro del henequén (Agave fourcroydes Lem) (Garriga et al., 2010) pudiera contribuir a la recuperación del cultivo en el país, sin embargo la elevada contaminación microbiana reduce la eficiencia de este proceso pero no se encontraron referencias sobre el uso de antibióticos para su control.
Atendiendo a la problemática existente este trabajo se propuso determinar el efecto del uso de antibióticos en el control de contaminantes bacterianos que afectan la producción de plantas in vitro de henequén.
MATERIALES Y MÉTODOS
Esta investigación se desarrolló en el Centro de Estudios Biotecnológicos (CEBIO) de la Universidad de Matanzas Camilo Cienfuegos, Matanzas, Cuba.
Material vegetal
Para el cultivo in vitro se emplearon plantas de henequén variedad ‘Sac Ki’ como material vegetal inicial. Estas procedían de plantaciones comerciales en la Empresa Henequenera Eladio Hernández. Las plantas se seleccionaron teniendo en cuenta elevado vigor, longitud de las hojas entre 120 y 130 cm y número de hijos basales entre cinco y siete. El material vegetal se propagó según lo descrito por Garriga et al. (2010).
Identificación de contaminantes y susceptibilidad a antibióticos
Se separaron frascos visiblemente contaminados donde se observaba una película alrededor de los explantes. Se realizaron aislamientos en placas de Petri con medio de cultivo que contenía triptona 10 g l-1, extracto de levadura 5 g l-1, NaCl g l-1, glucosa 10 g l-1 y agar 20 g l-1, pH 7.2. Las placas se incubaron a 30ºC durante 24h y las colonias aisladas se purificaron en similar medio de cultivo.
Se observaron las características culturales de las colonias en microscopio estereocopio y se realizaron preparaciones frescas y teñidas para observar los caracteres morfológicos (forma, agrupación, motilidad, respuesta al Gram). Además, se hicieron pruebas fisiológico-bioquímicas como la fermentación de carbohidratos (glucosa, lactosa, manitol, sacarosa), actividad catalasa y oxidasa, sensibilidad a colistina, producción de indol y de amina, hidrólisis de urea y liberación de CO2. Para estas pruebas se emplearon los medios de cultivo agar de hierro y triple azúcar (TSI), Citrato de Simmons, Agar de hierro y lisina (LIA), Agar Urea, Medio MIO (motilidad, indol y ornitina). Para la identificación de los contaminantes bacterianos se emplearon los criterios del Manual of Systematic Bacteriology (Garrity et al., 2005) y Madigan et al. (2009).
A todos los aislamientos se le realizaron antibiogramas mediante el método de Kirby-bauer con discos de los antibióticos Bacitracina, Cefotaxima, Penicilina, Estreptomicina, Rifampicina, Cloranfenicol, Tetraciclina, Ticar (Ticarcilina) y Eritromicina (Oxoid). Se seleccionaron dos antibióticos donde se formara halo de inhibición en todos los aislados. Cada ensayo fue replicado tres veces para los contaminantes aislados.
Efecto de antibióticos
Para evaluar la efectividad de los antibióticos contra los contaminantes bacterianos se emplearon por separado los dos antibióticos seleccionados previamente. Se adicionaron al medio de cultivo diferentes concentraciones (25, 50, 100, y 1000 mg l-1) y se tomó como control el medio de cultivo sin antibiótico. Se establecieron 40 individuos (dos explantes por frasco) por tratamiento.
Los frascos se colocaron en cámara de crecimiento con luz solar a 26 ± 2ºC (37.5 µmol m2 s-1 de luminosidad como promedio) durante 30 días. Se cuantificó el número de explantes contaminados con bacterias y el número de explantes necróticos por tratamiento. Se seleccionó el antibiótico y la concentración que no ocasionó fitotoxicidad a los explantes (expresada como necrosis o clorosis de los explantes) y donde se obtuvo el menor porcentaje de contaminación.
Posteriormente, se continuó la propagación de las plantas (Garriga et al., 2010) en medio de cultivo con y sin antibiótico a la concentración seleccionada y se transfirieron a fase de aclimatización donde se tuvieron en cuenta de forma general los criterios referidos por Abreu et al. (2007).
El experimento se desarrolló en casa de cultivo donde las plantas se colocaron en bandejas de poliestireno expandido con 70 alvéolos. Se empleó como sustrato una mezcla de pulpa de henequén descompuesta al 10% con zeolita. Se emplearon 40 plantas de réplica para cada tratamiento, la humedad ambiental se mantuvo entre 80 y 90%. A los 30 días de cultivo se cuantificó el número de plantas vivas y se calculó el porcentaje de supervivencia, el número de raíces por planta, se midió la longitud de las raíces (cm) y se calculó el área foliar (AF) (cm). AF largo x ancho x 0.68 (constante), según Abreu (2009).
Análisis estadístico
Para los análisis estadísticos se empleó el programa Statgraphics Versión 5.0 (2000). Los resultados se procesaron estadísticamente a través de un análisis de varianza de clasificación simple, con un diseño completamente aleatorizado. Los datos en porcentajes se transformaron según X = 2arcsin (X/100) 0.5. Para detectar la diferencia entre las medias se realizó un ANOVA y la Prueba de Rangos Múltiples de Duncan para el 5% de significación.
RESULTADOS Y DISCUSIÓN
Se comprobó la presencia de contaminantes bacterianos en los frascos de cultivo pertenecientes a Micrococcus spp., Pseudomonas spp., Agrobacterium spp., Bacillus subtilis y Bacillus licheniformis.
Los resultados de este estudio demostraron que el empleo de métodos de desinfección superficial del material vegetal procedente de plantaciones comerciales no garantizó la eliminación de los contaminantes bacterianos. Las especies identificadas se han encontrado en el suelo, asociadas a plantas y como contaminantes de diferentes cultivos propagados in vitro (Leifert y Waites, 1992; Reed et al., 1995; Asif et al., 2013).
Con el cultivo in vitro se obtienen cultivos asépticos que favorecen su propagación. Pero si se tiene en cuenta que los tejidos de los cuales se parte para iniciar el cultivo provienen del campo entonces, la probabilidad de la contaminación por virus, bacterias, levaduras y hongos filamentosos, es elevada (Niubó et al., 2004).
Los antibióticos ensayados inhibieron el crecimiento in vitro de los contaminantes aislados. Los mayores halos de inhibición en los aislados Gram negativos se observaron con el antibiótico Ticar mientras que Cefotaxina inhibió el crecimiento tanto de bacterias Gram negativas como Gram positivas. A partir de estos resultados se seleccionaron estos dos antibióticos.
En la mayor concentración para ambos antibióticos se produjo el menor número de explantes contaminados con diferencias significativas con el resto de las concentraciones ensayadas. Sin embargo, en presencia de esta concentración se produjo el mayor número de explantes necrosados, los cuales no sobrevivieron (Tabla 1).
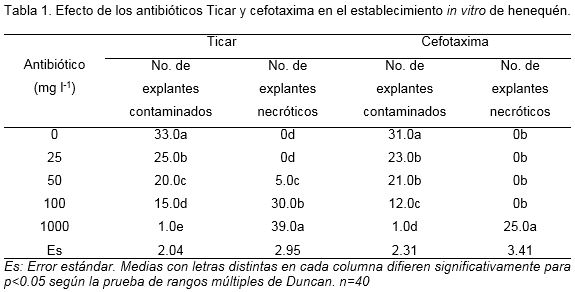
Los primeros individuos necróticos con el empleo de Ticar se observaron a partir de 50 mg l-1, mientras que con cefotaxima fue a 1000 mg l-1. Este resultado indicó que Ticar presentó mayor fitotoxicidad ya que a menor concentración se observó clorosis y necrosis de los tejidos que alcanzó hasta el 97.5% de los explantes con 1000 mg l-1.
Con cefotaxima 1000 mgl-1 se redujo la contaminación bacteriana en un 75% con respecto al control pero se perdió el 62.5% de los explantes por necrosis mientras que con 100 mg l-1 aunque la reducción fue menor no se observaron explantes necróticos.
Diferentes autores han informado que el uso de cefotaxima en el cultivo in vitro de plantas produce menores efectos fitotóxicos que otros antibióticos y reduce la contaminación bacteriana (Danilova y Dolgikh, 2004; Grewal et al., 2006; Asif et al., 2013; Sabale et al., 2015). Coincidiendo con los resultados de este trabajo, Barrueto y Zimmermann (2006) informaron que la adición de Cefotaxima 100 mg l-1 ayudó en el control de contaminación bacteriana persistente sin afectar el crecimiento y coloración de yemas axilares de yuca (Manihot esculenta) cultivadas in vitro. Sin embargo, Sabale et al. (2015) con la incorporación al medio de cultivo de cefotaxima 1000 mg l-1 alcanzaron un control efectivo de la contaminación bacteriana en la micropropagación de banano cv. ‘Grande naine’ (Musa AAA) sin fitotoxicidad.
A partir de los resultados se seleccionó el antibiótico Cefotaxima a 100 mg l-1. No se recomienda el empleo de Ticar en la micropropagación del henequén a partir de fuentes de explantes procedente de condiciones de campo, pues se necesitan elevadas concentraciones para controlar las contaminaciones que provocan un elevado número de individuos necrosados, una disminución del crecimiento vegetal y no controla contaminantes bacterianos Gram positivos.
Los resultados demostraron que las plantas que provenían del medio de cultivo con cefotaxima 100 mg l-1 mostraron un incremento significativo de las variables evaluadas en la fase de aclimatización (porcentaje de supervivencia, número y longitud de las raíces y área foliar) con respecto a las plantas del tratamiento control sin antibiótico (Tabla 2).
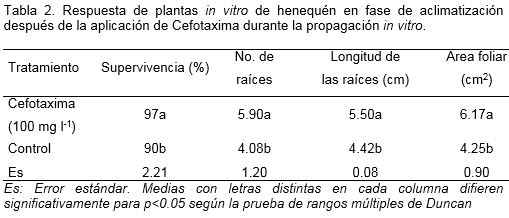
De modo general, se puede señalar que las plantas tratadas con Cefotaxima, mostraron un vigor superior y color verde más intenso en comparación con las plantas controles. No se evidenció en ninguno de los casos, la presencia de anomalías morfológicas y tampoco se observaron afectaciones de la pigmentación de las hojas.
Estos resultados están en correspondencia con los informados por otros autores que refieren un efecto estimulante de Cefotaxima en el cultivo in vitro de plantas (Mittal et al., 2009; Asif et al., 2013). En este sentido, Danilova y Dolgikh (2004) comprobaron que la adición de este antibiótico estimulaba la regeneración de plantas de Zea mays L. Sin embargo, este es el primer informe del efecto estimulante de Cefotaxima en la propagación de A. fourcroydes.
CONCLUSIONES
El uso de los antibióticos Ticar y Cefotaxima en la propagación in vitro de A. fourcroydes permite reducir las pérdidas por contaminación bacteriana y los resultados dependen de la concentración utilizada. En el caso de Ticar, por encima de 50 mg l-1 se observa fitotoxicidad en los explantes. Sin embargo, cefotaxima puede incluirse en el medio de cultivo a 100 mg l-1 y estimula el crecimiento vegetal.
REFERENCIAS
Abreu EO (2009) Aclimatización de plántulas de henequén (Agave fourcroydes Lem.) y su evaluación en la etapa de previvero. Tesis en opción al grado científico de Doctor en Ciencias Agrícolas, Instituto Nacional de Ciencias Agrícolas, La Habana, Cuba
Abreu E, González G, Ortiz R, Rodríguez P, Domech R, Garriga M (2007) Evaluación de vitroplantas de henequén (Agave fourcroydes Lem) durante la fase de aclimatización. Cultivos Tropicales 28 (1): 5-11
Asif M, Eudes F, Randhawa H, Amundsen E, Yanke J, Spaner D (2013) Cefotaxime prevents microbial contamination and improves microspore embryogenesis in wheat and triticale. Plant Cell Rep 32(10):1637-1646; doi: 10.1007/s00299-013-1476-4
Barrueto LP, Zimmermann MA (2006) Contaminação in vitro de plantas. Embrapa Recursos Genéticos e Biotecnologia, Brasília
Castillo-Campohermoso MA (2002) Eliminación de bacterias contaminantes de cultivo de Agave tequilana Weber. Tesis de maestría en Ciencias, Universidad de Guadalajara, Guadalajara, México
Danilova SA, Dolgikh YI (2004) The stimulatory effect of the antibiotic cefotaxime on plant regeneration in maize tissue culture. Russ J Plant Physiol 51:559–562; doi: 1021-4437/04/5104-0559
Fang JY, Hsu YR (2012) Molecular identification and antibiotic control of endophytic bacterial contaminants from micro propagated Aglaonema cultures. Plant Cell Tiss Org Cult 110:53–62; doi: 10.1007/s11240-012-0129-6
Garriga M, González G, Alemán S, Abreu E, Quiroz K, Caligari PDS, García-González R (2010) Manejo de la interacción auxina-citoquinina para mejorar el protocolo micropropagación de henequén (Agave fourcroydes Lem.) Chilean Journal of Agricultural Research 70(4): 545-551
Garrity G, Brenner DJ, Krieg NR, Staley JR (eds) (2005) Bergey's Manual of Systematic Bacteriology. Springer, East Lansing; doi: 10.1007/0-387-28022-7
González G, Alemán S, Abreu E, Figueroa H, Toapanta P, Doam C (2011) Evaluación de la cosecha de plantas seleccionadas de henequén (Agave fourcroydes Lem) y propagadas in vitro. Revista Ciencia Amazónica 2 (2): 13-16
González G, Alemán S, Trujillo R, Domech R, Abreu E, Pérez Y (2002) Influencia del 6 Benciladenina sobre el comportamiento in vitro de plantas de henequén obtenidas a partir de embriones. Biotecnología vegetal 2(4): 235-238
González G, Alemán S, Infante D (2000) Asexual genetic variability in Agave fourcroydes II: Selection among individuals in clonally propagated population. Plant Science 165 (3): 595-601
Grewal D, Gill R, Gosal SS (2006) Influence of antibiotic cefotaxime on somatic embryogenesis and plant regeneration in indica rice. Biotechnol J 1:1158–1162; doi: 10.1002/biot.200600139
Kulus M (2014) Micropropagation of selected Agave species. En: Czubenko M (ed). PhD Interdisciplinary Journal, pp. 75-84. Politechnika Gdańska, Gdańsk; doi: 10.13140/2.1.1482.6565
Leifert C, Waites WM (1992) Bacterial growth in plant tissue culture media. Journal of Applied Bacteriology 72: 460-466
Madigan MT, Martinko JM, Dunlap PV, Clark DP (eds) (2009) Brock Biología de los microorganismos. ADDISON-WESLEY, New Jersey; ISBN: 9788478290970
Madrigal LR, Pineda EF, Rodríguez de la O JL (1990) Agave. Handbook of Plant Cell Culture. En: Ammirato PV, Evans D A, Sharp WR, Bajaj Y (eds). Ornamental Species, pp. 206-227. McGraw-Hill Publishing Co, New York
Mbah EI, Wakil SM (2012) Elimination of bacteria from in vitro yam tissue cultures using antibiotics. J Plant Pathol 94:53–58
Mittal P, Gosal SS, Senger A, Kumar P (2009) Impact of cefotaxime on somatic embryogenesis and shoot regeneration in sugarcane. Physiol Mol Biol Plants 15:257–265; doi: 10.1007/s12298-009-0029-3
Niubó E, Díaz P, Oliva O, Portieles R, Díaz A, Ancheta O, Rodríguez S, Soto A, Sánchez C (2004) Metodología para la obtención in vitro de plantas y tejidos de la caña de azúcar libres de contaminantes exófitos y endófitos. Revista CENIC Ciencias Biológicas 35 (3): 55-161
Obledo-Vázquez EN, Flores-Verduzco N, Cervantes-Martínez J (2004) Detección del efecto de un extracto vegetal antimicrobiano sobre plantas de agave (Agave tequilana Weber var. azul) cultivadas in vitro utilizando fluorescencia inducida por láser (LIF). Revista Mexicana de Fitopatología 22 (3): 328-332
Reed BM, Buckley PM, Dewilde TN (1995) Detection and eradication of endophytic bacteria from micro propagated mint plants. In Vitro Cell Dev Biol- Plant 31:53–57
Robert ML, Herrera JL, Chan JL, Contreras F (1992) Micropropagation of Agave spp. En: Bajaj JPY (ed). Biotechnology in Agriculture and Forestry, pp. 306-329. Springer-Verlag, Berlin
Robert ML, Herrera-Herrera JL, Castillo E, Ojeda G, Herrera-Alamillo MA (2006) An Efficient Method for the Micropropagation of Agave Species. En: Loyola-Vargas VM, Vázquez-Flota F (eds). Methods in Molecular Biology, pp. 165-178. Humana Press, New Jersey; doi: 10.1385/1-59259-959-1:165
Sabale SN, Patil DM, Gokhale NB, Sawardekar SV, Sawant SS (2015) Elimination of bacterial contamination by using antibiotics in micropropagation of banana (Musa spp.) cv. Grand naine Journal of Cell and Tissue Research 15(2): 5111-5115
Sosa M, Alemán S, Pérez Y, Abreu E, Sosa D, González G (2014) Caracterización de la lámina foliar de plantas de Agave fourcroydes Lem. obtenidas por propagación asexual. Biotecnología Vegetal 14 (1): 37-44
Recibido: 23-02-2014
Aceptado: 17-06-2015
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
