Artículo original
Respuesta de cultivares de Phaseolus vulgaris L. en condiciones inducidas de estrés térmico
Response of Phaseolus vulgaris L. cultivars under induced conditions of heat stress
Raúl Collado1, Annerys Carabeo Pérez2, Ivian Poveda Martínez2, Luis Rojas1, Michel Leiva-Mora1, Lourdes R García1, Novisel Veitía1, Amanda Martirena1, Damaris Torres1, Leonardo Rivero1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: raulc@ibp.co.cu
2Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
RESUMEN
La producción del frijol común (Phaseolus vulgaris L.) está limitada por diversas condiciones estresantes, entre ellas, las altas temperaturas. Por ello, obtener cultivares tolerantes sin afectar su rendimiento es un propósito de los programas de mejoramiento genético de esta importante leguminosa. La evaluación de variables fisiológicas para determinar la respuesta de cultivares de P. vulgaris en condiciones de estrés térmico puede ser un aporte significativo para la identificación de cultivares tolerantes. Este trabajo se realizó con el objetivo de determinar la respuesta de cultivares de P. vulgaris, en condiciones inducidas de estrés térmico. Se determinó el efecto de la temperatura en la pérdida de electrólitos y la liberación de fosfato inorgánico en tejido foliar. En todas las temperaturas analizadas (35-60 °C), se observó un incremento en la pérdida de electrólitos, con respecto al valor de esta variable a 25 °C para los 10 cultivares objeto de estudio. Las diferencias significativas de pérdida de electrólitos entre los cultivares, se presentaron en los tratamientos donde el tejido foliar estuvo expuesto a 35 y 40 °C. Se observaron respuestas diferentes de liberación de fosfato inorgánico en dependencia del cultivar. ʹICA Pijaoʹ y ʹCuba Cueto 25-9 Negroʹ, liberaron mayor cantidad de fosfato inorgánico sin diferencias entre ellos. La temperatura influyó sobre la pérdida de electrólitos y la liberación de fosfato inorgánico en el tejido foliar, y permitió determinar la respuesta de varios cultivares en condiciones inducidas de estrés térmico.
Palabras clave: altas temperaturas, condiciones estresantes, frijol, liberación de fosfato, pérdida de electrólitos
ABSTRACT
The production of common bean (Phaseolus vulgaris L.) is limited by diverse stressful conditions, amongst them high temperatures. Therefore, obtaining tolerant bean cultivars without affecting their yield is a purpose of the breeding programs of this important legume. Evaluation of physiological variables to determine the response of cultivars of P. vulgaris under heat stress can be a significant contribution to the identification of tolerant cultivars. This work was performed in order to determine the response of ten P. vulgaris cultivars under induced heat stress conditions. The effect of temperature on electrolytes leakage and release of inorganic phosphate in leaf tissue of P. vulgaris was determinate. In all tested temperatures (35-60 ° C), there was an increase at electrolytes leakage, regarding the value of this variable at 25 ° C for 10 cultivars under study. Significant differences of electrolytes leakage between cultivars were presented in the treatments where leaf tissue was exposed to 35 and 40 ° C. Different responses of the release of inorganic phosphate were observed depending on cultivars. ʹICA Pijaoʹ and ʹCuba Cueto 25-9 Blackʹ cultivars released the biggest amount of inorganic phosphate without differences between them. The temperature influenced on the leakage of electrolytes and the release of inorganic phosphate from the leaf tissue, and allowed us to determine the response of various cultivars under induced heat stress conditions.
Key words: bean, electrolytes leakage, high temperatures, phosphate release, stressful conditions
INTRODUCCIÓN
Las especies del género Phaseolus son importantes fuentes de proteína vegetal en la dieta de los países en desarrollo. En este género, el frijol común (Phaseolus vulgaris L.), es la especie más empleada para consumo humano. Su centro de domesticación es en dos regiones Mesoamérica y América Andina, pero se ha diseminado por todos los continentes (Ramírez y Rangel, 2011).
El estrés causado por altas temperaturas provoca importantes afectaciones a la producción de frijol común. Reduce el porcentaje de germinación, incrementa el número de plántulas anormales, induce floración temprana, disminuye la eficiencia de la fijación de nitrógeno atmosférico, reduce la estabilidad de las membranas, por lo que se afecta la actividad fotosintética y la acumulación de biomasa (Hungria y Kaschuk, 2014; Reza et al., 2015). Durante la fase reproductiva, el estrés ocasionado por calor, afecta la viabilidad del polen, la fecundación y el desarrollo de las semillas, provoca la abscisión de las flores y las legumbres, lo que origina pérdidas substanciales en el rendimiento de granos (Porch et al., 2004). A causa de las altas temperaturas en las regiones tropicales y subtropicales la época de siembra de frijol común se restringe a los meses frescos del año y a las zonas donde no se sobrepasan los 30 °C. Por estas razones, la obtención de cultivares de frijol común tolerantes al estrés causado por altas temperaturas podría incrementar considerablemente las áreas disponibles para el cultivo de este grano (Beebe et al., 2011).
Las membranas celulares son los primeros blancos en muchos tipos de estrés en plantas. El mantenimiento de su estabilidad e integridad bajo condiciones de estrés producido por déficit de agua, salinidad o temperatura es un componente importante de la tolerancia a estos factores. El grado de ruptura de la membrana celular, causado por estrés provocado por temperatura puede ser estimado a través de mediciones de pérdida de electrólitos (Bajji et al., 2002) y/o liberación de fosfato inorgánico (Torres y Rodríguez, 2002). Estos métodos son poco costosos, no requieren de equipamiento sofisticado, son aplicables para diferentes sistemas de cultivos y permiten analizar un gran número de muestras en un corto período de tiempo. Sin embargo, a pesar de las ventajas que ofrecen, su empleo para identificar o diferenciar niveles de tolerancia a estrés producido por calor en frijol común no ha sido descrito en la literatura científica consultada. Por ello, la evaluación de variables fisiológicas para determinar la respuesta de cultivares de P. vulgaris en condiciones inducidas de estrés térmico puede ser un aporte para la identificación de cultivares tolerantes. Este trabajo se realizó con el objetivo de determinar la respuesta de cultivares de P. vulgaris, en condiciones inducidas de estrés térmico. Para ello, se estudió el efecto de la temperatura en la pérdida de electrólitos y la liberación de fosfato inorgánico en tejido foliar de P. vulgaris.
MATERIALES Y MÉTODOS
Material vegetal, condiciones de cultivo y colecta de muestras
El estudio se realizó con 10 cultivares de P. vulgaris (ʹICA Pijao ʹ, ʹI45Rʹ, ʹL68.3ʹ, ʹL84.9ʹ, ʹL84.6ʹ, ʹL84.4ʹ, ʹTomeguín-93ʹ, ʹBAT-93ʹ, ʹCuba Cueto 25-9 Negroʹ y ʹGuamá-23ʹ). La siembra se efectuó en una casa de cultivos protegidos con condiciones semicontroladas (temperatura ambiente media de 27 ± 5 °C, humedad relativa media de 84 ± 5% y una densidad de flujo de fotones fotosintéticos en el rango de 280-400 umol m-2s-1 entre las 9:00 am y 5:00 pm horas del día). Para la siembra se emplearon bolsas de polietileno rellenas con 1004.8 cm3 de mezcla de sustrato (materia orgánica + zeolita en proporción 4:1). Se sembraron tres semillas por bolsa y se utilizaron 25 bolsas por cada cultivar. Se realizaron tres siembras a intervalos de 15 días entre cada una de ellas. Las plantas se regaron a diario con un sistema automático de aspersores.
Se colectaron foliolos de la segunda y tercera hoja trifoliada en plantas con 30-35 días después de la germinación. Las hojas se colocaron en agua para evitar la deshidratación del tejido. Los foliolos se colocaron sobre una superficie lisa con el envés hacia arriba y se cortaron discos de 1.1 cm de diámetro con el empleo de un horadador. Para garantizar la homogeneidad de las muestras, se desecharon las nervaduras principales y los extremos terminales de los foliolos. Los discos de hojas obtenidos se utilizaron como muestras para las determinaciones de pérdida de electrólitos y liberación de fosfato inorgánico.
Efecto de la temperatura sobre la pérdida de electrólitos y la liberación de fosfato inorgánico en tejido foliar
Pérdida de electrólitos
En cada tubo (150 mm largo x 20 diámetro mm), se colocaron cinco discos de hojas, los que se enjuagaron con agua desionizada para eliminar los electrólitos adheridos a la superficie del tejido, así como los liberados por las heridas producidas por el horadador. A cada tubo con los discos de hojas, se añadieron 25 ml agua desionizada. Se realizaron 20 réplicas para cada cultivar. La apertura de los tubos se selló con Parafilm y se agitaron de forma manual para homogeneizar la solución. A continuación se midió la conductividad inicial del contenido en cada tubo con un conductímetro (DDS-307 A).
Los tubos con las muestras se colocaron en una gradilla y se introdujeron en un baño térmico (LAUDA E100) por 2 h a diferentes temperaturas (35, 40, 45, 50, 55 y 60 °C). Transcurridas las 2 h en la primera temperatura, las muestras se enfriaron a 25 ± 2 °C y se midió la conductividad a cada muestra mediante el procedimiento descrito anteriormente. Este proceso se realizó sucesivamente para cada temperatura hasta 60 °C. Finalmente se colocaron los tubos que contenían las muestras, tapados con papel de aluminio, en una autoclave a 121 °C y 1.2 kg cm-2 de presión durante 30 min para lograr la pérdida total de electrólitos. Después de este proceso de esterilización también se midió la conductividad de la solución. Los datos de las mediciones realizadas se utilizaron para calcular el porcentaje de pérdida de electrólitos (PE), para ello se aplicó la fórmula siguiente:
PE = [(PET - PEi) / (PEA - PEi)] x 100
Donde PET (pérdida de electrólitos de las muestras tratadas con una temperatura), PEi (pérdida de electrólitos inicial de las muestras sin tratar) y PEA (pérdida total de electrólitos de las muestras tratadas en autoclave).
Concentración de fosfato inorgánico
Para determinar el efecto del estrés térmico en la liberación de fosfato inorgánico, se colocaron cinco discos de tejido foliar en cada tubo con 25 ml de agua desionizada. Para cada cultivar se emplearon 10 tubos, las muestras se colocaron en una gradilla en un baño térmico (LAUDA E100) durante 2 h a 50 °C. Se utilizaron como control muestras que permanecieron a 25 ± 2 °C.
El contenido de fosfato inorgánico liberado por las muestras, se determinó a través de la metodología descrita por Se tomaron 5 ml del contenido de cada tubo a los cuales se les añadieron 2 ml de solución de sulfomolibdato de amonio y 1 ml de solución de hidroquinona (0.09 mol l-1), se agitó manualmente cada tubo y se dejaron transcurrir 3 min. Posteriormente, se le añadieron tres gotas de la solución de cloruro de estaño (0.13 mol l-1) utilizado como agente reductor. Transcurridos 5 min, se realizó la lectura de la densidad óptica a 650 nm con la utilización de un espectrofotómetro lector de placas ELISA (ThermoLabSysterms). De cada muestra se realizaron tres réplicas, para un total de 30 lecturas.
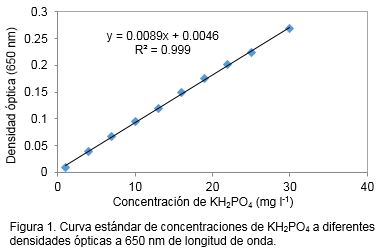
Con el valor de densidad óptica obtenido para cada muestra, se calculó la concentración de fosfato inorgánico mediante una ecuación de regresión, derivada de la curva estándar de fosfato realizada con anterioridad (Figura 1). Para la obtención de la curva estándar de fosfato se pesaron 0.115 g de KH2PO4, se disolvieron en 100 ml de agua desionizada y se enrasó hasta 1l de volumen total, cuya concentración final fue de 80 mg l-1 de fosfato y a partir de ella se realizaron diluciones a 30, 25, 22, 19, 16, 13, 10, 7, 4 y 1 mg l-1.
Análisis estadístico
Para el análisis estadístico de los datos experimentales se utilizó el Paquete estadístico SPSS versión 21.0. Se comprobó la normalidad y la homogeneidad de varianza, mediante la prueba de Shapiro-Wilk y la prueba de Levene, respectivamente. Como los datos no cumplieron los supuestos de normalidad y homogeneidad de varianza, se aplicó un análisis no paramétrico mediante las pruebas de Kruskal Wallis y Mann-Whitney para un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
Efecto de la temperatura sobre la pérdida de electrólitos y la liberación de fosfato inorgánico en tejido foliar
Pérdida de electrólitos
En todas las temperaturas analizadas (35-60 °C), se observó un incremento de forma general en la pérdida de electrólitos, con respecto al valor de esta variable a 25 °C para los 10 cultivares objeto de estudio. A partir de 45 °C, no se observaron diferencias significativas en el porcentaje de pérdida de electrólitos, pues en los 10 cultivares esta variable presentó valores superiores al 80%.
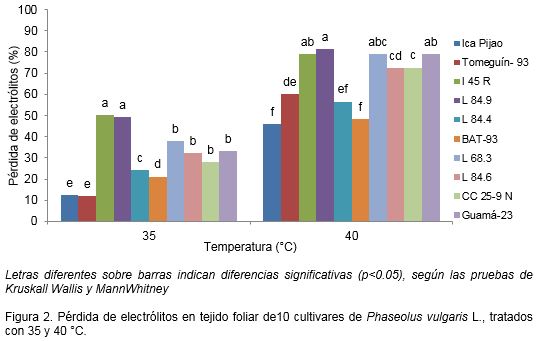
Las diferencias significativas entre los cultivares, en cuanto a la pérdida de electrólitos, se presentaron en los tratamientos donde el tejido foliar estuvo expuesto a 35 y 40 °C (Figura 2). A 35 °C, los cultivares que tuvieron menor pérdida de electrólitos fueron ʹICA Pijaoʹ y ʹTomeguín-93ʹ, seguidos por ʹL84.4ʹ y ʹBAT-93ʹ; en cambio los cultivares ʹI45Rʹ y ʹL84.9ʹ alcanzaron los mayores valores (50%) de este indicador (Figura 2). Cuando la temperatura aumentó a 40 °C, el porcentaje de pérdida de electrólitos se incrementó para todos los cultivares (Figura 2). Sin embargo, esta respuesta fisiológica correspondió con los valores de pérdida de electrólitos obtenidos a 35 °C, donde los cultivares ʹICA Pijaoʹ, ʹTomeguín-93ʹ, ʹL84.4ʹ y ʹBAT-93ʹ, fueron los menos afectados y los cultivares ʹL84.9ʹ e ʹI45Rʹ se mantuvieron dentro de los que mayor pérdida de electrólitos alcanzaron (Figura 2).
La determinación del porcentaje de pérdida de electrólitos ha demostrado tener una estrecha relación con la termoestabilidad de las membranas pues el primer efecto de la temperatura es su destrucción, en consecuencia disminuye la capacidad de las células para retener tanto solutos como iones en su interior (Schulze et al., 2005).
En el caso del frijol común, las determinaciones de pérdida de electrólitos se realizan con frecuencia después de haber sometido las plantas a condiciones de estrés hídrico o salino (Kumar et al., 2009, Houimli et al., 2010; Li et al., 2013). Sin embargo, en este trabajo los cultivares solamente fueron tratados con diferentes temperaturas con el objetivo de determinar su efecto, directamente sobre las membranas celulares del tejido foliar.
De esta manera a 35 °C los cultivares que tuvieron menor pérdida de electrólitos fueron ‘ICA Pijaoʹ y ʹTomeguín-93ʹ seguidos por ʹL84.4ʹ y ʹBAT-93ʹ, lo cual indica una mayor tolerancia al estrés térmico y una mayor termoestabilidad de sus membranas; en cambio los cultivares ʹI45Rʹ y ʹL84.9ʹ alcanzaron un 50% de pérdida de electrólitos por lo que fueron menos tolerantes a esta temperatura (Figura 2). A 40 °C, los cultivares ʹICA Pijaoʹ, ʹTomeguín-93ʹ, ʹL84.4ʹ y ʹBAT-93ʹ, fueron los más tolerantes, en cambio los cultivares ʹL84.9ʹ, ʹI45Rʹ, ʹL68.3ʹ y ʹGuamá-23ʹ fueron los más sensibles (Figura 2). Bajo las condiciones establecidas en este experimento, se determinó que 35 y 40 °C dentro del rango estudiado, fueron las temperaturas apropiadas para diferenciar respuestas entre cultivares de P. vulgaris basados en la variable fisiológica de pérdida de electrólitos.
En este trabajo se evidenció que la pérdida de electrólitos varió en dependencia del cultivar y que esta aumentó con el incremento de la temperatura. Resultados similares fueron observados por Celik y Turhan (2013) cuando analizaron la pérdida de electrólitos en cinco cultivares de frijol común.
En esta investigación los tratamientos por encima de 45 °C no permitieron discriminar entre los porcentaje de pérdida de electrólitos entre los diferentes cultivares. La variable evaluada mantuvo valores superiores al 80% muy similares para todos los cultivares. En línea con los resultados de esta investigación, Nava (2013) informó que el aumento de la temperatura a más de 40 °C provocó un incremento en el daño de la membrana celular en cultivares de Z. mays y P. vulgaris. Independientemente de la especie y cultivar, a 60 °C se observó el mayor efecto sobre la membrana celular, con un daño promedio de 84% y una diferencia de 75% con respecto al tratamiento de 40 °C. De acuerdo con lo informado por Rahman et al. (2004), esto se debe a modificaciones en la composición y estructura de la membrana celular. Esta explicación se basa en que desde el punto de vista fisiológico la temperatura modifica la fluidez de la membrana, lo cual provoca una liberación de biomoléculas e iones que genera un desbalance del potencial osmótico y del potencial de membrana e incluso provoca la lisis celular.
Los resultados de esta investigación confirmaron que el empleo de la prueba de la termoestabilidad de la membrana celular es un procedimiento conveniente para identificar cultivares de frijol tolerantes al estrés térmico en programas de mejoramiento genético.
Concentración de fosfato inorgánico
Se observaron respuestas diferentes de liberación de fosfato inorgánico en dependencia del cultivar (Figura 3). Los cultivares ‘ICA Pijao’ y ‘Cuba Cueto 25-9 Negro’, liberaron mayor cantidad de fosfato inorgánico sin diferencias entre ellos (Figura 3). La concentración de fosfato determinada en ‘ICA Pijao’ y ‘Cuba Cueto 25-9 Negro’ fue significativamente superior que en el resto de los cultivares, con excepción de ‘L68.3’ que presentó una respuesta similar a ‘Cuba Cueto 25-9 Negro’ (Figura 3). Basados en los resultados de la pérdida de electrólitos, la liberación de fosfato inorgánico para los cultivares ‘ICA Pijao’ y ‘Guamá-23’ reveló una respuesta contrastante.
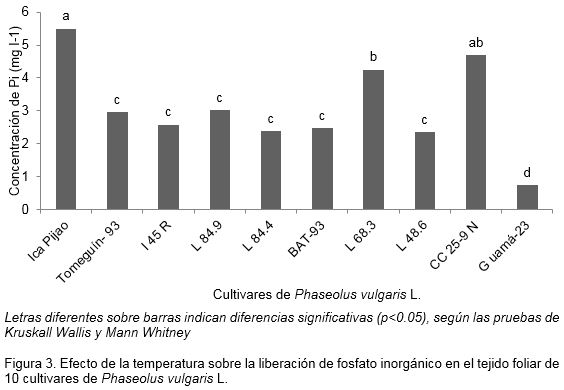
El rango de concentraciones de fosfato inorgánico detectado en este trabajo, después de someter los discos de hojas a 50 °C, está en el mismo orden de magnitud que las concentraciones de fosfato inorgánico determinadas en tejidos de la raíz de frijol (1.35-4.75 mg l-1) por Tawaraya et al. (2014). En este estudio a 50 °C no se pudo diferenciar cual cultivar liberó más o menos fosfato (Figura 3) esto puede deberse a que como a esta temperatura prácticamente se alcanza una ruptura total de la membrana, todos los cultivares hayan liberado todo su contenido de fosfato inorgánico. Se ha demostrado que la concentración endógena de fosfato en las especies vegetales, varía en dependencia del cultivar (Denbow et al., 1995) lo que pudo haber influido en la evaluación de esta variable. Por tanto, para emplear este indicador con el objetivo de diferenciar tolerancia a estrés abiótico en P. vulgaris, es necesario realizar previamente determinaciones de cantidades de fosfato en cada uno de los cultivares evaluados.
CONCLUSIONES
La temperatura influyó sobre la pérdida de electrólitos y la liberación de fosfato inorgánico en el tejido foliar de P. vulgaris. Este hecho permitió diferenciar la respuesta de varios cultivares en condiciones inducidas de estrés térmico.
REFERENCIAS
Beebe S, Ramirez J, Jarvis A, Rao IM, Mosquera G, Bueno GM, Blair M (2011) Genetic improvement of common beans and the challenges of climate change. En: Yadav SS, Redden RJ, Hatfield JL, Lotze-Campen H, Hall AE (eds). Crop Adaptation to Climate Change, pp. 356-369. Blackwell Publishing, Richmond; ISBN: 978-0-8138-2016-3
Celik G, Turhan E (2013) Genotypic variation in growth and physiological responses of common bean (Phaseolus vulgaris L.) seedlings to flooding. African Journal of Biotechnology 10 (38): 7372-7380
Denbow DM, Ravindran V, Kornegay ET, Yi Z, Hulet RM (1995) Improving phosphorus availability in soybean meal for broilers by supplemental phytase. Poultry Science 74 (11): 1831-1842
Houimli SIM, Denden M, Mouhandes BD (2010) Effects of 24-epibrassinolide on growth, chlorophyll, electrolyte leakage and proline by pepper plants under NaCl-stress. EurAsia J BioSci 4: 96-104; doi: 10.5053/ejobios.2010.4.0.12
Hungria M, Kaschuk G (2014) Regulation of N 2 fixation and NO 3−/NH 4+ assimilation in nodulated and N-fertilized Phaseolus vulgaris L. exposed to high temperature stress. Environmental and Experimental Botany 98: 32-39; doi: 10.1016/j.envexpbot.2013.10.010
Kumar G, Purty RS, Sharma MP, Singla-Pareek SL, Pareek A (2009) Physiological responses among Brassica species under salinity stress show strong correlation with transcript abundance for SOS pathway-related genes. Journal of plant physiology 166 (5): 507-520; doi: 10.1016/j.jplph.2008.08.001
Li Z, Bian M, Wu Z, Zhang X, Yang Q, Huang C (2013) Isolation and drought-tolerant function analysis of ZmPti1-1, a homologue to Pti1, from maize (Zea mays L.). African Journal of Biotechnology 10 (27): 5327-5336
Nava SC (2013) Temperatura óptima y etapa fenológica para determinar la termoestabilidad de la membrana celular en maíz y frijol. Phyton (B Aires) 82 (2): 249-254
Porch TG, Dickson MH, Long MC, Viands DR, Jahn M (2004) General combining ability effects for reproductive heat tolerance in snap bean. The Journal of Agriculture of the University of Puerto Rico 88 (3-4): 161-164
Rahman H, Malik SA, Saleem M (2004) Heat tolerance of upland cotton during the fruiting stage evaluated using cellular membrane thermostability. Field Crops Research 85 (2): 149-158; doi: 10.1016/S0378-4290(03)00159-X
Ramírez JCR, Rangel IBEU (2011) El frijol (Phaseolus vulgaris): su importancia nutricional y como fuente de fitoquímicos. Revista Fuente 3 (8): 5-9
Reza MR, Iqbal TMT, Sarker S (2015) Quality assessment of bush bean (Phaseolus vulgaris L.) seeds using the controlled deterioration technique. International Journal of Biosciences 6 (2): 188-202
Schulze ED, Beck E, Muller-Hohenstein K (2005) Plant Ecology. Springer-Verlag Berlin Heidelberg, New Delhi; ISBN: 978-3-540-20833-4
Tawaraya K, Horie R, Saito S, Wagatsuma T, Saito K, Oikawa A (2014) Metabolite Profiling of Root Exudates of Common Bean under Phosphorus Deficiency. Metabolites 4 (3): 599-611; doi: 10.3390/metabo4030599
Torres S, Rodríguez M (2002) Manual de Prácticas de Fisiología Vegetal. Universidad Central Marta Abreu de Las Villas, Santa Clara
Recibido: 10-11-2015
Aceptado: 23-12-2015
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
