Artículo original
Biotecnología Vegetal Vol. 16, No. 1: 53 - 60, enero - marzo, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Diversidad de cepas bacterianas de la filosfera de Musa spp. con actividad antifúngica frente a Mycosphaerella fijiensis Morelet
Bacterial strains diversity in Musa spp. phyllosphere with antifungal activity against Mycosphaerella fijiensis Morelet
Mileidy Cruz-Martín1, Mayra Acosta-Suárez1, Berkis Roque1, Tatiana Pichardo1, Rosa Castro2, Yelenys Alvarado-Capó1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: mileidy@ibp.co.cu
2Facultad de Recursos Naturales, Departamento de Fitopatología, Escuela Superior Politécnica de Chimborazo (ESPOCH). Panamericana Sur km 1 ½. Riobamba. Chimborazo. Ecuador. CP 06-01-4703.
.
RESUMEN
La búsqueda de alternativas a los plaguicidas agrícolas que se emplean para el manejo de la Sigatoka negra (Mycosphaerella fijiensis Morelet) incluye la selección de cepas de microorganismos con potencial para el control de este patógeno. El objetivo del trabajo fue caracterizar cepas bacterianas aisladas de la filosfera de Musa spp. con efecto antifúngico frente a M. fijiensis. Se realizó una caracterización morfológica, cultural, fisiológica y molecular de las cepas y se cuantificó la actividad antifúngica de estas mediante cultivo dual. Se comprobó la diversidad de bacterias con propiedades antifúngicas frente a M. fijiensis presentes en la filosfera Musa spp. Además, se constató que la filosfera de estos cultivos puede utilizarse como fuente de obtención de posibles controles biológicos de M. fijiensis.
Palabras clave: bacterias, biocontrol, epifitos, Sigatoka negra
ABSTRACT
The search for alternatives to agricultural pesticides used for the management of black Sigatoka (Mycosphaerella fijiensis Morelet) includes the selection of microorganisms strains with potential for the control of this pathogen. The objective of the work was to characterize bacterial strains isolated from the phylosphere of Musa spp. with antifungal effect against M. fijiensis. A morphological, cultural, physiological and molecular characterization of the strains was performed and the antifungal activity of these strains was quantified by dual culture. It was verified the diversity of bacteria with antifungal properties against M. fijiensis present in the phylosphere of Musa spp. In addition, it was found that the phyllosphere of these crops can be used as a source of obtaining possible biological controls of M. fijiensis.
Key words: bacteria, biocontrol, Black Sigatoka, epiphytes
INTRODUCCIÓN
El control biológico para patógenos foliares, puede ser una alternativa complementaria dentro del manejo de enfermedades, la cual frecuentemente involucra la aplicación del microorganismo antagonista sobre la superficie de la hoja (Agrios, 2005). El uso de productos biológicos está encaminado además del propio control, lograr la seguridad alimentaria, al adquirir alimentos libre de sustancias tóxicas (Cawoy et al., 2011).
Sin embargo, el éxito de dicho antagonista depende de su capacidad para establecerse como miembro de la microbiota epifita, especialmente cuando se requiere disminuir el inóculo del patógeno (Marín et al., 2003). Por tal motivo, el uso de antagonistas microbianos nativos debería preferirse al uso de antagonistas aislados de otros ambientes, pues los primeros se encuentran adaptados a las condiciones que determinan el hábitat en la superficie de la hoja (Ceballos et al., 2012).
Las tendencias actuales en la búsqueda de alternativas a los plaguicidas agrícolas incluyen el aumento del uso de los procesos de selección para identificar cepas de microorganismos con potencial para el control de patógenos causantes de enfermedades. Esta etapa preliminar, podría proporcionar herramientas adicionales para las alternativas de manejo de enfermedades con productos biológicos que posean diferentes mecanismos de acción que los plaguicidas químicos (Alvindia, 2012).
Entre las enfermedades foliares más desbastadoras de los plátanos y bananos (Musa spp.) se encuentra la Sigatoka negra, causada por el ascomicete Mycosphaerella fijiensis Morelet. Está considerada la enfermedad más limitante de estos cultivos ya que reduce el rendimiento y la productividad dentro de la plantación (Churchill, 2011).
En la búsqueda de productos biológicos efectivos contra M. fijiensis se han estudiado diferentes microorganismos (bacterias y hongos) asociados a estos cultivos (Alvindia y Natsuaki, 2008; Ceballos et al., 2012). Por esta razón el objetivo del trabajo fue caracterizar fisiológica, bioquímica y molecularmente bacterias presentes en la filosfera de Musa con efecto antifúngico frente a M. fijiensis.
MATERIALES Y MÉTODOS
Cepas bacterianas
Para este estudio se emplearon 19 cepas bacterianas pertenecientes a la Colección de Cultivos Microbianos del Instituto de Biotecnología de las Plantas (IBP). Estas fueron aisladas de la filosfera de diferentes cultivares de Musa spp. y se seleccionaron por su actividad antifúngica in vitro frente a M. fijiensis (Poveda et al., 2010).
Caracterización cepas
Se realizó una caracterización morfológica, cultural, fisiológica y molecular de las cepas. Para ello se llevaron a cabo observaciones microscópicas, se describieron los caracteres culturales y se determinó la respuesta a pruebas bioquímicas de acuerdo con los protocolos descritos en el Bergey’s Manual of Systematic Bacteriology (Krieg y Holt, 1984; Krieg y Holt, 1986).
Para la caracterización molecular se empleó la técnica amplificación de la región 16S ribosomal Para la purificación del ADN genómico de los aislados bacterianos se empleó el protocolo propuesto por Pereira de Melo et al. (2009). Se utilizaron los cebadores 27F (5´AGAGTTTGATCMTGGCTCAG 3´) y 907R (5´CCGTCAATTCMTTTRAGTTT 3´) que amplifican regiones específicas de la subunidad 16S del ADN ribosomal.
El producto de la amplificación del gen de 16S fue aplicado en geles de agarosa 1%. Las bandas fueron purificadas con el uso del Kit GENECLEAN II (Q-BIOgene) y el ADN resultante se cuantificó en espectrofotómetro Nanodrop (Thermo scients). El amplicón fue secuenciado por Macrogen Inc. (Seoul, Korea) y con las secuencias obtenidas se realizó un árbol filogenético que fue elaborado mediante el método del vecino más cercano y las secuencias se agruparon juntas basado en un bootstrap de 1000. Las distancias evolutivas fueron calculadas mediante el método de Probabilidad Máxima Compuesta (Tamura et al., 2004) y utilizando el programa MEGA 7.0.14.
Cuantificación de la actividad antifúngica
Para la cuantificación de la actividad antifúngica de las cepas se empleó el método de cultivo dual y como inóculo fúngico se utilizaron suspensiones miceliares de M. fijiensis. Se prepararon placas de Petri (90.0 mm) como se describe a continuación. En un Erlermeyer con 200.0 ml de Agar Papa Dextrosa (PDA) (Fluka) fundido (~ 40 ºC) se añadieron 20.0 ml de una suspensión micelial de M. fijiensis (para una concentración final de 5.0x105 fragmentos de micelio ml-1). Se homogenizó la mezcla y se vertió en las placas de Petri. Cuando las placas estuvieron secas, se añadieron en el centro de la placa 7.0 µl de cada suspensión bacteriana (un cepa por placa de Petri) ajustada a DO600=0.1 (Eppendorf Biophotometer), a partir de cultivos bacterianos de 24 horas de crecidos en Agar nutriente (Biocen). Como control se emplearon 7 µl de agua desionizada estéril en lugar de la suspensión bacteriana. Las placas se incubaron a 28ºC durante 72 horas.
La evaluación se realizó mediante la medición del halo de inhibición (mm) del crecimiento del patógeno a las 72 horas de incubación. Se emplearon tres réplicas por cada cepa bacteriana y el ensayo se repitió tres veces. Los valores obtenidos fueron analizados estadísticamente mediante las pruebas de Kruskal-Wallis y Mann Whitney, previa comprobación de los supuestos de normalidad y heterogeneidad de varianza.
RESULTADOS Y DISCUSIÓN
A partir de la caracterización de las bacterias antagonistas aisladas de la filosfera de Musa spp. se pudo comprobar la diversidad presente entre estas cepas que poseen actividad antifúngica frente a M. fijiensis.
Se identificaron tres familias Bacillaceae, Pseudomonadaceae y Micrococcaceae. Predominaron los bacilos esporulados (Bacillus) (52.6%) y otro 31.5% de las cepas se agruparon como otros bacilos Gram+ no formadores de esporas. Entre las características distintivas de las cepas analizadas estuvo su diversidad metabólica ya que fueron capaces de degradar in vitro varios sustratos tales como caseína (63%) gelatina (53%) y almidón (11%). Las características principales de cada una de las cepas se presentan en las tablas 1, 2, 3 y 4.

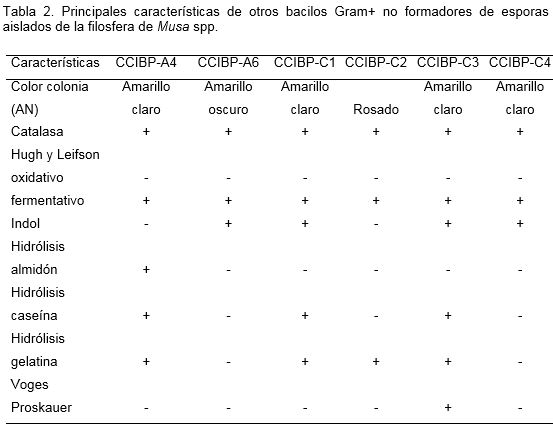

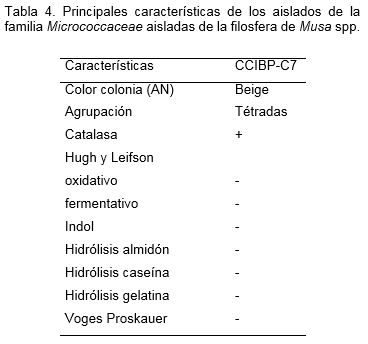
La preponderancia del género Bacillus, en la superficie de hojas de Musa spp. bajo las condiciones de cultivo en Cuba coinciden con los resultados referidos por Ceballos et al. (2012) en Urabá, Colombia. Estos autores encontraron que el 44% del total de las bacterias cultivables, pertenecían al grupo de bacterias aeróbicas formadoras de endosporas. La presencia de estas estructuras y la producción de sustancias con actividad antifúngica puede ser la causa del predominio de cepas pertenecientes al género Bacillus. Estas características les permiten la subsistencia y competencia en condiciones ambientales desfavorables (Todar, 2003). Según Setlow (2006), la formación de una espora genera un tipo de células que pueden sobrevivir durante largos períodos de tiempo con poco o nada de nutrientes y le confieren resistencia a la radiación, el calor y productos químicos. También su actividad antimicrobiana puede estar dada por la producción de péptidos antimicrobianos (Arguelles-Arias et al., 2009), enzimas líticas como glucanasas y quitinasas (Rao-Podile y Neeraja, 2011) y lipopéptidos. Los bioproductos basados en Bacillus son ampliamente empleados en la agricultura convencional y representan la clase más importante de productos viables para el uso fitosanitario (Pérez-García et al., 2011). Según Cawoy et al. (2011) entre los bioproductos disponibles en el mercado formulados a partir de bacterias, la mayoría de ellos contienen especies de Bacillus.
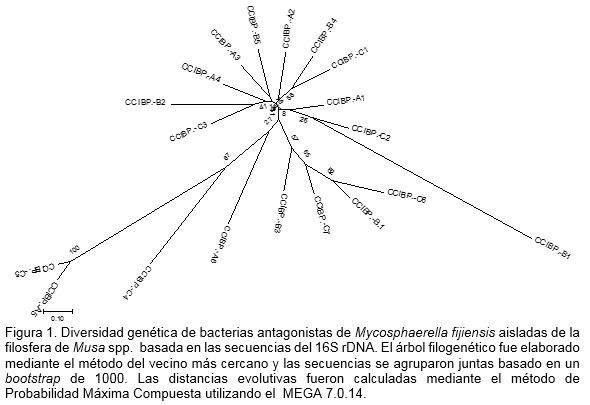
Mediante el análisis molecular se logró la amplificación del ADN bacteriano y se corroboró la diversidad bacteriana presentes en la filosfera de Musa spp. (Figura 1). Autores como Yang et al. (2001) demostraron con estudios que no requieren el cultivo del microorganismo, que los habitantes de las hojas son mucho más diversos que lo predicho por los estudios tradicionales. Sumado a esto, Yadav et al. (2010) y Zhang et al. (2010) en análisis de las comunidades bacterianas de la filosfera de plantas han revelado que estas son diversas tanto cuantitativa como cualitativamente.
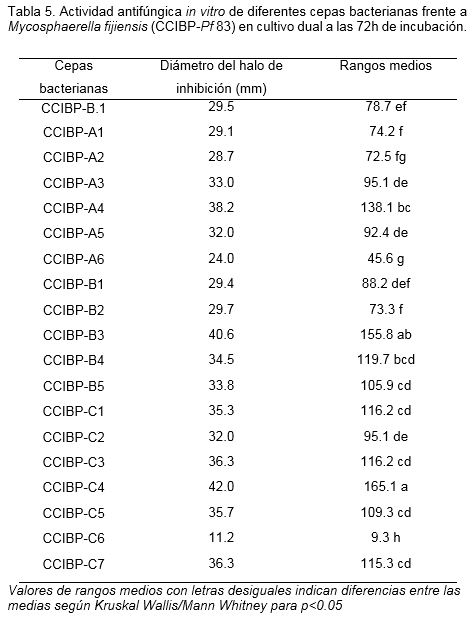
El método de cultivo dual empleado permitió cuantificar la actividad antifúngica in vitro de las cepas bacterianas frente M. fijiensis CCIBP-Pf-83 (Figura 2).

En cuanto a la actividad antifúngica, propiedad que fue utilizada como criterio de selección, también se observaron diferencias significativas entre las cepas mediante el método de evaluación empleado (Tabla 5).
Se observaron halos de inhibición bien definidos a las 72 horas de incubación y estos oscilaron entre 11.2 y 42.0 mm. Mediante esta técnica se pudieron observar diferencias entre las cepas en cuanto a la actividad antifúngica in vitro y corroborar los resultados anteriores sobre la diversidad de las bacterias presentes en la filosfera de bananos (Ceballos et al., 2012). Incluso, dentro de una misma familia se observaron diferencias significativas en cuanto al diámetro del halo de inhibición, de ahí la importancia de realizar este tipo de determinaciones cuantitativas para la selección de cepas.
Teniendo en cuenta los resultados de la caracterización de las cepas bacterianas tanto bioquímica, fisiológica, molecularmente así como de su actividad antifúngica se pudo constatar la diversidad existente en las bacterias presentes en la filosfera de Musa spp., que poseen actividad antifúngica frente a M. fijiensis. Estos resultados coinciden con los referidos por otros autores como Osorio et al. (2004) para las condiciones de cultivo en Colombia.
Los resultados alcanzados en este trabajo reafirman, además, lo planteado por Redford et al. (2010) acerca de que las bacterias presentes en la filosfera no son simples habitantes de la superficie de las hojas sino que están íntimamente relacionadas con las plantas que colonizan y tienen una influencia directa o indirecta en la composición de microorganismos asociados al cultivo. Es por ello que la filosfera de Musa spp. puede constituir una fuente importante de obtención de bacterias con características promisorias para el control biológico de M. fijiensis. Un conocimiento exhaustivo de estos microorganismos, sus características y su relación con M. fijiensis y la planta permitirá la elaboración de bioproductos eficientes para el control de esta enfermedad.
CONCLUSIONES
Las bacterias antagonistas de Mycosphaerella fijiensis aisladas de la filosfera de Musa spp. son diversas en caracteres morfológicos, culturales y fiisiológicos con presencia de representantes de tres familias y predominio del género Bacillus. Pueden constituir una fuente importante de candidatos para la elaboración de productos biológicos que puedan insertarse en el manejo de la enfermedad.
REFERENCIAS
Agrios GN (2005) Plant Pathology. Academia Press, New York; ISBN: 0-12-044565-4
Alvindia DG (2012) Inhibitory influence of biocontrol agents, plant oils, and an inorganic salt on Mycosphaerella fijiensis and Cordana musae. African Journal of Microbiology Research 6(19): 3690-3695; doi: 10.5897/AJMR12.175
Alvindia DG, Natsuaki KT (2008) Evaluation of fungal epiphytes isolated from banana fruit surfaces for biocontrol of banana crown rot disease. Crop Protection 27 (8):1200–1207; doi: 10.1016/j.cropro.2008.02.007
Arguelles-Arias A, Ongena M, Halimi B, Lara Y, Brans A, Joris B, Fickers P (2009) Bacillus amyloliquefaciens GAI as a source of potent antibiotics and other secondary metabolites for biocontrol of plan pathogens. Microbial Cell Factories 8 (63): 1-12; doi: 10.1186/1475-2859-8-63
Cawoy H, Bettiol W, Fickers P, Ongena M (2011) Bacillus-based biological control and plant diseases. En: Stoytcheva M (ed). Pesticides in the modern world, pesticides use and management, pp. 273-303. InTech Europe, Croacia; ISBN: 978-953-307-459-7
Ceballos I, Mosquera S, Angulo M, Mira J, Argel L, Uribe-Velez D, Romero-Tabarez M, Orduz-Peralta S, Villegas V (2012) Cultivable bacteria populations associated with leaves of banana and plantain plants and their antagonistic activity against Mycosphaerella fijiensis. Microb Ecol 64: 641–653; doi: 10.1007/s00248-012-0052-8
Churchill A (2011) Mycosphaerella fijiensis, the black leaf streak pathogen of banana: progress towards understanding pathogen biology and detection, disease development, and the challenges of control. Molecular Plant Pathology 12 (4):307-328; doi: 10.1111/J.1364-3703.2010.00672.X
Krieg NR, Holt J (1984) Bergey's Manual of Systematic Bacteriology. Williams & Wilkins, New York; ISBN: 0683041088
Krieg NR, Holt J (1986) Bergey's Manual of Systematic Bacteriology. Williams & Wilkins, Baltimore; ISBN: 0683078933
Marín DH, Romero RA, Guzman M, Sutton TB (2003) Black Sigatoka: an increasing threat to banana cultivation. Plant Disease 87(3):208-222; doi: 10.1094/PDIS.2003.87.3.208
Osorio I, Patiño LF, Bustamante E, Rodríguez PA (2004) Selección y evaluación de bacterias quitinolíticas provenientes de la zona de Urabá para el control de la Sigatoka negra. Boletín Técnico de Cenibabano (Medellín) 6:8-13
Pereira de Melo F, Fiore M, de Moraes L, Silva-Stenico M, Scramin S, Teixeira M, de Melo I (2009) Antifungal compound produced by the Cassava endophyte Bacillus pumilus MAIIIM4A. Sci Agric 66(5):583-592; doi: 10.1590/S0103-90162009000500002
Pérez-García A, Romero D, Vicente A (2011) Plant protection and growth stimulation by microorganisms: biotechnological applications of Bacilli in agriculture. Current Opinion of Biotechnology 22 (2):187-193; doi: 10.1016/j.copbio.2010.12.003
Poveda I, Cruz-Martín M, Sánchez-García C, Acosta-Suárez M, Leiva-Mora M, Roque B, Alvarado-Capó Y (2010) Caracterización de cepas bacterianas aisladas de la filosfera de Musa spp. con actividad antifúngica in vitro frente a Mycosphaerella fijiensis. Biotecnología Vegetal 10 (1): 57 – 61
Setlow P (2006) Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. Journal of Applied Microbiology 101(3): 514-525; doi: 10.1111/j.1365-2672.2005.02736.x
Tamura K, Nei M, Kumar S (2004) Prospects for inferring very large phylogenies by using the neighbor-joining method. Proc Nat Acad Sci 101 (30):11030-11035; doi:10.1073/pnas.0404206101
Todar K (2003) The genus Bacillus. University of Winconsin-Madison Department of Bacteriology, Madison
Rao-Podile A, Neeraja Ch (2011) Microbial chitinases as potential biopesticides. En: Reddy VD, Rao PN, Rao KV (eds). Pest and Pathogens: Management Strategies, pp. 275-300. CRC Press, Leiden; ISBN: 9780415665766
Redford A, Bowers R, Knight R, Linhart Y, Fierer N (2010) The ecology of the phyllosphere: geographic and phylogenetic variability in the distribution of bacteria on tree leaves. Environmental Microbiology 12(11): 2885–2893; doi: 10.1111/j.1462-2920.2010.02258.x
Yadav R, Karamanoli K, Vokou D (2010) Estimating bacterial population on the phyllosphere by serial dilution plating and leaf imprint methods. ECOPRINT 17: 47-52
Yang C-H, Crowley DE, Morneman J, Keen NT (2001) Microbial phyllosphere populations are more complex than previously realized. Proc Nat Acad Sci 98 (7): 3889-3894; doi: 10.1073/pnas.051633898
Zhang B , Bai Z, Hoefel D , Wang X , Zhang L, Li Z (2010) Microbial diversity within the phyllosphere of different vegetable species. En: Mendez-Vilas A (ed). Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology, pp.1067–1077. Formatex Research Center, Badajoz
Recibido: 20-09-2015
Aceptado: 05-12-2015
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
