Artículo original
Biotecnología Vegetal Vol. 16, No. 2: 67 - 72, abril - junio, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Establecimiento in vitro de brotes de Vasconcellea x helbornii (Badillo) Badillo
In vitro establishment of Vasconcellea x helbornii (Badillo) Badillo shoots
Mónica Jadán Guerrero1,2, Karem Basantez3, Rafael Gómez-Kosky2, Idalmis Bermúdez-Caraballoso2
1Departamento de Ciencias de la Vida, Universidad de las Fuerzas Armadas ESPE. Ave Gral Rumiñahui. Sangolquí. Quito. Ecuador. PO BOX 171-5-31B.
e-mail: mbjadan@espe.edu.ec, monica@ibp.co.cu
2Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
3 Universidad de las Américas. Ave de los Granados y Colimes esq Quito. Quito. Ecuador.
RESUMEN
El babaco [Vasconcellea x helbornii (Badillo) Badillo] es una especie de importancia comercial en Ecuador. El presente trabajo tuvo como objetivo establecer in vitro de brotes de yemas axilares a partir de plantas madre de babaco mantenidas en casa de cultivo. A las plantas se les aplicó Carbendazim y el bioestimulante (GERMO-TB01). Para la desinfección de los explantes se evaluaron tres concentraciones de Hipoclorito de Sodio (1, 1.5 y 2%) durante dos tiempos (5 y 10 minutos). Además, se determinó el efecto del uso de Gentamicina 50 mg l-1 y Estreptomicina 25 mg l-1 en el medio de cultivo. Los mejores resultados se alcanzaron al utilizar el Hipoclorito de Sodio al 1.5% durante 10 minutos y la inmersión en una solución con los dos antibióticos por 3 horas. Se logró un 68.5% de establecimiento in vitro de los brotes a los 21 días de cultivo. Los resultados contribuirán a la propagación masiva in vitro de este híbrido.
Palabras clave: babaco, desinfección, mezcla de antibióticos, micropropagación
ABSTRACT
Babaco [Vasconcellea x helbornii (Badillo) Badillo] is a specie of commercial importance in Ecuador. The present work aimed to establish in vitro shoots of axillary buds from mother plants of babaco kept in greenhouse. Carbendazim and the biostimulant (GERMO-TB01) were applied to the plants. For the disinfection of the explants, three concentrations of Sodium Hypochlorite (1, 1.5 and 2%) were evaluated during two times (5 and 10 minutes). In addition, the effect of the use of Gentamicin 50 mg l-1 and Streptomycin 25 mg l-1 in the culture medium was determined. The best results were achieved by using 1.5% Sodium Hypochlorite for 10 minutes and immersion in a solution with both antibiotics for 3 hours. A 68.5% in vitro establishment of the shoots was achieved at 21 days of culture. The results will contribute to in vitro mass propagation of this hybrid.
Key words: antibiotic mixture, babaco, disinfection, micropropagation
INTRODUCCION
El babaco [Vasconcellea x helbornii (Badillo) Badillo] ha sido considerada como híbrido natural proveniente del cruce de las especies V. pubescens (chamburo) y V. stipulata (toronche) (Lim, 2012).
El babaco ha sido introducido en países como Nueva Zelanda, Australia, Italia, España, Francia, Sur de África, Suiza, Canadá y Países Bajos en ensayos de invernadero (Scheldemanet al., 2003). Sin embargo, el principal problema en el cultivo, producción y comercialización del babaco es su forma de reproducción que se limita a la siembra de estacas. Esta vía de propagación tiene, entre otras dificultades, la baja capacidad de enraizamiento del material vegetal (AAIC, 2003). Además, hasta el momento, no existe un protocolo para la obtención de plantas libres de patógenos y su propagación a gran escala. Por tal motivo, la propagación in vitro de este híbrido ha sido presentado como un método alternativo para su propagación masiva.
Solo dos informes se han realizado hasta la fecha sobre la micropropagación de esta especie a partir del cultivo de ápices (Cohen y Cooper, 1982) y de yemas axilares (Cossio, 1988) sin embargo muestran pocos detalles del proceso realizado.
En el babaco, al igual que en papaya (Carica papaya L.), uno de los principales problemas en la fase de establecimiento del cultivo in vitro, cuando se emplean plantas adultas cultivadas en campo, es el alto porcentaje de contaminación microbiana. Esto no ha permitido el desarrollo del explante in vitro para su propagación (Quillay, 2011).
En la familia Caricaceae, la contaminación microbiana, sobre todo por bacterias, es uno de los problemas críticos. Sin embargo, Posada et al. (2004), alcanzaron un 68.5% de brotes establecidos a partir de plantas de campo, en un híbrido obtenido por cruzamiento tradicional con el uso de antibióticos.
En base a esta problemática se desarrolló la presente investigación con el objetivo de establecer in vitro brotes de yemas axilares a partir de plantas madre de babaco mantenidas en casa de cultivo.
MATERIALES Y METODOS
Material vegetal
Plantas madre de cinco meses de cultivo bajo condiciones semicontroladas (casa de cultivo), crecidas en bolsas de polietileno de 15 x 10 cm con capacidad para 1 kg de sustrato formado por suelo de la zona (franco arenoso arcilloso), humus de lombriz y pomina en proporción 3:1:1 (Cevallos y Ramos, 1990), desinfectado con anterioridad. Se realizaron riegos dos veces por semana, la temperatura osciló entre 15-23°C, con una humedad relativa de 40-50% y la intensidad de luz se controló con el uso de una malla sombra (50%) o sarán. Además, se realizaron aplicaciones del fungicida Carbendazim 0.5% (v/v) (Nufarm, EUA) y el bioestimulante GERMO-TB01 (GermoplantaCia. Ltda, Quito, Ecuador) 1.0 ml l-1. Las aplicaciones se realizaron por aspersión en el área foliar cada 2 días.
Desinfección
Se seleccionaron brotes de yemas axilares con un tamaño aproximado de tres a cinco centímetros que se cortaron con la ayuda de una tijera de podar previamente desinfectada con etanol al 70%.
En condiciones de laboratorio se realizaron los diferentes pasos del procedimiento de desinfección. Primero, lavado con agua común bajo el grifo durante dos horas. Después, lavado en una solución jabonosa (Jabón Protex) 3.0 ml l-1 durante 15 minutos en agitación a 90 rpm con un agitador orbital SHO-1D (Wisd Laboratory Instruments, Alemania). Inmediatamente, se realizaron tres lavados con agua destilada estéril. A continuación fueron sumergidos en una solución del fungicida DORBAQ (LONZA Inc., EUA) 6.0 ml l-1 por 30 minutos en agitación a igual velocidad y en equipo anteriormente referido. Se realizó un lavado con agua destilada estéril, para seguir con los diferentes tratamientos de desinfección.
Efecto del hipoclorito de sodio
Este experimento tuvo como objetivo determinar el efecto de diferentes concentraciones de Hipoclorito de Sodio (NaClO) en la desinfección de los brotes. Se evaluaron tres concentraciones 1.0, 1.5 y 2.0% (v/v) de NaClO, durante dos tiempos de exposición 5 y 10 min. Los explantes se mantuvieron en agitación como se describió anteriormente. A todos los tratamientos se le adicionaron de dos a cinco gotas de Tween 20.
Efecto de antibióticos
Este experimento tuvo como objetivo determinar el efecto la aplicación de antibióticos en la desinfección de los brotes. A partir de los resultados del experimento anterior y de acuerdo con los resultados alcanzados por Posada et al. (2004), en el establecimiento in vitro de un híbrido de papaya, después de la desinfección se sumergieron los explantes en una solución acuosa que contenía los antibióticos Sulfato de Gentamicina (50 mg l-1) y Estreptomicina (25 mg l-1) (Sigma-Aldrich, EUA) por 3 horas. Como control se siguió el mismo procedimiento sin sin la mezcla de antibióticos.
En ambos experimentos, dentro de la cámara de flujo laminar, se realizaron tres lavados con agua destilada estéril y los brotes fueron reducidos a un tamaño de 2.0 cm. Se utilizaron 20 brotes por tratamiento como repetición, los cuales se colocaron en tubos de ensayo (145.0 x 25.0 mm) con 10 ml de medio de cultivo semisólido compuesto por las sales de Cohen y Cooper (1982), a las que se le adicionaron 2.0 mg l-1 de 6-bencil aminopurina (6-BAP) y 0.1 mg l-1 de ácido naftalen-acético (ANA), maltosa 2.0 g l-1 y fue solidificado con 7.5 g l-1 de BACTOTM AGAR (Becton y Dickinson Co, EUA). El pH del medio de cultivo fue 5.8 previo a la esterilización por autoclave. Se cuantificó el número de explantes contaminados por bacterias y hongos filamentosos y se calculó el porcentaje de contaminación microbiana a las 72 horas. Además, a los 21 días después del establecimiento in vitro se cuantificó el número de brotes con necrosis y los explantes viables y se calculó el porcentaje.
Condiciones de cultivo
Los explantes fueron colocados en cámara de cultivo a 20±2ºC, estantes con tubos fluorescentes de luz blanca con un fotoperiodo de 12 horas luz, con una densidad de flujo de fotones fotosintéticos de 16.8 µmol m-2 s-1. La humedad relativa en el cuarto de cultivo fue 50%.
Análisis estadístico
Para los análisis estadísticos en las variables expresadas en porcentaje se utilizó el paquete estadístico STATISTICA versión 12.0 y se determinó la diferencia entre los valores mediante la prueba de comparación de proporciones para dos muestras. En todos los casos las diferencias se establecieron para p<0.05.
RESULTADOS Y DISCUSIÓN
Con los resultados alcanzados en este experimento se pudo constatar que la contaminación bacteriana resultó un punto crítico en el establecimiento in vitro de brotes de babaco. Con la concentración de hipoclorito de sodio de 1.5%, durante un tiempo de exposición de 10 minutos, se redujo en un 55% la contaminación por bacterias y 3.0% por hongos, lo cual demuestra la efectividad de este tratamiento, a pasar de que se observó un 10% de ápices necrosados (Tabla 1). Cabe señalar el efecto positivo del pretratamiento a las plantas madre con el fungicida Carbendazim, dos semanas previas a la toma de los ápices en el proceso de desinfección con solución del fungicida DORBAQ. Sin embargo, aún 45% de brotes establecidos, requiere continuar mejorando los procedimientos para proponer una metodología para la desinfección y el establecimiento in vitro más eficiente.
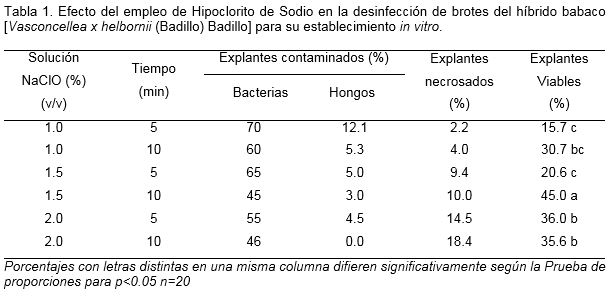
En el establecimiento in vitro de plantas, el hipoclorito de sodio es una de las soluciones más utilizadas para la desinfección de los explantes. Autores como Rebolledo et al. (2006) y Hernández y González (2010) utilizaron hipoclorito de sodio para la desinfección de explantes de plantas leñosas y frutales, obtuvieron bajos porcentajes de contaminación microbiana y no se observó un grado importante de oxidación del explante. No obstante, es necesario tener en cuenta que a medida que se aumentaron las concentraciones de hipoclorito de sodio al igual que el tiempo de exposición, los explantes comenzaron a presentar necrosis, sobre todo en los sitios en donde los tejidos son más sensibles (hojas) y donde se realizaron los cortes con el bisturí, esto se traduce en un futuro necrosamiento y muerte celular.
En igual sentido, Landázuri y Tigrero (2009) en Stevia rebaudiana Bertoni, refirieron que las altas concentraciones de las soluciones desinfectantes influyeron en la supervivencia de los explantes. Aquellos que se afectaron tuvieron una menor respuesta en el medio de cultivo, inicialmente mostraron necrosis y posteriormente murieron.
Por otra parte, Jordan (2011) en la especie Vasconcellea chilensis Planch. ex A. DC informó del uso de hipoclorito de sodio a 0.25% (v/v) durante 5 minutos para la desinfección de explantes de secciones nodales de plantas adultas. Previamente realizó varios pasos del proceso que incluyeron dos tipos de fungicidas (Triadimefon y Captan) pero no refiere los porcentajes de viabilidad alcanzados.
Más recientemente, Vélez-Mora et al. (2015) para lograr la germinación de semillas de Vasconcella stipulata Badillo, después de los tratamiento con sustancias que estimularan la germinación, emplearon para el proceso de desinfección hipoclorito de sodio al 1.0% (v/v) durante 5 minutos. Estos autores alcanzaron un 53% de semillas establecidas en el medio de cultivo Murashige y Skoog (1962) a los seis meses de cultivo.
El uso de antibióticos para la desinfección de brotes del híbrido de babaco el porcentaje de establecimiento. La contaminación bacteriana se redujo a solo 14.8% y alcanzó una viabilidad del 68.5% (Tabla 2).
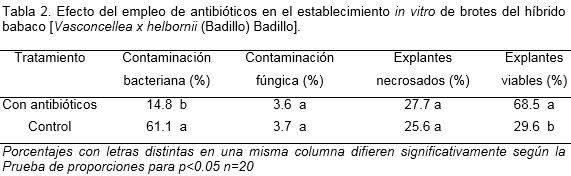
En los explantes tratados con antibióticos, al igual que Posada et al. (2004) en el híbrido IBP 42-99 de papaya (Carica papaya L.), no se evidenciaron síntomas de fitotoxicidad. Sin embargo, cuando el explante permaneció por un período de tiempo prolongado en hipoclorito de sodio, éste causó mayor daño al tejido. También las concentraciones de antibióticos sugeridas por estos autores, fueron adecuadas para disminuir los porcentajes de contaminación bacteriana en los explantes del híbrido babaco, con resultados muy similares en el presente trabajo.
También, Wu et al. (2012) emplearon antibióticos (Rifampicina o gentamicina) o la combinación de ambos, para eliminar la contaminación bacteriana en el cultivo in vitro de explantes provenientes de plantas hermafroditas de papaya y alcanzaron valores altos de establecimiento (78%).
El uso de antibióticos en babaco, no sólo se limita al cultivo in vitro, sino que se utiliza a nivel de campo para el control de enfermedades causadas por bacterias del género Agrobacterium, como es el caso de la enfermedad llamada “pata de elefante” o coliflor, la cual se presenta como un sobrecrecimiento de la base del tallo o en sus secciones (Fabara et al., 1985; AAIC, 2003).
El establecimiento de plantas leñosas o semileñosas en el cultivo in vitro es un paso difícil. Sin embargo, en el presente trabajo fue posible alcanzar resultados positivos con el proceso de desinfección y el uso de antibióticos. La desinfección de los explantes es un paso esencial para el éxito del cultivo in vitro. La contaminación microbiana puede originarse por microorganismos que vienen adheridos a la superficie del explante o por fallas en los procedimientos de trabajo en el laboratorio. El mantenimiento de plantas donadoras bajo condiciones de invernadero o vivero y pretratamiento con sustancias antimicrobianas disminuyen los procesos de infección. Ello permite lograr el establecimiento de cultivos axénicos y fisiológicamente vigorosos con los cuales iniciar el proceso de multiplicación in vitro. La superficie de los tejidos de las plantas constituyen un hábitat para los microorganismos, estos pueden alojarse en estomas, lenticelas o cualquier otra abertura natural, lo cual dificulta en extremo su eliminación. Los problemas más frecuentes son: infecciones debido a la superficie pilosa, bacterias endógenas y el daño a los explantes debido a la oxidación fenólica (Battistini y De Paoli, 2007).
A los 21 días de establecidos los brotes presentaron buen crecimiento y formación de varias hojas, con los cual estaban listos para pasar a la fase de multiplicación in vitro (Figura 1).

CONCLUSIONES
Las investigaciones realizadas en este trabajo permitieron lograr un 68.5% de establecimiento in vitro de brotes del híbrido babaco. Esto se logró a través de una técnica reproducible, con el empleo de brotes de yemas axilares de plantas madre crecidas en casa de cultivo. Los resultados contribuirán a la propagación masiva de este híbrido.
REFERENCIAS
AAIC (2003) El cultivo de babaco en invernadero (Carica pentagona). Abya Yala, Quito
Battistini A, De Paoli G (2002) Large-scale micropropagation of several peach rootstocks. Acta Horticulturae 592:29-33
Cohen D, Cooper PA (1982) Micropropagation of babaco a Carica hybrid from Ecuador. En: Fujiwara A (ed) 5th Intl Congr Plant Tissue and Cell Culture Japan, pp. 743-744. Tokyo
Coppens DG, Drew R, Kyndt T, Scheldeman X (2014) Genetics and genomics of papaya. En: Ming R, Moore P H (eds) Plant Genetics and Genomics: Crops and Models 10, pp. 47-79. Springer, New York
CORPEI (2006) Babaco. Disponible en: http://www.sierraexportadora.gob.pe/datasiex/dctos/estudios_mercado/Babaco_2006.pdf. Consultado 21/07/ 2015
Corteza J (2013) Información sobre el Babaco. Disponible en: http://rifruco.blogspot.com/p/informacion-de-la-fruta.html. Consultado 25/07/2015
Cossio F (1988) Ilbabaco. Edagricole, Bologna
Fabara J, Bermeo N, Berberán C (1985) Manual del Cultivo del Babaco. Grupo Esquina editores – diseñadores SA Impreseñal Cia Ltda, Ambato
Hernández H, Dallos M (2012) Establecimiento de un protocolo de propagación de Gulupa (Passiflora edulis SIMS) a partir de embriones cigóticos y yemas axilares. Agron 20 (2):53- 64
Hernández Y, González ME (2010) Efectos de la contaminación microbiana y oxidación fenólica en el establecimiento in vitro de frutales perennes. Cultivos Tropicales 31(4): 1-5
Jordan M (2011) In vitro morphogenic responses of Vasconcellea chilensis Planch. ex A. DC (Caricaceae) Agronomía Colombiana 29 (3): 481-485
Kitto SL (1997) Commercial micropropagation. Hort Science 32(6):310-325
Landázuri PA, Tigrero JO (2009) Stevia rebaudiana Bertoni, una planta medicinal. ESPE, Sangolquí
Lim TK (2012) Edible Medicinal and Non-Medicinal Plant. Springer, New York; ISBN 9048186617
Muñoz C (1986) Propagación del babaco (Carica x heilbonii Badillo nm pentagona (Heilborni Badillo) Mediante estacas apicales herbáceas. Agricultura Técnica 46 (4): 513-514
Murashige T, Skoog FM (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15:473-479
Posada L, Gómez R, Gallardo J, Reyes M, Herrera I (2004) Establecimiento in vitro de ápices de plantas de campo del híbrido cubano de Papaya IBP 42-99. Biotecnología Vegetal 4 (3): 153-158
Pro-Agro E (2007) Fitoquímica y Agroindustrialización de dos genotipos de Vasconcellea, chamburo (Vasconcellea cundinamarcensis V. Badillo) y toronche (Vasconcellea stipulata V. Badillo). Sangolqui, Quito
Quillay N (2011) Determinación de la capacidad embriogénica de babaco (Vasconcellea x heilbornii) a partir de óvulos y hojas multiplicados in vitro vía embriogénesis somática. Tesis presentada para la obtención del Grado Académico de Magister en Gestión de la Producción de Flores y Frutas Andinas para Exportación, Universidad Técnica de Ambato, Ambato, Ecuador
Rebolledo V, Aparicio A, Cruz H (2006) Estudio preliminar para la propagación in vitro de dos especies de pinos. Foresta Veracruzana 8(2): 27-32
Scheldeman X, Romero J, Van Damme V, Heyens V, Van Damme P (2003) Potencial de papayas de altura (Vasconcella spp.) en el sur del Ecuador. Lyonia 5(1): 73-80
Soria N, Viteri P (1999) Guía para el cultivo de babaco en el Ecuador. Revista del Instituto Nacional de Investigaciones Agropecuarias 33(9): 35-38
Vélez-Mora DP, Armijos GR, Jordán MZ (2015) Enhancement of germination, hyperhydricity control and in vitro shoot formation of Vasconcellea stipulata Badillo. Revista Colombiana de Biotecnología XVII (2):16-21
Wu K, Zeng S, Chen Z, Duan J (2012) In vitro mass propagation of hermaphroditic Carica papaya cv. Meizhonghong. Pak J Bot 44(5):1669-1676
Recibido: 08-12-2015
Aceptado: 25-02-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
