Artículo original
Biotecnología Vegetal Vol. 16, No. 2: 73 - 82, abril - junio, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Establecimiento in vitro del portainjertos híbrido ‘Garfi x Nemared’ para durazno
In vitro establishment of the hybrid rootstock ‘Garfi x Nemared’ (Garnem) for peach
Limberg Guevara Salguero1, Giorjan Arnulfo Arancibia Padilla1, Samuel Sala Limachi1, Andy Aguilar Flores1, Faride Tirado Banuz2, Rafael Gómez-Kosky3
1Laboratorio de Biotecnología Agroforestal, Asociación Bolivian Cactus. Cantón Pulquina Abajo, Carretera Vieja a Cochabamba km 256. Comarapa. Departamento Santa Cruz. Bolivia.
2ONG Green Cross Bolivia. Calle 3 este, lado de la Capilla El Carmen Zona Norte. El Remanso, Santa Cruz de la Sierra. Departamento Santa Cruz. Bolivia.
3Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: kosky2015@gmail.com
RESUMEN
El híbrido interespecífico ‘Garfi x Nemared’ (Prunus dulcis (Mill) D.A.Webb x Prunus persica (L.) Batsch.) ha alcanzado gran importancia como portainjertos para durazno en Bolivia, pero la propagación por métodos tradicionales ha sido difícil. El presente estudio tuvo como objetivo establecer in vitro este híbrido. Se emplearon como explantes iniciales segmentos nodales de plantas madre que crecieron en condiciones controladas de cultivo y a las cuales se aplicó pretratamiento con fungicida y fertilizante. Para la desinfección fueron ensayadas dos concentraciones de hipoclorito de sodio (0.5 y 0.75%) y dos tiempos (10 y 12 min). El mayor porcentaje de establecimiento (79.5%) fue logrado con 0.75% de NaClO durante 12 min, en un medio de cultivo MS libre de reguladores del crecimiento. Se alcanzó un 100% de control de la oxidación de los fenoles con la combinación de plantas madre crecidas bajo 50% de sombra, yemas jóvenes, el uso de 150 mg l-1 ácido cítrico al final de la desinfección y en el medio de cultivo y posteriormente colocar los tubos de ensayo con los segmentos nodales una semana en condiciones de oscuridad.
Palabras clave: cultivo de tejidos, híbrido interespecífico, Prunus
ABSTRACT
The interspecific hybrid between almond and peach, ‘Garfield x Nemared’ (Prunus dulcis (Mill) D.A.Webb x Prunus persica (L.) Batsch.) has become very important as rootstocks for peach in Bolivia, but propagation by traditional methods of this hybrid has been very difficult. In the present study the aim was to in vitro establishment of this hybrid. As initial explants, nodal segments from mother plants, growing under controlled culture conditions, were used. For disinfection two concentrations of sodium hypochlorite (0.5 and 0.75%) and time (10 and 12 min) were tested. The greatest percentage of establishment was achieved using 0.75% NaClO for 12 min in an MS culture medium free of growth regulators. A 100% control of the phenols oxidation was achieved with the combination of mother plants growing under 50% shade, young buds, use of 150 mg l-1 citric acid at the end of the disinfection process and into the culture medium and then place the test tubes with the nodal segments one week in the dark.
Keywords: interspecific hybrid, Prunus, tissue culture
Introducción
La producción y consumo de frutas a nivel internacional tiende a crecer a un ritmo acelerado de acuerdo con la demanda de los mercados. La producción se centra en países como China e India. A nivel latinoamericano, se destacan Brasil, Argentina y Chile; de los cuales los dos últimos países son proveedores de frutas frescas a Bolivia (Kempff et al., 2015).
En Bolivia, la producción frutícola se encuentra localizada principalmente en los valles interandinos de los departamentos de La Paz, Tarija, Chuquisaca, Potosí, Santa Cruz y Cochabamba. Estos valles conforman microrregiones con características de clima y suelo, aptas para la producción de frutales, en particular, el durazno (Prunus pérsica (L.) Batsch.) (Coca, 2011). En el departamento de Santa Cruz, la provincia de Vallegrande es considerada la principal productora de frutales caducifolios y en específico el durazno (Kempff et al., 2015).
El material vegetal que se ha propagado asexualmente para uso de portainjertos de durazno, es el conocido como cultivar ‘Criollo’. Sin embargo, en los últimos años es el cv. híbrido ‘Garfi x Nemared’ (Prunus dulcis (Mill) D.A.Webb x Prunus persica L. Batsch.), conocido como GxN 15 que gradualmente se está convirtiendo en el principal portainjertos para el durazno en Bolivia debido a las características que presenta de buena adaptación a las condiciones de suelos de los valles, vigor elevado, rápida entrada en producción y tolerancia a la sequía (Centella et al., 2011).
El portainjertos ‘GXN 15’, llamado también ‘Garnem’ fue obtenido en España por el Servicio de Investigación Agraria de la Diputación General de Aragón, Zaragoza. Es un híbrido entre almendro (Prunus dulcis (Mill) D.A.Webb) y durazno seleccionado entre las plantas originadas por el cruzamiento del ‘Garfi x Nemared’ (Serie G x N). El árbol es de vigor grande, porte erguido, poco ramificado, con ramas que emiten pocos anticipados. Las hojas son grandes, de aspecto intermedio entre las de almendro y durazno. En primavera tiene un color rojo que durante el verano vira a verde bronceado. Las flores son grandes, de color rosa pálido y los frutos son pequeños, redondeados, de color verde oscuro con tonalidades rojizas, indehiscentes y con hueso libre. Este portainjerto es muy empleado para durazno (P. persica (L.) Batsch.), nectarín (Prunus persica var. nectarina) y sobre todo para almendro. Es inmune a los nemátodos agalladores (Meloidogyne spp.), tolerante a nemátodos lesionadores (Pratylenchus spp.) y resistente a asfixia radical (COTEVISA, 2015).
La propagación de este híbrido usando semillas es casi imposible y la propagación vegetativa por métodos convencionales tales como estacas o brotes de ramas a menudo se asocia con varias dificultades, debido a algunos desórdenes fisiológicos tales como la baja capacidad de enraizamiento (Dejampour et al., 2007). Por tal motivo, el desarrollo de protocolos para la propagación in vitro de este híbrido ha sido presentado como un método alternativo para la obtención de este material vegetal.
La micropropagación de patrones Prunus y sus varios híbridos interespecíficos como el durazno x almendro, albaricoque (Prunus armeniaca L.) x almendro, ciruelo (Prunus domestica L.) x almendro y albaricoque x ciruelo se han informado anteriormente (Fotopoulos y Sotiropoulos, 2005; Martinelli, 2005; Espinosa et al., 2006; Dejampour et al., 2007; Kalinina y Brown, 2007).
Estas especies del género Prunus presentan en su mayoría una difícil propagación in vitro. Por esta característica se les conoce como plantas recalcitrantes (Arab et al., 2014). Battistini y De Paoli (2002) y Cabrera (2003) señalaron que los portainjertos para durazno y el durazno son consideradas especies difíciles de propagar por cultivo de tejidos debido a diversos factores que afectan la adaptación del explante en las condiciones in vitro. Entre ellos se mencionan las frecuentes dificultades de oxidación, presencia de inhibidores de crecimiento y sobre todo a la dificultad del enraizamiento.
Battistini y De Paoli (2002) señalaron, además, que a pesar de que en su vivero producen todos los patrones de Prunus por micropropagación, cada clon necesita experimentación específica para equilibrar los componentes en el medio de cultivo para optimizar la proliferación de brotes y las raíces y para mejorar el proceso de aclimatización. Aunque la propagación in vitro puede ser un método fiable para la propagación clonal masiva de materiales vegetales sanos de nuevos portainjertos, no ha sido intentado en el portainjertos híbrido interespecíficos ‘GxN 15’, hasta el momento en Bolivia según la literatura nacional e internacional consultada.
En la actualidad muchos estudios del cultivo in vitro han sido realizados para el propagación in vitro del durazno y algunos de sus híbridos interespecíficos como portainjertos, pero existen muy pocos trabajos y algunos de ellos muy preliminares sobre la serie GxN (Barrios y Percy, 2008; Centellas et al., 2011; Arab et al., 2014; Kelek et al., 2015). A partir de lo anterior el presente trabajo tuvo como objetivo establecer una metodología para el establecimiento in vitro de segmentos nodales del portainjertos híbrido ‘Garfi x Nemared’ a partir de plantas madre cultivadas en un banco de germoplasma ex situ en una casa túnel.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron plantas madre en pleno crecimiento del portainjertos híbrido ‘Garfi x Nemared Garfi’ (Prunus dulcis (Mill) D.A.Webb) x durazno Nemared (Prunus persica L.) con 4 a 5 meses de cultivo en el Banco de Germoplasma ex situ (Figura 1). De estas fueron seleccionadas ramas jóvenes para tomar segmentos nodales que se emplearon como explantes.

Pretratamientos a las plantas madre
Las plantas madre utilizadas para la toma de los segmentos nodales se encontraban en condiciones controladas de cultivo, bajo túnel cerrado con cubierta Agrofilm y malla sombra o Sarán 50%, encima. Estas recibieron aplicaciones previas con el fungicida sistémico Carbendazim (SINOCARB, Sinochem Ningbo LTD, China) a 0.65 ml l-1 dos semanas antes de la toma de los segmentos nodales.
Además, tres semanas previas antes de la toma de los explantes se aplicó fertilizante foliar AjiFOL® Plus (Compañía Ajinomoto, Perú) a 1.25 ml l-1 y una mezcla de reguladores del crecimiento (500 mg l-1 de 6 bencilaminopurina y 1000 mg l-1 de ácido giberélico) con una frecuencia de una vez por semana.
Toma de los explantes
La toma de los explantes (segmentos nodales) fue realizada en horas tempranas de la mañana. Para el corte se tuvo en cuenta que los segmentos nodales utilizados fueran los comprendidos entre el primer y quinto par de hojas a partir de la yema apical, con un grosor no superior a 0.2 cm. Se les eliminaron las hojas y se dejó solo un pequeño fragmento del peciolo de 3 a 5 mm. Para todo esto se empleó una tijera de podar. Los explantes una vez cortados fueron colocados en frascos de cultivo cerrados con agua destilada para el traslado al laboratorio.
Desinfección
En el laboratorio se realizaron los diferentes pasos del procedimiento de desinfección. Primero se realizó un lavado con agua bajo la llave durante una hora. Luego, se lavaron con detergente doméstico líquido 'Ola'® (Astrix S.A, Bolivia) del cual se adicionaron de 3 a 5 ml por cada 250 ml de agua. El lavado se realizó durante 30 minutos en agitación, con un agitador magnético y enjuague posteriormente con agua para eliminar el detergente. Posteriormente, los segmentos nodales fueron individualizados con ayuda de una tijera de podar o bisturí. Después se realizó una primera desinfección de los segmentos nodales individuales en recipientes estériles con etanol al 70% durante 30 segundos con agitación manual. A continuación se eliminó el etanol dentro de la cabina de flujo laminar.
Para la etapa final del proceso de desinfección los segmentos nodales fueron colocados en una solución de hipoclorito de sodio (NaClO). Se estudiaron dos tratamientos: 0.5 y 0.75% (v/v) de NaClO, durante un tiempo de exposición de 10 min en agitación (Figura 2).

Después de la desinfección con hipoclorito de sodio, se realizaron tres enjuagues en la cabina de flujo laminar con agua destilada estéril. Los segmentos nodales después de desinfectados fueron colocados en una solución estéril de ácido cítrico a 150 mg l-1.
Una vez realizada la desinfección de los segmentos nodales se siguieron los siguientes pasos para el establecimiento de los explantes, en la cabina de flujo laminar. Se redujo el tamaño del explante de 1 a 2 cm. Para este procedimiento, se eliminaron ambos extremos del segmento porque en esa zona hay un mayor daño ocasionado por el desinfectante. A continuación se colocaron los segmentos nodales de forma vertical sobre el medio de cultivo en tubos de ensayo de vidrio de 16 x 2 cm, con 10 ml de cultivo semisólido para el establecimiento in vitro. Los tubos se taparon con lámina de aluminio de 0.2 µM y después se sellaron con filme plástico de policloruro de vinilo (PVC) (ALPFILM®, ALPES LTDA, San Pablo, Brasil).
El medio de cultivo basal estuvo compuesto por las sales y vitaminas propuestas por Murashige y Skoog (1962) MS al 100% de su concentración (PhytoTechnology Laboratories Co. Kansas, EUA), sacarosa 30 g l-1, ácido cítrico 150 mg l-1, 7 g l-1 de agar (Bacto® Agar, Becton, Dickinson y Co., EUA) y pH 5.7 antes de la esterilización por autoclave. Para la mitad de los explantes de cada tratamiento con NaClO se adicionaron 0.1 mg l-1 de ácido giberélico al medio de cultivo y para el resto se empleó el medio de cultivo basal. Se utilizaron 20 tubos de ensayo como repeticiones por tratamiento con un segmento nodal en cada uno.
Los tubos de ensayo con los segmentos nodales fueron colocados bajo condiciones de oscuridad total a 24 ± 2.0°C durante una semana. Posteriormente se ubicaron en cámara de crecimiento con luz solar con un fotoperiodo de 12 horas luz; a 21 ± 2.0°C, con una densidad de flujo de fotones fotosintéticos (DFFF) entre 25.9 a 69.0 µmol m-2 s-1.
Las evaluaciones se realizaron a los 15 días de cultivo para las variables número de segmentos nodales contaminados por microorganismos y con oxidación fenólica. A los 45 días de cultivo se evaluaron las variables número de segmentos nodales vivos, muertos y de los vivos los que brotados. Los datos fueron convertidos a porcentaje.
Se seleccionó la concentración de NaClO que redujo significativamente la contaminación microbiana y que no ocasionó fitotoxicidad a los explantes. El experimento se repitió dos veces en el tiempo.
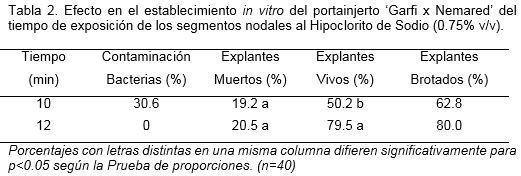
A partir de los resultados se realizó un nuevo ensayo con mayor tiempo de exposición de los segmentos nodales en la mejor concentración de hipoclorito de sodio (NaClO) en dos tiempos de exposición (10 y 12 minutos). El número de explantes, las condiciones de cultivo y las evaluaciones fueron similares a las descritas anteriormente. El experimento se repitió dos veces en el tiempo.
Análisis estadístico
Para el procesamiento estadístico se utilizó el paquete estadístico STATISTICA versión 12.0 para las variables expresadas en porcentajes, la diferencia entre los valores se determinó mediante la prueba de comparación de proporciones para dos muestras p≤0.05.
Resultados y Discusión
En los tratamientos estudiados no se observó contaminación por hongos. Los resultados alcanzados con la mayor concentración de hipoclorito (0.75%) durante un tiempo de exposición de 10 minutos permitió reducir la contaminación por bacterias (Tabla 1). Esto demostró la efectividad del pretratamiento a las plantas madre con el fungicida sistémico Carbendazim, dos semanas previas a la toma de los segmentos nodales. Sin embargo, los valores de contaminación por bacterias fueron altos.

El incremento del tiempo de exposición de los explantes en el NaClO en 2 minutos más (12 minutos en total) permitió lograr un 100% de brotes in vitro libres de contaminantes microbianos visibles (Tabla 2). Esto demostró la influencia de la especie y sus características botánicas, que pueden permitir o no mayor acumulación de microorganismos, si se compara con resultados similares en otras especies como manzano (Malus domestica L.) y ciruelo (Prunus domestica L.) (datos no mostrados) en un mayor o menor éxito en el establecimiento in vitro.
El establecimiento de plantas leñosas para su cultivo in vitro es un paso difícil. Sin embargo, en el presente trabajo fue posible alcanzar resultados positivos. La desinfección de los explantes es esencial para el éxito del cultivo in vitro. La contaminación microbiana puede originarse por contaminantes que vienen adheridos a la superficie del explante o por fallas en los procedimientos de laboratorio. El mantenimiento de plantas donadoras bajo condiciones de invernadero o vivero y con pretratamiento con sustancias antimicrobianas disminuyen las pérdidas. Ello permite lograr el establecimiento de cultivos axénicos y fisiológicamente vigorosos con los cuales iniciar el proceso de multiplicación (Cassells, 2011).
Varios autores se refieren a la importancia del protocolo de desinfección en el establecimiento in vitro de especies frutales, lo que hace que varíen los porcentajes de contaminación microbiana. Sin embargo, tratamientos con 0.5-0.75% de NaClO dependiendo del tipo de la especie frutal han sido encontrados efectivos en el control de microorganismos contaminantes (Battistini y De Paoli, 2007). Similares resultados han sido obtenidos en el presente trabajo con 0% de contaminación, muerte del 20.5% y una supervivencia del 79.5%.
Para el establecimiento in vitro de especies de Prunus, se han utilizado ápices (Theiler- Hedtrich y Feucht, 1985; Deogratias et al., 1986) y secciones nodales de tallo (Couto et al., 2003; Couto et al., 2004) como explantes. Los resultados de estos ensayos están en correspondencia con los informados por otros autores ya que los porcentajes de establecimiento y brotación obtenidos en Prunus han sido variables En este sentido, Couto et al. (2003) informaron 15% mientras que Da Silva et al. (2003) lograron 63%; Ahmand et al. (2003) señalan 55% y Feleket et al. (2015) refieren a 87.7%.
El empleo del hipoclorito de sodio como parte final del proceso de desinfección en Prunus, ha sido utilizado por diferentes autores. Las concentraciones varían desde 0.25 hasta 5.0% con tiempos entre los 5 a 15 min (Cabrera, 2003; Ahmand et al., 2003; Parada y Villegas, 2009; Vaghiar-Azar et al., 2012; Felek et al., 2015). Las concentraciones y tiempos empleadas en este trabajo se encontraron entre esos valores.
En correspondencia con lo anterior Parada y Villegas (2009) refieren en otro híbrido interespecífico de almendro x durazno (H1) portainjertos potencial obtenido del cruzamiento de las variedades 'Dulce Marrakech´ x 'Flordaguard´, que al analizar la efectividad de los tres tiempos de exposición de secciones nodales al hipoclorito de sodio (Cloralex®) al 1.0%, encontraron que este factor únicamente influyó en la incidencia de hongos, y que los tiempos más efectivos fueron 10 y 15 min, con 10 y 9.4% de contaminación respectivamente. Al comparar el desempeño de dos tipos de explantes (ápices y segmentos nodales) al ser expuestos por 5 min al hipoclorito de sodio, se observó que los ápices se contaminaron menos que las secciones nodales, tanto por hongos como por bacterias; esto sugiere que a menor tamaño de explante, menor contaminación. En cuanto a supervivencia y brotación, las secciones nodales del tallo presentaron porcentajes mayores que los ápices. Los ápices murieron en mayor proporción (74.4%) que las secciones nodales. Sin embargo, en este trabajo donde se utilizaron segmentos nodales fue posible controlar la contaminación fúngica y bacteriana.
Por otra parte, Arab et al. (2014) utilizaron para el establecimiento in vitro del portainjertos 'Garnem' segmentos nodales de plantas jóvenes que crecían en invernadero y realizaron la desinfección en varios pasos con etanol al 70%, pero no emplearon NaClO, sino Bicloruro de mercurio (0.01%) durante 3.5 min. Después de la desinfección realizaron dos lavados de los explantes en una solución de 700 mg l-1 de ácido cítrico y antes de colocarlos en el medio de cultivo los enjuagaron con agua destilada estéril. Estos resultados apoyan en parte los resultados del presente trabajo, aunque, en este caso solo fue necesario utilizar 150 mg l-1 de este antioxidante, pero combinándolo con oscuridad durante siete días y después colocando a la luz los explantes. Sin embargo, estos autores en el trabajo no se refieren a los porcentajes de contaminación microbiana, supervivencia y brotación alcanzados.
Los segmentos nodales sometidos previamente a oscuridad durante una semana, tuvieron un porcentaje de regeneración adecuado, respecto a otros resultados informados en la literatura científica internacional, probablemente, debido a un mayor tenor de auxina endógena, ya que estas son sensibles a la luz, lo que modifica de esta forma el balance auxina/citoquinina y favorece la morfogénesis. Además, influyó en el control de la oxidación de los felones, lo que evitó la muerte de los explantes y con ello una mayor brotación. Este es uno de los problemas principales a resolver en el establecimiento in vitro del durazno a nivel internacional.
Es de destacar que en ambos ensayos con la combinación de brotes jóvenes de plantas madre que se cultivaron en casa túnel con malla sombra del 50%, la inmersión de los segmentos nodales al final del proceso de desinfección en una solución con el antioxidante ácido cítrico, la incorporación de este en el medio de cultivo y colocar posteriormente los tubos de ensayo con los segmentos nodales durante siete días en condiciones de oscuridad, permitió eliminar en un 100% la exudación de fenoles y la oxidación de estos en la base de los explantes.
Posiblemente la edad del explante también influyó en la liberación de fenoles, ya que tallos con menos edad en formación son menos propensos a la oxidación. Sobre lo anterior, Muhitch y Fletcher (1985) plantearon que tejidos jóvenes son con frecuencia menos propensos al oscurecimiento después de la escisión que otros más viejos, esto lo demostraron en Rosa sp. (L.) cv. 'Paul'. También, Duhem et al. (1988) informaron que explantes muy jóvenes de cafeto (Coffea arabica L.) fueron más proclives a mostrar oxidación fenólica que aquellos tomados de tejidos más viejos. Igualmente, para el caso del durazno cultivar ‘Salcajá’ las pruebas demostraron que explantes provenientes de material vegetal joven fueron menos susceptibles a oxidarse en comparación con los de mayor tiempo de formación. Estos últimos se ven afectados por las heridas ocasionadas al tejido con lo cual se favorece la oxidación ya que se estimula la respiración. Además, el material vegetal de mayor edad se encuentra más lignificado y al momento de realizar los cortes se ocasionan heridas innecesarias al ser más difíciles de trabajar debido a su dureza. También se corre el riesgo de que las yemas ya no se encuentren viables o que estas sean de flor y no vegetativas (Cabrera, 2003). En el presente trabajo se tuvo el cuidado de que el material vegetal seleccionado tuviera el mismo tiempo en haberse formado.
Al respecto, varios trabajos señalan el empleo de sustancias antioxidantes durante el proceso de desinfección y después en el medio de cultivo. Por ejemplo, se ha empleado ácido ascórbico, ácido cítrico, carbón activado y polivinilpirrolidona (PVP). En durazno se han alcanzado los mejores resultados con el uso del PVP a 900 mg l-1 y carbón activado a 5 g l-1 lo (Cabrera 2003; Ahmad et al., 2003). Sin embargo, Cabrera (2003) refirió que el ácido cítrico tuvo el menor efecto en el control de la oxidación a concentraciones que variaron entre 50-150 mg l-1 contrario a los resultados del presente trabajo, donde con el empleo de 150 mg l-1 y combinado con el proceso de cultivo de las plantas madre en condiciones de menor intensidad luminosa y una semana a la oscuridad de los segmentos nodales permitió lograr un 100% de control de la oxidación en los explantes (Figuras 3 y 4).


En el medio de cultivo sin ácido giberélico fue donde se alcanzaron los mayores valores de brotación de las yemas in vitro. Todo parece indicar que este híbrido posee suficiente giberelina endógena y la aplicación de forma exógena perjudica la formación de brotes. En este sentido, Ahmad et al. (2003) señalaron en el híbrido interespecífico ‘GF 677’ de durazno x almendro el no uso de reguladores del crecimiento en el medio de cultivo para lograr los mejores resultados en la brotación de las yemas lo cual apoya los resultados del presente estudio. También Vaghiar-Azar et al. (2012) refirieron en otro híbrido del género Prunus entre albaricoque x ciruelo los mejores resultados en la brotación con un medio de cultivo sin reguladores del crecimiento. No obstante, otros autores informaron el empleo en el medio de cultivo de la citoquinina 6 bencilaminopurina en concentraciones entre 0.5 y 1.5 mg l-1 (Barrios y Percy, 2008; Arab et al., 2014; Felek et al., 2015).
Conclusiones
Se pudo lograr el establecimiento in vitro de segmentos nodales del portainjertos 'Garnem' con el uso de ramas jóvenes provenientes de plantas madre cultivadas en condiciones controladas bajo 50% de sombra, con la aplicación de pretratamientos previos a la toma de los segmentos nodales de ramas jóvenes, el proceso de desinfección empleado con hipoclorito de sodio al 0.75% durante 12 minutos, la inmersión en una solución de ácido cítrico (150 mg l-1) sin reguladores del crecimiento y condiciones de oscuridad total durante los primeros siete días de cultivo.
AGRADECIMIENTOS
Al Instituto Nacional de Innovación Agropecuaria y Forestal (INIAF) de Bolivia y a las Alcaldías de Vallegrande y Comarapa por el financiamiento para hacer posible esta investigación, a través del subproyecto “Fortalecimiento del sistema de producción frutícola en los municipios de Comarapa y Vallegrande con aplicación de tecnología in vitro”.
Referencias
Ahmad T, Ur-Rahman H, Ahmed MCH, Laghari MH (2003) Effect of culture media and growth regulators on micropropagation of peach rootstock GF 677. Pak Journal Botany 35 (3): 331-338
Arab MM, Abba SY, Abdolali Sh, Saber Sh, Shoresh MG (2014) Effects of nutrient media, different cytokinin types and their concentrations on in vitro multiplication of G x N15 (hybrid of almond x peach) vegetative rootstock. Journal of Genetic Engineering and Biotechnology 12 (2): 81-87; doi: 10.1016/j.jgeb.2014.10.001
Barrios B, Percy R (2008) Establecimiento in vitro del portainjerto de duraznero Garfi x Nemared (G x N-15). Tesis de Grado, Universidad Autónoma Juan Misael Saracho, Tarija, Bolivia
Battistini A, De Paoli G (2002) Large scale micropropagation of several peach rootstocks. Acta Hort 592: 29-33
Cabrera AM (2003) Efecto de antioxidantes, desinfectantes, medios de cultivo y reguladores del crecimiento, en la propagación in vitro del cultivo de yemas axilares de melocotón Prunus persica (L.) Batsch var Salcajá. Tesis de Grado, Universidad de San Carlos de Guatemala, Guatemala
Centellas A, Álvarez V, Acuña E, Rocha E, Maita E (2011) Manual de propagación de plantínes de duraznero y manzano bajo invernadero. Fundación PROINPA, Cochabamba; ISBN: 978-99954-743-9-3
Coca MM (2011) La agalla de corona del duraznero en Cochabamba. Revista de Agricultura Bolivia 50: 2-8
COTEVISA (2015) Características del híbrido Garnem. Disponible en: http://www.cotevisa.com/tecnologia/garnem-g-x-n. Consultado 25/08/15
Couto A, Posser C, de Luces G, Fachinello JC, da Silva JB (2003) Estabelecimento e multiplicação in vitro de Prunus sp. em diferentes meios de cultivo. Rev Bras Frutic 25 (1): 561-563; doi: 10.1590/S0100-29452003000100037
Couto M, Ucker R, Pedroso de Oliveira R (2004) Estabelecimento in vitro de porta-enxertos de Prunus sp. Rev Bras Frutic 26(3): 561-563; doi: 10.1590/S0100-29452004000300047
Da Silva DA, Rogalski M, Antunes LK, Felisbino C, Crestani L, Guerra MP (2003) Estabelecimento e multiplicação in vitro de porta-enxertos de Prunus. Rev Bras Frutic 25 (2): 297-300; doi: 10.1590/S0100-29452003000200029
Dejampour J, Grigourian V, Majidi E, Asgharzade N (2007) Sterilization, establishment and proliferation of some Prunus interspecific hybrids for in vitro culture. Journal of Horticultural Science Technology 8: 165-174
Deogratias JM, Lutz A, Dosba F (1986) In vitro micropropagation of shoot tips from juvenile and adult Prunus avium L and Prunus persica (L.) Batsch to produce virus free plants. Acta Horticulturae 193: 139-144
Duhem K, Le Mercier N, Boxus P (1988) Difficulties in the establishment of axenic in vitro cultures of field collected coffee and cacao germplasm. Acta Horticulturae 225: 67-75
Espinosa AC, Pijut PM, Michler CH (2006) Adventitious shoot regeneration and rooting of Prunus serotina in vitro cultures HortScience 41(1): 193-201
Fotopoulos S, Sotiropoulos TE (2005) In vitro rooting of PR 204/84 rootstock (Prunus persica × P. amygdalus) as influenced by mineral concentration of the culture medium and exposure to darkness for a period. Agronomy Research 3(1): 3-8
Kalinina A, Brown D (2007) Micropropagation of ornamental Prunus spp. and GF 305 peach, a Prunus viral indicator. Plant Cell Reports 26 (7): 927-935; doi: 10.1007/s00299-007-0315-x
Kelek W, Mekibib F, Admassu B (2015) Optimization of explants surface sterilization condition for filed grown peach (Prunus persica (L.) Batsch cv. Garnem) intented for in vitro culture. African Journal of Biotechnology 14 (8): 657-660; doi: 10.5897/AJB2014.14266
Kempff SF, Vargas MR, Rivadeneira CF, Barba AL (2015) Panorama y perspectivas de la fruticultura cruceña Ecoregión Valles. Editorial DUI-UAGRM Universidad Autónoma Gabriel Rene Moreno, Santa Cruz de la Sierra; ISBN: 978-99974-51-01-9
Martinelli A (2005) Factors affecting in vitro propagation of the peach-almond hybrids Hansen 2168 and Hansen 538. Acta Hort 173: 237-244
Muhitch M, J Fletcher (1985) Influence of culture age and spd treatment on the accumulation of phenolic compounds in suspension cultures. Plant Physiology 78: 25-28
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497
Parada DP, Villegas AM (2009) Propagación in vitro del híbrido almendro x durazno H1. Rev Fitotec Mex 32 (2): 103 – 109
Theiler-Hedtrich CM, Feucht W (1985) Micropropagation of Prunus cerasus rootstocks, Influence of culture medium constituents on growth in stage I and II. Acta Hort 169: 335-340
Vaghiar-Azar E, Vatanpour-Azghandi A, Majidi-Heravan E, Dejampour J, Habashi AA (2012) Micropropagation of two apricot × plum inter specific hybrid rootstocks (HS405 and HS706). Iranian Journal of Genetics and Plant Breeding 1(2): 9-15
Recibido: 16-01-2016
Aceptado: 22-03-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
