Artículo original
Biotecnología Vegetal Vol. 16, No. 2: 113 - 123, abril - junio, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Propagación in vitro de Hylocereus monacanthus (Lem.) Britton y Rose
In vitro propagation of Hylocereus monacanthus (Lem.) Britton and Rose
Laura Belem Montiel–Frausto1, José Raymundo Enríquez del Valle2, Aroldo Cisneros1
1Instituto Politécnico Nacional, Centro Interdisciplinario de Investigación para el desarrollo Integral Regional (CIIDIR) Unidad Oaxaca. Hornos 1003, Col Noche Buena. Santa Cruz Xoxocotlán. Oaxaca. México. CP 71230. e-mail: cisneros@post.bgu.ac.il y acisnerosp@ipn.mx
2Instituto Tecnológico del Valle de Oaxaca (ITVO). Ex Hacienda de Nazareno S/N. Santa Cruz Xoxocotlán. Oaxaca. México. CP 68130.
RESUMEN
La aplicación del cultivo de tejidos contribuye a la propagación rápida y masiva de especies con importancia económica, y sirve como plataforma básica de las estrategias de producción. El objetivo de este trabajo fue establecer la propagación in vitro de Hylocereus monacanthus (Lem.) Britton y Rose. Se germinaron semillas in vitro, se tomaron los segmentos apicales que contenían el ápice y las areolas y se establecieron en medio de cultivo MS con BAP (1.0, 2.0 y 4.0 mg l-1) y AIA (0.5 mg l-1) por separado y combinados para la fase de multiplicación. Para el enraizamiento de los brotes se utilizó un medio de cultivo MS con diferentes concentraciones de sales inorgánicas (50, 75 y 100%) y AIB (0.1 mg l-1). Las plantas obtenidas in vitro se plantaron en invernadero para su aclimatización. El porcentaje de germinación de las semillas fue del 70% con 6% de contaminación microbiana. Con 1 mg l-1 de BAP se obtuvieron los mejores resultados para la multiplicación in vitro de H. monacanthus. Se obtuvo 100% de brotes enraizados en todos los tratamientos y solo se observó diferencia significativa para la longitud de las raíces con la adición de 0.1 mg l-1 de AIB. La supervivencia promedio de las plantas transferidas a sustrato fue de 97.1%. Los resultados de este trabajo ofrecen una alternativa de propagación para H. monacanthus, lo cual contribuirá al establecimiento de plantaciones comerciales y otros estudios a nivel de laboratorio.
Palabras clave: brotes, cactus, pitahaya
ABSTRACT
The application of tissue culture contributes to the rapid and massive propagation of economically important species and serves as a basic platform for production strategies. The objective of this work was to establish the in vitro propagation of Hylocereus monacanthus (Lem.) Britton and Rose. The seeds were in vitro germinated and then the apical segments containing the apex and areoles were taken and placed in culture medium MS with BAP (1.0, 2.0 and 4.0 mg l-1) and IAA (0.5 mg l-1) separately and combined for the multiplication phase. For rooting an MS culture medium with different concentrations of inorganic salts (50, 75 and 100%) and IBA (0.1 mg l-1) was used. In vitro plants obtained were planted in greenhouse for their acclimatization. The percentage of seeds germination was 70% with 6% of microbial contamination. With 1 mg l-1 BAP, the best results were obtained for the in vitro multiplication of H. monacanthus. In all treatments 100% of rooted shoots were obtained and only a significant difference was observed for root length with the addition of 0.1 mg l-1 IBA. The average survival of plants transferred to substrate was 97.1%. The results of this work offer an alternative of propagation for H. monacanthus, which will contribute to the establishment of commercial plantations and other studies at the laboratory level.
Keywords: pitahaya, shoot tip, cacti
INTRODUCCIÓN
Las técnicas modernas de producción de variedades mejoradas altamente homogéneas han provocado la reducción de la variabilidad genética de las especies cultivadas y ha ocasionado una erosión genética, lo que ha hecho necesario recurrir a fuentes genéticas originales de variabilidad (Rayas et al., 2013).
La familia de las cactáceas distribuidas en forma nativa en América, se caracteriza por el uso eficiente del agua mediante la ruta fotosintética CAM (Metabolismo Ácido de las Crasuláceas) (Nunez et al., 2014). La pitahaya, nombre que recibe el fruto de Hylocereus spp. es una cactáceas epífita que se distribuye en climas secos, tropicales y subtropicales (Ortiz-Hernández et al., 2012) de importancia antropocéntrica por sus frutos, tallos y como fuente de componentes industriales. La demanda del fruto es alta pues son consideradas frutas exóticas en diferentes países (Ortiz-Hernández y Carrillo-Salazar, 2012; Valencia-Botín, et al., 2013). H. undatus (Haw.) Britton & Rose es la especie de mayor importancia económica y México es considerado el principal centro de origen de la diversidad genética de pitahaya (Legaria et al., 2005).
La vía de propagación de las cactáceas son las semillas, propágulos vegetativos e injertos. Sin embargo, las semillas no garantizan la estabilidad genética clonal de la especie o variedad y en algunos casos son difíciles de obtener o tienen muy baja viabilidad (Lema-Rumińska y Kulus, 2014). En adición a lo anterior, Goettsch et al. (2015), publicaron que los taxones pertenecientes a la familia de las cactáceas se encuentran entre los más amenazados; no siendo una excepción el género Hylocereus, el cual está ganando hoy día mayor importancia y relevancia como cultivo de fruta exótica.
La pitahaya se propaga principalmente mediante esquejes, método que es ineficiente, lento y donde las plantas son susceptibles a daños por exceso de humedad y enfermedades (Hua et al., 2015). Por otra parte, las plantas de pitahaya obtenidas de semillas muestran una fase juvenil que superan los cuatro años y las progenies que se obtiene son prácticamente híbridas. Por estas razones es que se hace necesario el empleo de técnicas biotecnológicas que garanticen una mayor homogeneidad con fidelidad clonal y que satisfagan las demandas de material vegetal de plantación. La biotecnología vegetal ofrece una serie de técnicas que pueden ser incorporadas a los esquemas de conservación de los recursos fitogenéticos, como son las relacionadas con el cultivo in vitro de tejidos vegetales. Las técnicas de propagación in vitro son importantes para la conservación de la integridad genética de especies vegetales (Alegría, 2001). En el caso del género Hylocereus se ha informado la propagación in vitro de varias especies entre las que se encuentran Hylocereus undatus (Mohamed-Yasseen, 2002; Dahanayake y Ranawake, 2011; Hua et al., 2015), Hylocereus costaricensis (F.A.C.Weber) Britton & Rose (Viñas et al., 2012) y H. polyrhizus (Hua et al., 2015).
Las técnicas de propagación in vitro permiten obtener material vegetal que sea representativo de la variabilidad genética; siendo la propagación in vitro un método que permite obtener una gran cantidad de plántulas en un corto tiempo y espacios reducidos (Pérez-Molphe-Balch et al., 2012). Una técnica de propagación utilizada en cactáceas es la activación de yemas axilares presentes en las areolas las cuales dan origen a nuevos brotes y posteriormente al desarrollo de una plántula completa (Villavicencio et al., 2012; Lema-Rumińska y Kulus, 2014).
En Hylocereus la mayoría de las areolas permanecen en estado latente debido principalmente a la dominancia apical, y solo algunas yemas bajo condiciones naturales pueden convertirse en brotes vegetativos o capullos de floración (Khaimov-Armoza et al., 2012). La técnica de propagación a partir de activación de areolas es importante por su simplicidad, bajo riesgo de inestabilidad genética y alta tasa de propagación (Zoghlami et al., 2012). Algunas especies responden de forma diferente a una misma condición de cultivo; siendo la combinación de reguladores de crecimiento vegetal (como son las auxinas y citocininas) los que desempeñan la función principal para determinar la vía de diferenciación celular. Para el caso de las cactáceas, la brotación de yemas axilares requiere niveles bajos de auxina y altos de citocininas (Viñas et al., 2012).
H. monacanthus representa un nuevo cultivo de frutas exóticas con potencial económico significativo para los productores de zonas áridas y semi-áridas del estado de Oaxaca, México. Sin embargo, tanto su propagación por vías convencionales (semillas y propágulos vegetativos) como su crecimiento son lentos. Por ello, es escaso el material vegetal de propagación de que se dispone. En esta especie no existe información sobre la aplicación de métodos biotecnológicos de propagación que permita suplir las demandas crecientes de material vegetal de plantación para los productores. Por esta razón, el objetivo de este trabajo fue establecer la propagación in vitro de Hylocereus monacanthus (Lem.) Britton y Rose.
MATERIALES Y MÉTODOS
Material vegetal
Semillas viables de H. monacanthus, fueron colectadas de frutos maduros de plantas de 6 años de edad ubicadas en el banco de germoplasma del CIIDIR unidad Oaxaca, perteneciente al Instituto Politécnico Nacional (IPN). En el laboratorio, los frutos se lavaron con detergente y agua corriente para eliminar restos de polvo y contaminantes. Las semillas fueron removidas del mesocarpio con la ayuda de un colador de plástico (con malla de 1 mm2) y abundante agua corriente, y luego fueron secadas durante 24 horas en ambiente fresco y ventilado.
Establecimiento in vitro
Las semillas se clasificaron según Cisneros et al. (2011) y fueron seleccionadas las semillas viables. Bajo condiciones asépticas, se sometieron al proceso de desinfección superficial tomando como referencia lo descrito en Cisneros y Tel-Zur (2010) modificado mediante la inmersión en una solución al 0.6% de hipoclorito de sodio con agitación continua durante 10 minutos, seguido de tres enjuagues con agua destilada estéril, proporcional al tiempo antes mencionado. Posteriormente, se establecieron in vitro 100 semillas en frascos de cultivo de 145 cm3 que contenían 20 ml de medio de cultivo basal MS (Murashige y Skoog, 1962) con 50% de las sales MS y libre de reguladores del crecimiento. En cada frasco se colocaron 10 semillas. El pH del medio de cultivo se ajustó a 5.8, antes de agregar 6 g l-1 de agar. Los medios de cultivo se esterilizaron durante 17 min a 121 ºC y 1.2 kg cm-2 de presión. Las semillas se incubaron durante 35 días en la cámara de cultivo a 25±2 ºC, 28 µmol m-2 s-1 de intensidad luminosa y fotoperiodo de 16/8 h luz/oscuridad. Se cuantificó el número de semillas germinadas y contaminadas con microorganismos y se calculó el porcentaje de germinación y contaminación microbiana.
Multiplicación in vitro
A partir de los 35 días de crecimiento en la fase anterior se seleccionaron aquellas plantas que tuvieran el epicótilo mayor a 1 cm de longitud de acuerdo con el procedimiento descrito por Dahanayake y Ranawake (2011), y se separaron del resto de la plántula (hipocotíleo, cotiledones y radícula).
Estos segmentos apicales, que contenían el ápice y las areolas, se establecieron en varias combinaciones de medio de cultivo para inducir la proliferación de brotes. El medio de cultivo basal estuvo compuesto por las sales MS (100%), sacarosa 30 g l-1, tiamina-HCl 40 mg l-1 y mio-inositol 100 mg l-1. A este se adicionaron diferentes concentraciones de N6- bencilaminopurina (BAP) (1, 2 y 4 mg l-1) y ácido indolacético (AIA) (0.5 mg l-1) comparados contra un control libre de reguladores del crecimiento (Tabla 1). En un primer ensayo se trabajó con los tratamientos que contenían los reguladores del crecimiento de forma individual (T1-4), y en un segundo se incorporaron tratamientos con estos combinados. La preparación de los medios de cultivo y las condiciones de incubación fueron similares a las descritas anteriormente.
Los explantes se cultivaron durante 60 días, y luego se procedió a la toma de datos: número de brotes por explante, longitud de brotes (mm), masa fresca de los brotes (g), número de callos y raíces por explante, presencia y porcentaje de brotes hiperhídricos por frasco.
Enraizamiento de los brotes
Los brotes obtenidos fueron individualizados para inducir su enraizamiento. Esta fase se llevó a cabo, en medio de cultivo basal MS con diferentes concentraciones de sales inorgánicas (50, 75 y 100 %) y ácido indolbutírico (AIB) (0 y 0.1 mg l-1). Se seleccionaron brotes de 2 cm de longitud y se colocaron cinco brotes en cada recipiente de cultivo. Posteriormente, los cultivos se colocaron en las mismas condiciones de ambiente controlado del experimento anterior, por un periodo de 60 días, y transcurridos estos se realizó la evaluación del experimento. Se tomaron datos de altura de brote (cm), número de raíces y longitud de raíces (cm).
Aclimatización
Las plántulas de pitahaya se colocaron individualmente en macetas #4 de unicel (vol. 177 cm3) que contenían una mezcla de sustrato de perlita y peat moss (1:1). Para esta fase se seleccionaron brotes de 4 cm de longitud. Cada maceta se cubrió con una bolsa de polietileno trasparente para crear un ambiente de humedad relativa alta. La primera semana la bolsa de polietileno fue retirada por 30 min, en la segunda semana por 60 min, en la tercera por 120 min, y en la cuarta semana se retiró por completo. Se programaron dos riegos por semana con 50% de la solución de Steiner (Trejo-Téllez y Gómez-Merino, 2012). Después de cuatro semanas se cuantificó el número de plantas vivas y se calculó el porcentaje de supervivencia. Además, se midió la altura de las plantas (cm).
Análisis estadístico
Se analizaron los datos y se sometieron a análisis de varianza simple de una sola vía, previa transformación a logaritmo de base decimal para cumplir con los supuestos de normalidad, y mediante la prueba de Tukey (p≤0.05) se realizó la comparación de las medias independientes, para lo cual se empleó el paquete estadístico XLSTAT (XLSTAT 2015, versión 2015.6.01.23865; https://www.xlstat.com/es/). Los experimentos de multiplicación y enraizamiento se establecieron mediante un diseño experimental completamente al azar, mediante las combinaciones de diferentes concentraciones de AIA (0 y 0.5 mg l-1) y BAP (1, 2 y 4 mg l-1) para la multiplicación (Tabla 1), y de AIB (0 y 0.1 mg l-1) y las sales MS (50, 75 y 100 %) para el enraizamiento. Por lo que resultaron seis tratamientos y el control con cero concentraciones. La unidad experimental estuvo compuesta de un frasco de cultivo que contenía cinco segmentos de epicotíleos o brotes, con un total de 15 repeticiones por tratamiento.
RESULTADOS
La germinación de las semillas ocurrió entre 4 y 6 días después de la siembra y el porcentaje de germinación fue del 70%. La viabilidad de las semillas en este experimento se mantuvo al colectar frutos jóvenes muy cercanos a la maduración total y con la selección de las semillas viables (Figura 1A), según su clasificación morfológica y de esa forma se garantizó una rápida germinación (Figura 1B), posterior al tiempo de cosecha.
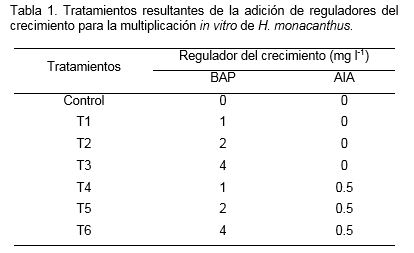
En la fase inicial del cultivo in vitro se observaron tasas bajas de contaminación microbiana (6%), y no se presentó muerte de los explantes a causa de la fenolización u oxidación (datos no mostrados). Después de 60 días del inicio del cultivo in vitro, se observó la formación de órganos (brotes axilares) y el desarrollo de tejido calloso. Los explantes se incubaron en condiciones ambientales que fueron apropiadas para activar las células meristemáticas contenidas en las areolas y producir brotes bien diferenciados. Utilizando concentraciones diferentes de la citocinina BAP y la auxina AIA se observaron efectos sobre el número de brotes, la altura de brotes, formación de raíces y masa fresca (Figura 2 y 3).

De acuerdo con el análisis de varianza realizado en H. monacanthus las concentraciones de los reguladores del crecimiento (BAP y AIA) tuvieron efectos significativos (p≤0.05) en las variables evaluadas de número y altura de los brotes, respectivamente (Figura 2). Con 1 mg l-1 de BAP se alcanzó el mayor número de brotes por explante y la mayor altura con diferencias significativas sobre el resto de las concentraciones de BAP (2 y 4 mg l-1), AIA (0.5 mg l-1) y el control (sin reguladores del crecimiento).
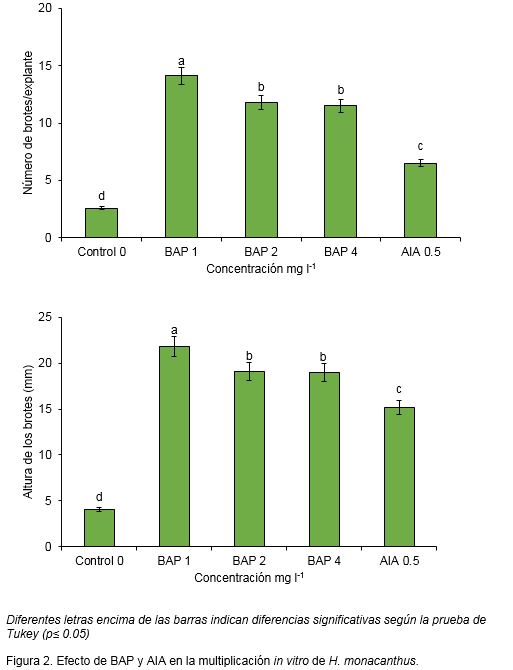
La combinación de los reguladores del crecimiento no incrementó significativamente los valores de las variables número de brotes por explante y altura de los brotes (Figura 3 A y B). Sin embargo, con el aumento de la concentración de BAP y su combinación con AIA la masa fresca de los brotes aumentó (Figura 3C). El tratamiento T6 (4 mg l-1 BAP + 0.5 mg l-1AIA), mostró los mayores resultados con 4.55 g de masa fresca. Cabe señalar que este resultado estuvo influenciado por la producción de tejido calloso en la base de los explantes de donde no se originan brotes adventicios y solo en los tratamientos control (sin reguladores del crecimiento), T1 (1 mg l-1 BAP) y T4 (1 mg l-1 BAP + 0.5 mg l-1 AIA) no se observó la formación de este tipo de tejido.
Además de la formación de tejido calloso (Figura 1C) también se comprobó la presencia de brotes hiperhídricos (Figuras 1D y 4), lo cual pudo influenciar los valores de masa fresca de los explantes (Figura 3C).
Por otra parte, aunque en la mayoría de los tratamientos y el control, fue nula la producción de raíces; aspecto este que favorece la fase de multiplicación en la propagación in vitro de pitahaya, en los tratamientos T4 (1 mg l-1BAP + 0.5 mg l-1AIA) y T5 (2 mg l-1 BAP + 0.5 mg l-1 AIA) se observó muy baja formación de raíces, aspecto no deseado en esta fase de la micropropagación.
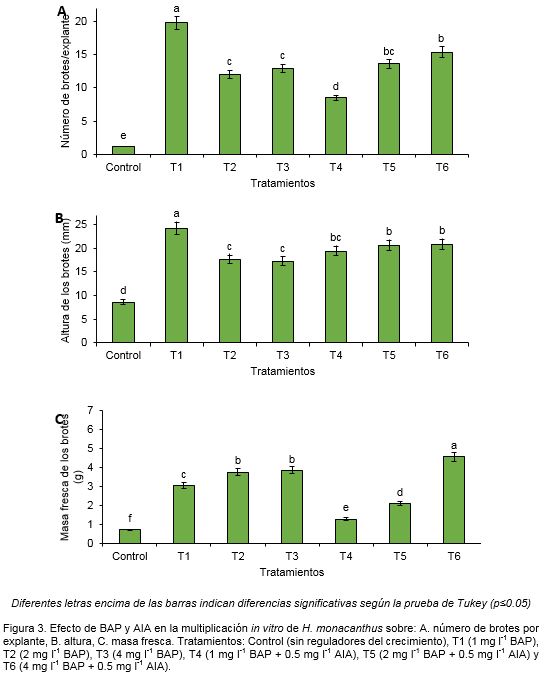
Un aspecto importante en la micropropagación de una especie es el desarrollo no deseado de brotes hiperhídricos. En este caso, se comprobó de 13 a 42% de formación de brotes hiperhídricos en los tratamientos con BAP superior a 2 mg l-1 (Figura 4). Algo significativo fue que con la adición de AIA en combinación con BAP se favoreció el desarrollo de brotes hiperhídricos (Figura 4), con valores que superaron el 40% en el tratamiento 6 (4 mg l-1 BAP + 0.5 mg l-1 AIA).
En la fase de enraizamiento en todos los tratamientos probados ya sea con y sin AIB se observó la formación y el desarrollo de raíces, sin encontrarse diferencias significativas para las variables evaluadas de longitud del brote (media de 3.65 cm) y número de raíces (media de 4.2 raíces por planta). Sin embargo, en los tratamientos donde se adicionó AIB, independientemente de la concentración de sales, se obtuvo la mayor longitud de las raíces (Tabla 2).
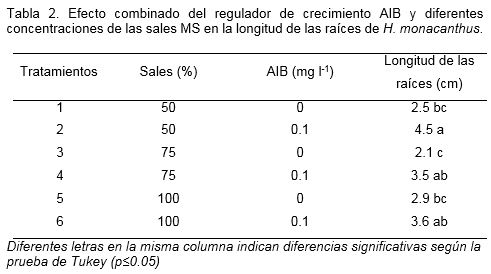
Durante las cuatro semanas de aclimatización (Figura 1E) en invernadero no se encontraron diferencias significativas para las variables evaluadas de supervivencia y altura de las plantas durante el monitoreado de la dinámica de crecimiento y desarrollo de estas. La supervivencia promedio fue de 97.2% y la altura promedio de las plantas de 8.51 cm.
DISCUSIÓN
Las altas tasas de geminación de semillas de cactáceas están relacionadas con el ambiente creado por el medio de cultivo, como alta humedad relativa y la presión osmótica (Ruvalcaba-Ruíz et al., 2010). En este estudio, la viabilidad de las semillas estuvo determinada principalmente por la selección de acuerdo con su clasificación morfológica (Cisneros et al., 2011), y al corto tiempo de almacenamiento posterior al tiempo de cosecha como lo realizado por Dahanayake y Ranawake (2011). Esto tuvo un efecto positivo en el crecimiento y desarrollo de los explantes que registraron una tasa muy baja de muerte a causa de la fenolización u oxidación.
La activación de los puntos de crecimiento celular en las areolas de los explantes para producir nuevos brotes, estuvo influenciada por la concentración de citocinina y auxina empleada en este estudio (Figura 2). De acuerdo con el análisis de varianza realizado, se observó un efecto de los reguladores del crecimiento sobre las variables evaluadas con diferencias significativas, ya sea en combinación o por sí sola cada una (Figuras 2 y 3). Las citocininas reducen el efecto de dominancia apical que a su vez inhibe el desarrollo de brotes axilares. Sin embargo, la aplicación de altas concentraciones de citocininas inhibe la elongación de yemas (Ngomuo et al., 2014), no siendo así para este estudio donde se logró un crecimiento adecuado de las yemas axilares similares a los descritos por Viñas et al. (2012). La combinación adecuada de auxinas y citocininas bajo condiciones apropiadas se utilizan para romper la latencia de las yemas y aumentar la formación de brotes (Lema-Rumińska y Kulus, 2014). Panda y Hazra (2012) cultivaron segmentos nodales de Semecarpus anacardium Linn., en medio de cultivo enriquecido con 2.27 mM de TDZ (Thidiazuron) y promovieron la división y proliferación de células meristemáticas en las yemas axilares, sin embargo, el desarrollo de los brotes fue inhibido por el TDZ, el cual está considerado como una citocinina fuerte y con efecto favorable sobre la organogénesis, la maduración y diferenciación de embriones de Hylocereus spp. (Pelah et al., 2002; Cisneros et al., 2013).
En este trabajo se encontraron resultados similares a los informados por Viñas et al. (2012) para H. costaricensis en la altura de los brotes, donde los tratamientos que solo contenían BAP, mostraron la mayor altura, no siendo completamente favorable la adición del AIA para el crecimiento y desarrollo de los brotes de pitahaya en fase de multiplicación (Figura 3). Efectos positivos para el caso de la aplicación de otras auxinas como el ácido 1-naphthaleneacético (ANA) fueron referidos por Mohamed-Yasseen (2002) en la micropropagación de H. undatus y por Cisneros y Tel-Zur (2010), para el rescate de embriones inmaduros de pitahaya, la cual es una estructura de composición celular deferente a las areolas, y en la propagación in vitro de varios cultivares de pitahaya con diferente composición genética (Hua et al., 2015).
Los resultados demostraron la factibilidad del uso en la propagación de H. monacanthus de la activación de areolas. De las técnicas empleadas en cactáceas, esta es muy utilizada porque no induce variación somaclonal. Por ejemplo, en Opuntia ficus-indica L. la proliferación de brotes se realizó en condiciones de obscuridad y posteriormente en fotoperiodo de 16 h luz 8 h obscuridad, resultando el 100% de las areolas activas con brotes de mayor longitud (Zoghlami et al., 2012).
En especies de Hylocereus se han desarrollado protocolos de propagación con el empleo de diferentes concentraciones y tipos de reguladores de crecimiento, así como fuentes de explantes (Mohamed-Yasseen, 2002; Viñas et al., 2012: Hua et al., 2015), con resultados inferiores en cuanto a número de brotes por explante a los obtenidos en este trabajo. En este estudio se informa la propagación in vitro de H. monacanthus mediante la activación de areolas, lo cual constituye una forma rápida de crecimiento y desarrollo para la introducción a la producción, en comparación a otros propágulos de más lento crecimiento como lo referido para H. costaricensis (Web.) Britton y Rose (Viñas et al., 2012).
La regeneración de plantas por vía organogénesis directa e indirecta permite superar las desventajas que se producen con la propagación sexual por semillas (Ruvalcaba-Ruíz et al., 2010). Mediante la organogénesis indirecta y directa, Pelah et al. (2002) y Dahanayake y Ranawake (2011) evaluaron el potencial de generación de callos y brotes en diferentes tipos de explantes (cotiledones, hipocotíleos, epicotíleos, hoja y tallo), y obtuvieron como resultado que los callos de hipocotíleos y epicotíleos no generaron estructuras morfogénicas; y los tallos fueron el mejor explante para la formación de los brotes directo, comparable con la formación de callos en la base de los explantes y de brotes en las areolas obtenidos en este trabajo. Estos métodos de propagación han sido utilizados en varias especies de cactáceas para realizar la reintroducción a su hábitat natural, entre ellas, Mammillaria mathildae Kraehenb. y Krainz (García-Rubio y Malda-Barrera, 2010), para la recuperación mediante la propagación in vitro de Coryphantha retusa (Pfeiff.) Britton y Rose en categoría de amenazado (Ruvalcaba-Ruíz et al., 2010), también para la obtención de material vegetal de propagación de H. undatus (Dahanayake y Ranawake, 2011), y en la organogénesis indirecta de Ortegocactus macdougallii Alexander (Arellano-Perusquía et al., 2013).
Por otra parte, la presencia de callos y brotes hiperhídricos puede ser atribuible a las concentraciones exógenas de los reguladores del crecimiento vegetal (Pérez-Molphe-Balch et al., 2015), como ocurre en los procesos de micropropagación, organogénesis y embriogénesis somática (Pelah et al., 2002). En este caso, se observó la formación de tejido calloso en tratamientos con las concentraciones más altas de BAP y en combinación con AIA. El desarrollo de brotes hiperhídricos fueron comparables con los informados para especies de Hylocereus (Mohamed-Yasseen, 2002; Pelah et al., 2002) y otras cactacéas (García-Rubio y Malda-Barrera, 2010; Lema-Rumińska y Kulus, 2014; Pérez-Molphe-Balch et al., 2015). Los resultados de este trabajo ofrecen una alternativa de propagación para H. monacanthus, lo cual contribuirá al establecimiento de plantaciones comerciales y otros estudios a nivel de laboratorio.
CONCLUSIONES
Se logró la propagación in vitro de la especie de pitahaya H. monacanthus a partir de la activación de yemas en las areolas del hipocotíleo, para lo cual no existen referencias bibliográficas en base a este tema en dicha especie. Se propone para la fase de multiplicación el medio de cultivo compuesto por las sales MS con la adición de 1 mg l-1 de BAP; mientras que, para la fase de enraizamiento, se plantea un medio de cultivo con 0.1 mg l-1 de AIB. Las plantas obtenidas tienen una supervivencia elevada una vez transferidas a condiciones de casa de cultivo para su aclimatización.
AGRADECIMIENTOS
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT – México) por el financiamiento parcial de la investigación mediante el proyecto No. 248045 de la convocatoria de Proyectos de Desarrollo Científico para Atender Problemas Nacionales y de su Programa Nacional de Formación de Profesionales Altamente Calificados por la concesión de la beca de investigación a la estudiante de postgrado L.B. Montiel-Frausto.
REFERENCIAS
Alegría JMI (2001) Conservación de germoplasma de especies raras y amenazadas. Investigación agraria, producción y protección vegetal 16 (1): 5-24
Arellano-Perusquía A, López-Peral MCG, Chablé-Moreno F, Estrada-Luna AA (2013) Effect of growth regulators in the organogenesis and multiplication of Ortegocactus macdougallii Alexander. Propagation of Ornamental Plants 13(23): 160-167
Cisneros A, Tel-Zur N (2010) Embryo rescue and plant regeneration following interspecific crosses in the genus Hylocereus (Cactaceae). Euphytica 174 (1): 73-82; doi: 10.1007%2Fs10681-010-0135-x
Cisneros A, Benega R, Tel-Zur N (2011) Ovule morphology, embryogenesis and seed development in three Hylocereus species (Cactaceae). Flora - Morphology Distribution Functional Ecology of Plants 206(12): 1076-1084; doi: 10.1016/j.flora.2011.07.013
Cisneros A, Benega-Garcia R, Tel-Zur N (2013) Creation of novel interspecific-interploid Hylocereus hybrids (Cactaceae) via embryo rescue. Euphytica 189 (3): 433-443; doi: 10.1007/s10681-012-0800-3
Dahanayake N, Ranawake AL (2011) Regeneration of dragon fruit (Hylocereus undatus) plantlets from leaf and stem explants. Tropical Agricultural Research and Extension 14 (4): 85-89; doi: 10.4038/tare.v14i4.4848
García-Rubio O, Malda-Barrera G (2010) Micropropagation and reintroduction of the endemic Mammillaria mathildae (Cactaceae) to its natural habitat. HortScience 45 (6): 934-938
Goettsch B, Hilton-Taylor C, Cruz-Piñón G, Duffy JP, Frances A, Hernández HM, Inger R, Pollock C, Schipper J, Superina M (2015) High proportion of cactus species threatened with extinction. Nature plants 1: 15142; doi: 10.1038/nplants.2015.142
Hua Q, Chen P, Liu W, Ma Y, Liang R, Wang L, Wang Z, Hu G, Qin Y (2015) A protocol for rapid in vitro propagation of genetically diverse pitahaya. Plant Cell Tissue and Organ Cultures 120 (2): 741-745; doi: 10.1007/s11240-014-0643-9
Khaimov-Armoza A, Novák O, Strnad M, Mizrahi Y (2012) The role of endogenous cytokynins and environmental factors in flowering in the vine cactus Hylocereus undatus. Israel Journal of Plant Sciences 60 (3): 371-383
Legaria SJP, Alvarado ME, Gaspar R (2005) Diversidad genética en pitahaya (Hylocereus undatus (Haworth) Britton y Rose). Revista Fitotecnia Mexicana 28 (3): 179-185
Lema-Rumińska J, Kulus D (2014) Micropropagation of cacti – A review. Haseltonia 19 (19): 46-63; doi: 10.2985/026.019.0107
Mohamed-Yasseen Y (2002) Micropropagation of pitaya (Hylocereus undatus Britton et Rose). In vitro Cellular Developmental Biology 38 (5):427-429; doi: 10.1079/IVP2002312
Murashige T, Skoog F (1962) A revised medium for rapid growth and bio-assays with tobacco tissues cultures. Physiologia Plantarum 15: 473-497
Ngomuo M, Mneney E, Ndakidemi P (2014) The in vitro propagation techniques for producing banana using shoot tip cultures. American Journal of Plant Sciences 5: 1614-1622; doi: 10.4236/ajps.2014.511175
Nunez DGC, Escobar R, Caetano CM, Vaca JCV (2014) Estandarización de un protocolo de regeneración en pitahaya amarilla (Selenicereus megalanthus (K. Schum. ex Vaupel) Moran). Acta Agronómica 63 (1): 31-41; doi: 101.15446/acag.v63n1.3605
Ortiz-Hernández YD, Livera-Muñoz M, Carrillo-Salazar JA, Valencia-Botín AJ, Castillo MR (2012) Agronomical, physiological and cultural contributions of pitahaya (Hylocereus spp.) in México. Israel Journal of Plant Sciences 60 (3): 359-370; doi: 10.1560/IJPS.60.3.359
Ortiz-Hernández YD, Carrillo-Salazar JA (2012) Pitahaya (Hylocereus sp.): a short review. Comunicata Scientiae 3 (4): 220-237
Panda BM, Hazra S (2012) Micropropagation of Semecarpus anacardium L.: A medicinally important tree species. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology 146 (1): 61-68; doi: 10.1080/11263504.2012.727877
Pelah D, Kaushik RA, Mizrahi Y, Sitrit Y (2002) Organogenesis in the vine cactus Selenicereus megalanthus using thidiazuron. Plant Cell, Tissue and Organ Culture 71 (1):81-84; doi: 10.1023/A:1016585108094
Pérez-Molphe-Balch E, Esparza-Araiza MJ, Pérez-Reyes ME (2012) Conservación in vitro de germoplasma de Agave spp. bajo condiciones de crecimiento retardado. Revista Fitotecnia Mexicana 35 (4): 279-287
Pérez-Molphe-Balch E, Santos-Díaz M del S, Ramírez-Malagón R, Ochoa-Alejo N (2015) Tissue culture of ornamental cacti. Scientia Agricola 72 (6): 540-561; doi: 10.1590/0103-9016-2015-0012
Rayas A, Cabrera M, Santos A, Basail M, López J, Medero V, Beovides Y (2013) Efecto del manitol y el nitrato de plata en la conservación in vitro de la malanga (Xanthosoma spp.). Revista Colombiana de Biotecnología XV (1): 167-171
Ruvalcaba-Ruíz D, Rojas-Bravo D, Valencia-Botín AJ (2010) Propagación in vitro de Coryphantha retusa (Britton & Rose) un cactus endémico y amenazado. Tropical and Subtropical Agroecosystems 12 (1): 139-143
Trejo-Téllez LI, Gómez-Merino FC (2012) Nutrient solutions for hydroponic systems. En: Asao T (ed) Hydroponics - A Standard Methodology for Plant Biological Researches, pp. 1-22. InTech Open Access Publisher, Rijeka, Croatia; ISBN: 978-953-51-0386-8
Valencia-Botín AJ, Kokubu H, Ortiz-Hernández YD (2013) A brief overview on pitahaya (Hylocereus spp.) diseases. Australasian Plant Pathology 42 (4): 437-440; doi: 10.1007/s13313-012-0193-8
Villavicencio EEG, González CA, Carranza PMA (2012) Micropropagación de Epithelantha micromeris (Engelm.) F.A.C. Weber ex Britt. & Rose, cactácea ornamental y recurso fitogenético del desierto Chihuahuense. Revista Mexicana de Ciencias Forestales 3 (14): 83-102
Viñas M, Fernández-Brenes M, Azofeifa A, Jiménez VM (2012) In vitro propagation of purple pitahaya (Hylocereus costaricensis [F. A. C. Weber] Britton & Rose) cv. Cebra. In vitro Cellular & Developmental Biology-Plant 48 (5): 469-477; doi: 10.2307/23326875
Zoghlami N, Bouamama B, Khammassi M, Ghorbel A (2012) Genetic stability of long term micropropagated Opuntia ficus-indica (L.) Mill. plantlets as assessed by molecular tools: Perspectives for in vitro conservation. Industrial Crops and Products 36 (1): 59-64; doi: 10.1016/j.indcrop.2011.08.006
05-01-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
