Artículo original
Biotecnología Vegetal Vol. 16, No. 3: 143 - 151, julio - septiembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Propagación in vitro de orquídeas nativas como una contribución para la conservación ex situ
In vitro propagation of native orchids for contribution to ex situ conservation
Belkys Adriana Pérez-Martínez, Sandra Liliana Castañeda-Garzón
Subdirección Científica, Jardín Botánico de Bogotá José Celestino Mutis. Avenida Calle 63 No 68-95. Bogotá. Bogotá DC. Colombia. CP 111071. e-mail: baperez@jbb.gov.co
RESUMEN
La presente investigación se desarrolló en la Subdirección Científica del Jardín Botánico de Bogotá José Celestino Mutis (Colombia). El objetivo fue determinar las condiciones nutritivas para la germinación asimbiótica y el crecimiento in vitro de cinco orquídeas silvestres nativas Epidendrum oxysepalum, Epidendrum chioneum, Epidendrum nocturnum, Oncidium pyramidale y Cyrtochilum revolutum. El medio de cultivo basal estuvo compuesto por sales MS reducidas en un 50% enriquecido o no con suplementos orgánicos, auxinas y citoquininas. Al término de dos meses de evaluación, se determinó que el medio de cultivo MS reducido en un 50% en sus sales, mio-inositol, vitaminas, pulpa de banano, sacarosa, canela en polvo y agar fue el más indicado para semillas de E. chioneum, E. nocturnum, O. pyramidale y C. revolutum, provenientes de cápsulas en estado de madurez fisiológica y no dehiscentes (cerradas). En semillas inmaduras de E. oxysepalum no se observaron procesos germinativos en ninguno de los dos medios de cultivo de germinación asimbiótica evaluados. El crecimiento in vitro, en términos de índice de incremento de longitud apical, evaluado durante tres meses para protocormos de E. nocturnum y O. pyramidale, fue favorecido por el empleo del medio de cultivo MS al 50% enriquecido.
Palabras clave: Cyrtochilum, crecimiento, Epidendrum, medios de cultivo, Oncidum
ABSTRACT
The present research was developed in the Scientific Subdivision of the Botanical Garden of Bogotá José Celestino Mutis (Colombia). The objective was to determine the nutritional conditions for asymbiotic germination and for plantar growth from protocorms of five native wild orchids Epidendrum oxysepalum, Epidendrum chioneum, Epidendrum nocturnum, Oncidium pyramidale and Cyrtochilum revolutum. The basal culture medium consisted of the MS salts reduced by 50% enriched or not with organic supplements, auxins and cytokinins. At the end of two months of evaluation, the MS culture medium reduced by 50% in its salts, myo-inositol, vitamins, banana pulp, sucrose, cinnamon powder and agar was determined to be the most suitable for E. oxysepalum, E. chioneum, E. nocturnum, O. pyramidale and C. revolutum, from capsules in a state of physiological maturity and not dehiscent (closed). In immature seeds of E. oxysepalum no germination processes were observed in any of the two asymbiotic germination culture media evaluated. In vitro growth, in terms of apical length increase index, evaluated for three months for E. nocturnum and O. pyramidale protocorms, was favored by the use of 50% enriched MS culture medium.
Keywords: culture medium, Cyrtochilum, in vitro growth, Epidendrum, Oncidum
INTRODUCCIÓN
Colombia forma parte de los países de Suramérica con mayor riqueza y con más especies de orquídeas, con 4 270 especies registradas, de las cuales 1 572 son especies exclusivas del país.
Características como la belleza de sus flores, lo enigmático de sus relaciones bióticas, la adaptabilidad a los ambientes en donde crecen y los variados hábitos de crecimiento que presentan, hacen que éste sea uno de los grupos de plantas más apetecidos y fascinantes, situación que ha provocado su comercio intensivo y no controlado y su extracción inmisericorde e ilegal de sus ambientes naturales (Betacour et al., 2015). Lo anterior, unido a la degradación, transformación o destrucción de sus hábitats, hace que varias especies estén consideradas en peligro de extinción (Hágsater et al., 2005).
Además de los factores externos mencionados, las orquídeas presentan factores intrínsecos que limitan su propagación sexual y la variación genética que en ellas se puede presentar. Estos factores están relacionados con el pequeño tamaño de las semillas y sus escasas reservas alimenticias, que las lleva a establecer asociaciones simbióticas principalmente con micorrizas para lograr su germinación, la cual en condiciones naturales, puede llegar a ser sólo de un 2-3% (Luan et al., 2006). Es así como las técnicas in vitro se presentan como una estrategia para la conservación ex situ de orquídeas debido a que facilita la germinación de todas las semillas de las cápsulas de las orquídeas que se encuentren bien maduras, permite la producción de un gran número de plantas en un corto periodo de tiempo y se logra reducir en un 85% aproximadamente el tiempo de germinación (Pedroza-Manrique et al., 2010).
En este contexto, la Subdirección Científica del Jardín Botánico de Bogotá José Celestino Mutis (JBB), consciente de la importancia de contribuir en la conservación ex situ de la familia Orchidaceae, ha fortalecido las líneas de investigación en propagación vegetal, con el objetivo de desarrollar investigaciones relacionadas con la aplicación de las técnicas in vitro para la recuperación, conservación y propagación de orquídeas nativas. Los resultados han resaltado la importancia de ahondar progresivamente en el desarrollo de protocolos de propagación in vitro para las especies de la familia Orchidaceae, han enriquecido los registros de publicación existentes y han brindado las bases para el establecimiento de un sistema de micropropagación, a partir de la colección de germoplasma base conformada.
Teniendo en cuenta lo mencionado, se planteó la presente investigación que tuvo como objetivo determinar las condiciones nutritivas para la germinación asimbiótica y para el crecimiento in vitro de cinco orquídeas silvestres nativas. Se busca que con los métodos y resultados aquí expuestos se puedan brindar bases para la reproducción in vitro de las especies priorizadas de las cuales hay escasos trabajos de investigación publicados (Rodríguez et al., 2007), que a su vez permita el establecimiento de un sistema de micropropagación como una estrategia de conservación ex situ de Epidendrum oxysepalum, E. chioneum, E. nocturnum, Oncidium pyramidale y Cyrtochilum revolutum.
MATERIALES Y MÉTODOS
La investigación se realizó en el laboratorio de cultivo de tejidos vegetales de la Subdirección Científica del JBB.
Material vegetal
Las especies en las cuales se llevaron estudios de germinación asimbiótica o crecimiento plantular a partir de protocormos fueron Epidendrum oxysepalum Hágsater & E. Santiago, Epidendrum chioneum Lindl., Epidendrum nocturnum Jacq., Oncidium pyramidale Lindl. y Cyrtochilum revolutum (Lindl.) Dalström. Los criterios de priorización de las especies estuvieron relacionados principalmente con el origen (nativas), la accesibilidad a las poblaciones y la disponibilidad de cápsulas necesarias para el establecimiento del cultivo in vitro.
Germinación asimbiótica
En el presente estudio, se manejó por especie procedente de una única fuente de material vegetal. Para la colecta de cápsulas de las especies E. oxysepalum, O. pyramidale y C. revolutum, se realizaron salidas de campo en las áreas de distribución natural localizadas en las localidades de Usme, Ciudad Bolívar y Sumapáz (Bogotá D.C., Colombia). Para E. chioneum y E. nocturnum, la colecta se llevó a cabo en la colección especializada para la conservación (CEPAC) de orquídeas del JBB.
Las cápsulas se colectaron en estado no dehiscente y con madurez fisiológica. Este último factor no fue posible para E. oxysepalum, debido a que las cápsulas, en el momento de la colecta, estaban inmaduras.
En el laboratorio, la cápsula se envolvió en papel aluminio y se colocó dentro de un sobre de papel kraft en refrigeración a 4°C hasta el momento de su uso. Bajo las condiciones de asepsia que brinda la cabina de flujo laminar, este material vegetal fue sometido a un esquema de desinfección superficial establecido por Pérez-Martínez y Pacheco (2005), que consiste en colocar la cápsula en una solución jabonosa concentrada (2%) durante cinco minutos, aplicar tres enjuagues con agua microfiltrada estéril y limpiar su superficie con un algodón estéril humedecido con hipoclorito de sodio al 13%, realizando finalmente, aspersión con alcohol al 70% y flameado.
A la cápsula ya desinfectada, se le realizó un corte longitudinal para llevar a cabo la siembra uniforme de sus semillas en dos medios de cultivo, cuya composición estuvo basada en las sales minerales MS (Murashige y Skoog, 1962) reducidas en un 50% (MS al 50%), enriquecido con: mio-inositol 50 mg l-1, niacina 0.25 mg l-1, piridoxina 0.25 mg l-1, tiamina 0.05 mg l-1, glicina 1.0 mg l-1, sacarosa 40 g l-1, carbón activado 2.0 g l-1, canela en polvo 1.5 g l-1, pulpa de banano 60 g l-1 y agar 6.0 g l-1 como agente gelificante y sin o con el suplemento ácido indol butírico (AIB) a 2.5 mg l-1 (TG1 y TG2, respectivamente).
La unidad experimental correspondió al frasco de vidrio que contenía 20 ml del medio de cultivo. La cantidad y tamaño de las cápsulas fue variable entre las especies, lo que conllevó a diferencias en el número de repeticiones: cinco para E. chioneum, cinco para E. oxysepalum, diez para O. pyramidale, 15 para E. nocturnum y 20 para C. revolutum. Se realizó observación directa al estereomicroscopio de semillas de cada una de las especies, lo cual permitió verificar la presencia de embrión en ellas.
La germinación se registró a partir del momento en el que se observó coloración verde acentuada del embrión y aumento del tamaño en circunferencia y longitud (engrosamiento), que ocasionó el rompimiento de la testa y por tanto, el inicio de la germinación (Flores-Escobar et al., 2008). El registro de la variable se llevó a cabo cada siete días, por observación directa, mediante la determinación del área (dentro del frasco) ocupada por las semillas que iniciaron el proceso germinativo, según lo descrito anteriormente. El seguimiento al porcentaje de germinación se llevó a cabo durante dos meses, tiempo en el cual se tomaron 880 datos.
Crecimiento in vitro a partir de protocormos
Protocormos de E. nocturnum y O. pyramidale, provenientes del medio de cultivo de germinación TG1, que poseían un vástago no superior a 0.4 cm de longitud, fueron empleados como explantes para la evaluación del crecimiento, relacionado con longitud de la parte aérea (apical).
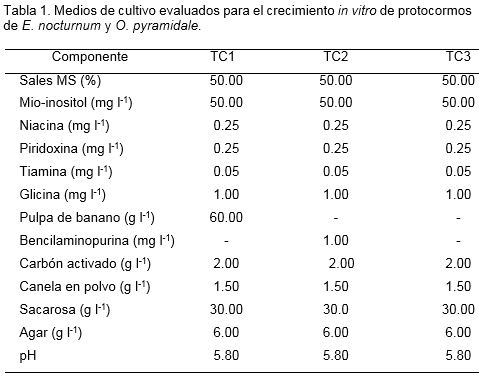
Los protocormos de cada especie se cultivaron en tres medios de cultivo (TC1, TC2 y TC3) basados en las sales MS al 50% y mio-inositol, niacina, piridoxina, tiamina y glicina (Tabla 1). La unidad experimental estuvo constituida por dos explantes en un frasco de vidrio que contenía 20 ml del medio de cultivo.
Para E. nocturnum se manejaron 20 repeticiones por tratamiento, para un total de 120 registros semanales y para O. pyramidale, se emplearon 14 repeticiones por tratamiento (84 registros semanales). La variable longitud apical (cm) fue medida desde la base del protocormo hasta la zona distal de la hoja más larga del explante. La evaluación se realizó cada 15 días, durante 12 semanas. Como herramienta de medición se utilizó una regla graduada con aproximación milimétrica. Con los datos registrados quincenalmente, se construyeron las curvas de crecimiento del material vegetal en función del tiempo y se determinaron los respectivos índices de incremento de crecimiento (IIC), en términos de longitud apical. El IIC se calculó mediante la fórmula (Vilchez et al., 2009): IIC = (MT-MLI) / MLI, donde MT es la longitud final y MLI es la longitud inicial del explante.
Las sales minerales, vitaminas, mio-inositol, AIB y BAP, empleados en cada una de las fases de propagación in vitro, fueron de grado analítico. El pesaje se llevó a cabo en una balanza analítica de precisión y la preparación se hizo en agua microfiltrada. Las soluciones de estos compuestos fueron añadidas al medio de cultivo antes de su esterilización en autoclave. En el proceso, se emplearon recipientes de vidrio, con un volumen de 20 ml de medio de cultivo en cada uno de ellos. El pH del medio de cultivo, se ajustó a 5.8 antes de añadir el agar y la esterilización se realizó en una autoclave durante15 minutos, con una temperatura de vapor aproximada de 121.5 C. Los cultivos, permanecieron en la sala de incubación del laboratorio, a una temperatura mínima de 24°C y máxima de 27°C , con una humedad relativa del 55% al 70% y un fotoperiodo de 16 h luz (intensidad lumínica de 40 μmol m-2 s-1, provista por lámparas de luz fluorescente tipo blanco-frío) y 8 h de oscuridad.
Análisis estadístico
Para la evaluación de los ensayos, se aplicó un diseño experimental completamente al azar para cada una de las etapas desarrolladas. Se realizó la transformación arcoseno para los porcentajes de germinación registrados en la última semana de evaluación, con el objetivo de normalizar los datos y establecer homogeneidad de las varianzas. Con el programa estadístico SAS ® 9.0, se sometieron los datos a un análisis de varianza ANOVA y la prueba de rangos múltiples de Duncan (con base en un 95% de confiabilidad), para poder determinar el efecto de los distintos medios de cultivo.
RESULTADOS Y DISCUSIÓN
Germinación asimbiótica
En el presente trabajo, para ninguna de las especies estudiadas se llevaron a cabo pruebas de viabilidad de las semillas, sin embargo, la calidad y madurez de las semillas fue confirmada al observarse, con la ayuda del estereomicroscopio, que éstas presentaban embrión bien formado. Así mismo, durante el momento de su siembra en los dos medios de cultivo, las semillas no presentaban agrupamientos y se desprendieron con facilidad de la cápsula.
Los dos medios de cultivo ensayados (TG1 y TG2, sin y con AIB a 2.5 mg l-1, respectivamente), brindaron las condiciones nutritivas favorables para la germinación de E. oxysepalum, O. pyramidale, E. nocturnum y C.revolutum. Sin embargo, para E. oxysepalum, la inmadurez del embrión fue determinante en los valores nulos de la variable porcentaje de germinación (Fig. 1). Por lo tanto, los medios de cultivo, no cumplieron con las exigencias nutritivas para que el embrión inmaduro de las semillas rompiera la latencia y diera inicio a su desarrollo fisiológico.

Se consideró útil el empleo de cápsulas inmaduras de E. oxysepalum, debido a que semillas inmaduras de otros géneros (Lelia, Cattleya, Brassavola y Encyclia), han brindado resultados positivos de germinación in vitro (Damon et al., 2004; Barrera et al., 2005; Aguilar-Morales y López-Escamilla, 2013). Específicamente, Aguilar-Morales y López-Escamilla (2013) refirieron que las semillas inmaduras de Laelia speciosa (Kunth) Schltr., registraron un 100% de germinación in vitro, a diferencia de las semillas maduras para las que la germinación fue nula (0%). Éstos resultados, estuvieron relacionados con la calidad de las semillas provenientes de la cápsula madura, ya que éstas estaban vacías o carecían de embrión, mientras la cápsula inmadura presentó tanto semillas vacías como semillas con presencia de embrión.
En general, las semillas de una cápsula verde, permanecen en estado de latencia, en el cual no se logra alcanzar una etapa mínima de desarrollo y por lo tanto se restringe la germinación. El medio de cultivo para un embrión inmaduro, exige condiciones especiales diferentes a las que contienen otros medios de cultivo para la germinación asimbiótica (Pedroza-Manrique et al., 2010), relacionadas con el empleo de nutrientes específicos, como la glutamina (fuente de nitrógeno), la cual se considera que puede beneficiar el crecimiento de embriones inmaduros (Pierik, 1990).
Para E. chioneum, O. pyramidale, E. nocturnum y C.revolutum, el porcentaje semanal de germinación mostrado en la figura 1, corresponde al promedio registrado en las repeticiones, según el medio de cultivo (TG1 y TG2). La germinación empezó a registrarse en los dos medios de cultivo a partir de la segunda semana después de la siembra, excepto en C. revolutum. Tres semanas después, los valores promedios mínimos (2%) y máximos (77%) se presentaron en C. revolutum en TG2 y en E. nocturnum en TG1, respectivamente.
En la octava semana de evaluación, no se encontraron diferencias significativas para E. chioneum, O. pyramidale y C. revolutum (P= 0.3466; P= 0.5372; y P= 0.6494) en el análisis de varianza ANOVA. Sin embargo, la germinación fue observada más tempranamente y con mayores valores al término del tiempo de evaluación en las semillas colocadas en el medio de cultivo TG1, donde el AIB (2.5 mg l-1) no estaba presente. Al emplear este medio de cultivo, los porcentajes de germinación finales fueron 100%, 84% y 87%, respectivamente.
La germinación de E. nocturnum se vio significativamente afectada por la composición del medio de cultivo (P= 0.0395). La prueba Duncan determinó dos grupos homogéneos, donde el medio de cultivo TG1 sobresalió al permitir un 100% para la variable evaluada. De ésta manera, el TG1 (basado en las sales MS al 50%), se consideró como el medio de cultivo apropiado para la germinación de las especies evaluadas. Se lograron óptimos resultados en tiempo y porcentajes de germinación y permitió una reducción de los costos de producción al no emplearse reguladores del crecimiento.
Todos los tratamientos, manejaron como base el medio de cultivo MS. Su empleo en diferentes proporciones, ha brindado resultados óptimos para la germinación y crecimiento de diversas especies de orquídeas, gracias a su contenido de sales inorgánicas, carbohidratos, vitaminas y aminoácidos, lo que brinda un alto grado de nitrógeno y potasio, necesarios para la nutrición (Salazar y Mata, 2003; Flores-Escobar et al., 2011; Salazar-Mercado, 2012).
Específicamente, en la etapa de germinación evaluada en la presente investigación, el empleo del medio de cultivo MS al 50% junto a la pulpa de banano y el carbón activado, se basó en los resultados favorables que han proporcionado en la germinación in vitro de otras especies de orquídeas pertenecientes principalmente a los géneros Laelia, Bletia, Epidendrum, Eulophia, Oncydium y Prosthechea (Rodríguez et al., 2007; Aguilar-Morales y López- Escamilla, 2013). El uso de AIB en el medio de cultivo TG2, respondió a los resultados de otras investigaciones que relacionan su presencia unida a altas concentraciones de sacarosa, como favorables en la promoción del desarrollo de embriones inmaduros de orquídeas (Pedroza-Manrique et al., 2010).
La germinación de semillas de orquídeas cultivadas in vitro a partir de cápsulas, varía dependiendo de su madurez, de la calidad de la semillas y del tipo de orquídea, sin embargo, los informes de diferentes autores mencionan que en promedio germinan después de 30 y 60 días de cultivo (Ávila y Salgado-Garcigilia, 2006). Según Yamazaki y Miyoshi (2006) y Ávila y Salgado (2006), no todas las orquídeas requieren de reguladores de crecimiento para la germinación, ya que generalmente los embriones contienen concentraciones endógenas de hormonas para iniciar su desarrollo (Montoya, 1991). Dichas observaciones coinciden con los resultados de este trabajo.
En este sentido, Rodríguez et al. (2007), realizaron estudios de germinación asimbiótica in vitro de 15 especies de orquídeas silvestres, para las cuales la germinación se presentó en el 60% al emplear medios de cultivo sin reguladores del crecimiento y a los que se adicionaron carbón activado (1.5 g l-1), luego de un periodo de tiempo de seis y 40 semanas. En el presente estudio, los porcentajes de germinación se obtuvieron en ocho semanas y los valores oscilaron entre el 84% y el 100%, para cuatro de las cinco especies silvestres de orquídeas. Esto fue posible, al emplear un medio de cultivo MS al 50%, con mio-inositol, niacina, piridoxina, tiamina, glicina, sacarosa y pulpa de banano. Este último compuesto, al igual que otras sustancias orgánicas como el agua de coco, contiene altas concentraciones de azúcares, aminoácidos, antioxidantes, minerales, ácidos orgánicos y agentes promotores del crecimiento vegetal (Arditti, 1993). Su empleo es de gran importancia para favorecer procesos germinativos o para el desarrollo y aclimatización de orquídeas debido a que estimula el crecimiento y la formación de raíces y pseudobulbos. Además, posee la ventaja de su bajo costo comparado con el de reguladores de crecimiento como las auxinas y citoquininas (Minea et al., 2004; Moreno y Menchaca, 2007; Flores-Escobar et al., 2008; 2011; Salazar-Mercado, 2012).
Es oportuno referir que además del medio de cultivo y del estado de madurez, existen otros factores que no fueron evaluados en el presente estudio pero que pueden influir en la germinación asimbiótica in vitro de orquídeas. Tales factores son la calidad de semillas, relacionada directamente con la viabilidad (Salazar-Mercado, 2012) y la fuente de material vegetal. El conjunto de estos factores puede tener una incidencia particular para cada especie, y de modo general, puede reportar beneficios importantes en el proceso germinativo bajo condiciones de laboratorio.
Crecimiento in vitro a partir de protocormos
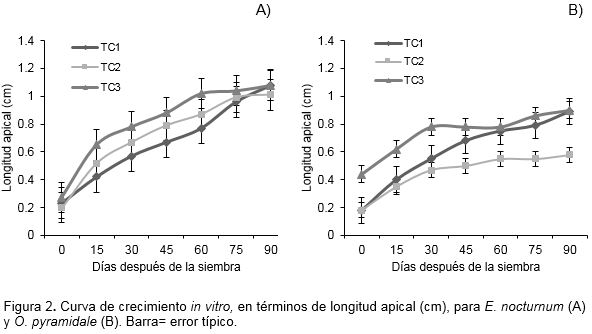
En la figura 2, se representa la curva de crecimiento para E. nocturnum y O. pyramidale, basada en los promedios de la longitud apical (cm), registrados periódicamente (15, 30, 45, 60, 75 y 90 días después de la siembra) en los medios de cultivo mencionados.
Al aplicar el análisis de varianza (ANOVA) a los IIC basados en los valores de longitud apical registrados quincenalmente (Figura 3), se determinó que para E. nocturnum, los medios de cultivo ensayados no difirieron significativamente, excepto en los datos tomados 15 días después de la siembra, donde TC2 y TC3 presentaron las mayores medias (1.67 y 1.45) seguido por el TC1 (1.03). Al término del tiempo de evaluación (90 días), los explantes en el medio de cultivo TC1 presentaron un IIC igual a 4.15, el cual es mayor a los valores observados en TC2 y TC3 (3.97 y 3.24). Para O. pyramidale, se presentaron quincenalmente diferencias entre los medios de cultivo ensayados (15 días P= 0.0113; 30 días P= 0.0053; 45 días P= 0.0006; 60 días P= 0.0003; 75 días P= 0.0011 y 90 días P= 0.0004). Con la prueba de rangos múltiples de Duncan, los medios de cultivo TC1 y TC2 conformaron, desde el día 15 hasta el día 75, un grupo homogéneo con las mayores medias. 90 días después de la siembra, el TC1 se consideró el medio de cultivo apropiado al brindar un IIC igual a 4.65, estadísticamente diferente a los valores alcanzados por TC2 y TC3 (3.04 y 1.12).
Lo planteado anteriormente, determina que la tasa de crecimiento in vitro, medida en IIC de longitud apical, difirió entre E. nocturnum y O. pyramidale, lo cual puede ser un reflejo de su tasa de crecimiento in vivo o puede indicar que algunas especies satisfacen mejor que otras sus necesidades nutricionales en el medio de cultivo basal utilizado (Molphe et al., 2012). Además, es importante tener en cuenta que las especies silvestres de orquídeas, presentan lento crecimiento y en algunas ocasiones, necesitan más de un año en condiciones in vitro para alcanzar entre 3 – 5 cm de altura (Rodríguez et al., 2010).
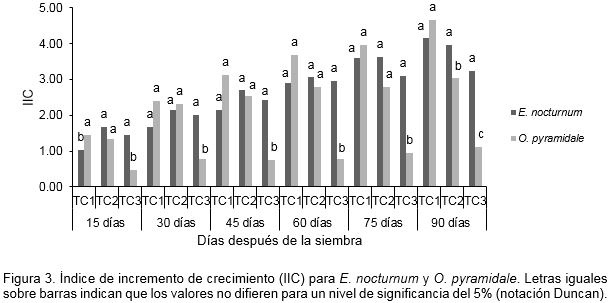
En términos nutricionales, la tasa de crecimiento in vitro, se vio favorecida por la adición de sustancias como la pulpa de banano o BAP, las cuales se encuentran representadas en los medios de cultivo TC1 y TC2. En contraste, al emplear el medio de cultivo TC3, carente de éstos compuestos, la tasa de crecimiento (medida en IIC), fue menor. Estos resultados, apoyan los presentados por Moreno y Menchaca (2007); Flores-Escobar et al. (2008 y 2011) y Salazar-Mercado (2012), quienes indicaron que el cultivo in vitro de orquídeas, puede ser favorecido por la adición al medio de cultivo de suplementos orgánicos o reguladores del crecimiento. Lo anterior también fue confirmado por Kaur y Bhutani (2012), quienes concluyeron que con el empleo de homogeneizado de banano (50 g l-1), los explantes (protocormos) de Cymbidium pendulum (Roxb.) Sw., presentaron la más alta tasa de regeneración, con formación de brotes vigorosos y de raíces.
Teniendo en cuenta los resultados al término del tiempo de evaluación (90 días), el medio de cultivo TC1 (MS al 50%, mio-inositol 50 mg l-1, niacina: 0.25 mg l-1, piridoxina: 0.25 mg l-1, tiamina 0.05 mg l-1, glicina 1 mg l-1, sacarosa 30 g l-1, carbón activado: 2 g l-1, canela en polvo 1.5 g l-1, pulpa de banano: 60 g l-1 y agar 6 g l-1), se consideró como el más indicado para favorecer la longitud apical en E. nocturnum y O. pyramidale. Las ventajas de este medio de cultivo se relacionan principalmente con su composición reducida en sales inorgánicas, mio-inositol y vitaminas, y a su carencia de reguladores del crecimiento, que puede verse reflejada también en la reducción de costos de producción. El mayor conocimiento que existe en cuanto a los demás factores que influyen en el cultivo in vitro, ha conllevado al empleo de medios de cultivo sencillos (Pedroza-Manrique y Bejarano, 2008). Uno de estos factores, está relacionado con las concentraciones endógenas de auxinas y citoquininas presentes en los explantes, las cuales dependen de la especie y del tipo de explante (Pedroza y Micán, 2006).
CONCLUSIONES
El medio de cultivo MS modificado (MS al 50%), enriquecido con pulpa de banano y sin reguladores del crecimiento, favoreció la germinación asimbiótica de E. chioneum, O. pyramidale, C. revolutum y E. nocturnum. El anterior medio de cultivo, igualmente brindó condiciones nutritivas óptimas para el crecimiento in vitro (en términos de longitud apical) de E. nocturnum y O. pyramidale.
Con los nulos porcentajes de germinación asimbiótica obtenidos en E. oxysepalum, se puede brindar fundamentos para determinar que la madurez fisiológica de las semillas es un factor influyente y necesario para el rompimiento de la latencia e inicio del proceso germinativo.
Es necesario el desarrollo de estudios complementarios que permitan dilucidar aspectos nutricionales y ambientales (combinaciones de sustancias orgánicas y requerimientos de luz, entre otros), que pueden influir en los procesos in vitro de las especies estudiadas. Sin embargo, se considera que con los resultados aquí presentados, ha sido posible identificar la respuesta in vitro de estas especies, lo cual puede aportar en el desarrollo de un sistema de producción de plantas in vitro, como estrategia de conservación ex situ. Lo anterior se considera importante, principalmente por ser especies nativas, silvestres, con gran potencial ecológico y con escasos trabajos publicados.
AGRADECIMIENTOS
Al Jardín Botánico de Bogotá José Celestino Mutis (JBB) y al equipo de trabajo del programa Manejo de especies vegetales en la región capital de la Subdirección Científica, por su contribución en el desarrollo del estudio.
REFERENCIAS
Aguilar-Morales M, López-Escamilla A (2013) Germinación in vitro de Laelia speciosa (Kunth) Schltr., una herramienta para su conservación ex situ. Estudios científicos en el estado de Hidalgo y zonas aledaña 3: 18 - 25
Arditti J, Ernst R (1993) Micropropagation of Orchids. John Wiley-Sons Inc, New York; ISBN: 0471549053
Ávila I, Salgado-Garciglia R (2006) Propagación y mantenimiento in vitro de orquídeas mexicanas, para colaborar en su conservación. Biológicas 8: 138 - 149
Damon A, Aguilar-Guerrero E, Rivera L, Nikolaeva V (2004) Germinación in vitro de semillas inmaduras de tres especies de orquídeas de la región del Soconusco, Chiapas, México. Revista Chapingo Serie Horticultura 10 (2): 195 - 203
Flores-Escobar, G, Gil-Vásquez I, Colinas-León M, Mata-Rosas M (2011) Propagación in vitro de la orquídea Brassia verrucosa Bateman ex. Lindl. Revista Chapingo Serie Horticultura 17(1): 5 – 8
Flores-Escobar G, Legaria-Solano J, Gil-Vásquez I, Colinas-León M (2008) Propagación in vitro de Oncidium stramineum Lindl. una orquídea amenazada y endémica de México. Revista Chapingo Serie Horticultura 14(3): 347 – 353
Hágsater E M, Soto A, Salazar G A, Jiménez R, López M A, Dressler R L (2005) Las orquídeas de México. Instituto Chinoin AC, México DF
Kaur S, Bhutani K (2012) Organic growth supplement stimulants for in vitro multiplication of Cymbidium pendulum (Roxb.) Sw. Hort Sci (Prague) 39 (1): 47 – 52
Luan VQ, Thien NQ, Khiem DV, Nhut DT (2006) In vitro germination capacity and plant recovery of some native and rare orchids. En: Thuy L T, Hau N V (eds) Proceedings of International Workshop on Biotechnology in Agriculture, Nong Lam University, 20-21/10/2006, pp. 175 – 177. Ho Chi Minh City
Minea M, Piluek C, Menakanit A, Tantiwiwat S (2004) A Study on Seed Germination and Seedling Development of Spathoglottis Bl. Orchids. Kasetsart J (Nat Sci) 38 (4): 141-156
Betancur J, Sarmiento-L H, Toro-González L, Valencia J (2015) Plan para el estudio y la conservación de las orquídeas en Colombia, Ministerio de Ambiente y Desarrollo Sostenible, Colombia. Universidad Nacional de Colombia, Bogotá DC
Molphe E, Esparza M, Pérez M (2012) Conservación in vitro de germoplasma de Agave spp. bajo condiciones de crecimiento retardado. Rev Fitotec Mex 35(4): 279 - 287
Montoya L (1991) Cultivo de tejidos vegetales. Universidad Nacional de Colombia, Medellín
Moreno D, Menchaca R (2007) Efecto de los compuestos orgánicos en la propagación in vitro de Stanhopea tigrina Bateman (Orchidaceae). Foresta Veracruzana 9(2): 27 - 32
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco cultures. Physiologia Plantarum 15:473 - 497
Pedroza J, Micán, Y (2006) Asymbiotic germination of Odontoglossum gloriosum (Orchidaceae) under in vitro conditions. In Vitro Cell Dev Biol Plant 42(6): 543 – 547
Pedroza-Manrique J, Bejarano-T A (2008) Propagación vegetativa in vitro de Puya santossi. Revista Colombiana de Biotecnología 10(1): 36 - 48
Pedroza-Manrique J, Serrato-Muñoz L, Castaño-Robayo M (2010) Efecto del carbón activado y ácido indol acético en el desarrollo de protocormos de Masdevallia coccinea Linden ex Lindl. y Maxillaria nutans Lindl. Revista Colombiana de Biotecnología 12(2): 86-102
Pérez-Martínez, B, Pacheco R (2005) Germinación in vitro de Masdevallia ignea Rchb.f (Orchidaceae) a partir del cultivo de semillas provenientes de diferentes tipos de polinización. Revista Pérez Arbelaezia 16: 45 -55
Pierik R L M (1990) Cultivo in vitro de las plantas superiores. Mundi-Prensa, Madrid; ISBN: 8471142678
Rodríguez L, González R, Alvarado K, Telles E (2007) Germinación asimbiótica in vitro de semillas de orquídeas silvestres. Biotecnología Vegetal 7(3): 139 - 142
Rodríguez L, González M, González R (2010) Micropropagación de Encyclia phoenicea (Lindl.) Neum, orquídea epífita endémica de Cuba. En: Congreso Científico del INCA XVII, San José de las Lajas, 22-26/11/2010, pp. Instituto Nacional de Ciencias Agrícolas, San José de las Lajas; ISBN: 978-959-7023-47-0
Salazar V, Mata M (2003) Micropropagación y conservación de orquídeas mexicanas en el Jardín Botánico Clavijero. Lankesteriana 7: 151-153
Salazar-Mercado S (2012) Germinación asimbiótica de semillas y desarrollo in vitro de plántulas de Cattleya mendelii Dombrain (Orchidaceae). Acta Agronómica 61(1): 69 - 78
Vilchez J, Rivas Y, Albany N, Molina M, Martínez L (2009) Efecto de la N6-bencilaminopurina sobre la multiplicación in vitro de ocumo criollo (Xanthosoma sagittifolium L. Schott.). Rev Fac Agron (LUZ) 26: 212-222
Yamazaki J, Miyoshi K (2006) In vitro asymbiotic germination of immature seed and formation of protocorm by Cephalanthera falcata. Oxford Journals 98: 1197 – 1206
Recibido: 31-05-2016
Aceptado: 13-07-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
