Artículo original
Biotecnología Vegetal Vol. 16, No. 3: 153 - 160, julio - septiembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del CO2 sobre el desarrollo de embriones somáticos de Coffea arabica L. cv. ‘Caturra rojo’ y Clematis tangutica K.
Effect of CO2 on somatic embryos development Coffea arabica L. cv. ‘Caturra rojo’ and Clematis tangutica K.
Raúl Barbon1, Walter Preil2, Alina Capote1, Elio Jiménez3
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: raulb@ibp.co.cu
2Private address. Birkenhöhe 28. Ammersbek. Germany. 22949.
RESUMEN
Los estudios para optimizar la embriogénesis somática se han centrado tradicionalmente en los componentes del medio de cultivo pero se han analizado poco otros factores del ambiente in vitro como es la composición de la atmósfera gaseosa. El objetivo de este trabajo fue determinar la influencia del CO2 en el desarrollo del embrión somático durante la transición de la etapa globular a la etapa de torpedo. La investigación se realizó en dos especies modelo de embriogénesis somática que se desarrollan en zonas climáticas diferentes: Coffea arabica L. cv. ‘Caturra rojo’ y Clematis tangutica K. Se emplearon tres concentraciones de CO2 (2.5, 5.0 y 10.0%) combinado con 21% O2 y dos controles (intercambio pasivo y ventilación forzada). Se demostró el efecto del CO2 sobre la diferenciación de los embriones somáticos en etapa globular a torpedo en cafeto y clematis, ya que en los tratamientos con intercambio pasivo, donde hubo acumulación de CO2, la diferenciación de embriones somáticos fue superior a los tratamientos con ventilación forzada. Con 5.0% de CO2 se estimuló el proceso de diferenciación de los embriones en etapa globular, pues en el tratamiento con esta concentración de CO2 para cafeto y clematis se obtuvo la mayor proporción de embriones en etapas de torpedo y bajos niveles de malformación.
Palabras clave: ambiente in vitro, diferenciación, dióxido de carbono, embriogénesis somática
ABSTRACT
Studies to optimize somatic embryogenesis have traditionally focused on the components of the culture medium but little other in vitro environment factors have been analyzed such as the composition of the gaseous atmosphere. The objective of this work was to determine the influence of CO2 on the development of the somatic embryo during the transition from the globular to the torpedo stage. The research was carried out on two model species for somatic embryogenesis that they are developed in different climatic zones: Coffea arabica L. cv. ‘Caturra rojo’ and Clematis tangutica K. Three CO2 concentrations (2.5, 5.0 and 10.0%) combined with 21% O2 and two controls (passive exchange and forced ventilation) were used. The effect of CO2 on the differentiation of somatic embryos from globular to torpedo stage in coffee and clematis was demonstrated, since in the treatments with passive exchange, where there was accumulation of CO2, the differentiation of somatic embryos was superior to treatments with forced ventilation. With 5.0% CO2 the process of differentiation of the embryos in the globular stage was stimulated, because in the treatment with this concentration of CO2 for coffee and clematis the highest proportion of embryos in torpedo stages and low levels of malformation were obtained.
Keywords: carbon dioxide, differentiation, in vitro environment, somatic embryogenesis
INTRODUCCIÓN
La embriogénesis somática está llamada a ser dentro de poco tiempo la nueva vía de propagación masiva para diferentes especies de plantas porque brinda una serie de ventajas como es la obtención de volúmenes de producción superiores en un menor periodo de tiempo y a un costo más bajo con respecto a la propagación por organogénesis (Etienne et al., 2016). Sin embargo, a pesar de haberse descrito el desarrollo de la embriogénesis somática en un gran número de especies, todavía es necesario un mayor estudio básico de este proceso y de sus bases bioquímicas (Shimazu y Kurata, 1999; Aslam et al., 2011) que permitan incrementar su eficiencia y repetibilidad.
La optimización de la embriogénesis somática se centró inicialmente en los componentes fundamentales del medio de cultivo, y posteriormente se han continuado estudios sobre la influencia de la atmósfera gaseosa dentro del frasco de cultivo y biorreactores (Zavattieri et al., 2010). Sobre esto último se ha tomado de base la fisiología de los embriones cigóticos en la semilla botánica, donde hay una disminución paulatina del oxígeno y un aumento del dióxido de carbono (Miyoshi y Sato, 1997).
Con el avance del desarrollo de la embriogénesis somática en diferentes cultivos y las ventajas que esta brinda, se han realizado investigaciones sobre el efecto de componentes del ambiente in vitro como oxígeno y dióxido de carbono en el desarrollo morfogenético de los embriones somáticos (Hohe et al., 1999; Huang et al., 2006; Barbón et al., 2008) y otros gases como el etileno (Auboiron et al., 1990; Meskaoui et al., 2006) con el objetivo de optimizar el proceso y aumentar la calidad de los embriones somáticos. Sin embargo, aspectos tales como la influencia del CO2 durante las fases de la embriogénesis somática y en específico la diferenciación de los embriones somáticos y su correspondiente transición de una etapa a otra de desarrollo en Coffea y Clematis que se han utilizado como plantas modelo podría contribuir aún más al conocimiento de la influencia del ambiente in vitro en la embriogénesis somática.
El objetivo de este trabajo fue determinar el efecto del ambiente in vitro durante el desarrollo morfogenético de embriones somáticos en etapa globular a etapa de torpedo en dos especies de plantas de diferentes zonas climáticas.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon embriones somáticos de Coffea arabica L. cv. ‘Caturra rojo’ y Clematis tangutica K. en etapas iniciales de desarrollo (globular). Los embriones somáticos fueron obtenidos de suspensiones celulares embriogénicas en fase de diferenciación a partir de la metodología propuesta por Barbón et al. (2003).
Efecto del CO2 sobre el desarrollo de embriones somáticos
Para determinar el efecto del CO2 sobre el desarrollo de embriones somáticos se emplearon tres concentraciones de CO2 (2.5, 5.0 y 10.0%) combinadas con 21% de oxígeno y dos controles (intercambio pasivo y ventilación forzada). Se colocó un embrión somático en etapa globular por tubo Eppendorf de 2.0 ml de volumen (Figura 1A), cada uno con un volumen de 1.8 ml de medio de cultivo en estado semisólido y 25 de estos se colocaron en un frasco de cultivo modificado para mantener las concentraciones de dióxido de carbono constantes en el tiempo (Figura 1B).

Se realizó una selección de embriones en etapa globular de acuerdo con una caracterización morfológica típica de esa etapa de desarrollo como es la forma redondeada y coloración crema clara (Código hexadecimal: #886A08). Se colocaron 25 embriones somáticos por frasco de cultivo y un total de seis frascos por tratamiento. Los medios de cultivo utilizados fueron los empleados para la formación y diferenciación de embriones somáticos. Para Clematis se utilizó un medio de cultivo en estado semisólido compuesto por las sales Gamborg et al. (1968), 0.2 mg l-1 de ácido indolacético (AIA), 0.5 mg l-1 de 6-Bencilaminopurina (6-BAP) y 3% de sacarosa; mientras que, para cafeto se empleó un medio de cultivo compuesto por las sales de Murashige y Skoog (1962), 1.0 mg l-1 6-BAP y 3% de sacarosa. El pH de los medios de cultivo fue ajustado a 5.7 con NaOH (0.5 N) y HCl (0.5 N) antes de la esterilización en autoclave, a 121oC y 1.2 kg cm-2, durante 20 minutos. Se evaluaron las siguientes variables a los 42 días cultivo:
número de embriones somáticos que alcanzaron la etapa de torpedo,
número de embriones con embriogénesis somática secundaria asociada,
número de embriones viables, se consideró aquellos embriones somáticos que desarrollaron a etapa de torpedo, presentaron embriogénesis somática secundaria asociada o sin desarrollar lo anterior mencionado pero mostraron vitalidad mediante prueba de fluoresceína diacetato (Widholm, 1972),
número de embriones somáticos con malformaciones, se refiere a la cuantificación de los embriones somáticos que no poseen el aspecto morfológico típico (forma, apariencia, color) de la etapas de desarrollo morfogenético de las especies dicotiledóneas.
Los datos experimentales se procesaron estadísticamente mediante un análisis de homogeneidad de varianza mediante la prueba de Bartlett y las medias fueron comparadas usando la prueba de rangos múltiples de Bonferroni. Para la variable número de embriones malformados se modificaron los datos mediante la transformación arcosen (x)½. El programa estadístico empleado fue SAS GLM (SAS Institute Inc., Cary, NC, USA).
RESULTADOS Y DISCUSIÓN
Los embriones somáticos de cafeto que alcanzaron la etapa de torpedo en todos los tratamientos poseían una coloración carmelita cremosa (Código hexadecimal: #886A08) típica de esta especie, además del alargamiento y la diferenciación de los rudimentos cotiledonales. En el tratamiento con 5.0% de CO2 un 66.6% de los embriones somáticos se desarrollaron de la etapa globular a la etapa de torpedo (Tabla 1). Mientras, el control con intercambio pasivo y el tratamiento con 2.5% de CO2 no presentaron diferencias significativas entre ellos.
Se pudo apreciar un efecto negativo a una concentración de 10.0% de CO2 para los embriones somáticos en etapa globular, lo que impidió el posterior desarrollo de estos, algo similar ocurrió en el control con ventilación forzada. En el control con intercambio pasivo fue mayor el número de embriones somáticos que alcanzaron la etapa de torpedo con respecto al tratamiento con ventilación forzada. Para las dos especies se comprobó el papel beneficioso del CO2 que quedó demostrado al comparar los resultados con los controles de intercambio pasivo y ventilación forzada.
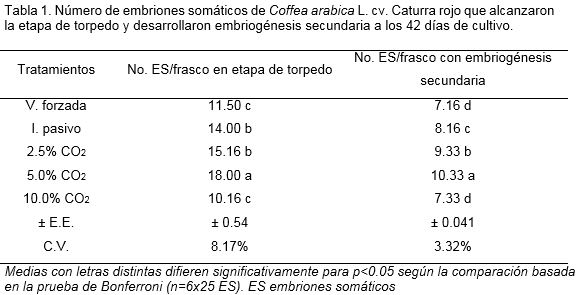
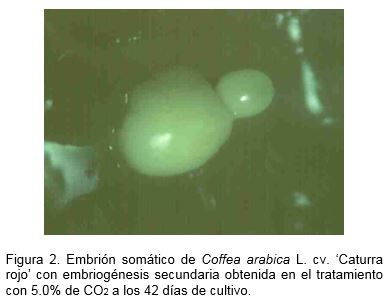
El desarrollo de la embriogénesis secundaria asociada a los embriones somáticos (Figura 2) fue estimulada con una concentración de 5.0% de CO2, seguida de 2.5% de CO2 y el control con intercambio pasivo (Tabla 1). Esto indicó que a dichas concentraciones de CO2 se favorece la formación y desarrollo de nuevos embriones somáticos, lo cual coincide con los resultados de la fase de diferenciación en medios de cultivo semisólidos y suspensiones celulares (Barbón et al., 2008) y pudiera valorarse como estrategia para reducir el tiempo de cultivo.
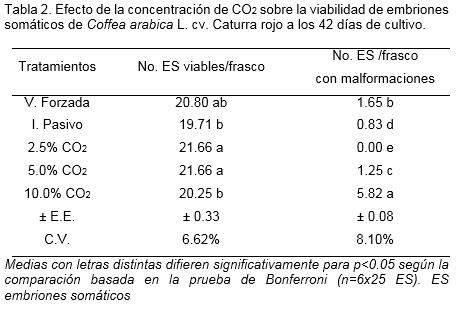
Los valores de supervivencia fueron altos para todos los tratamientos. Sin embargo, con 10.0% de CO2 se encontró el mayor número de embriones malformados (Tabla 2). Los embriones tenían un color carmelita oscuro (Código hexadecimal: #29220A) y un crecimiento anormal, ya que perdieron su forma típica de la etapa globular y no se observó alargamiento bipolar (Figura 3).

En clematis al igual que en cafeto, el tratamiento con 5.0% de CO2 fue donde el mayor número de embriones somáticos en etapa globular alcanzó la etapa de torpedo (Figura 4), con diferencias significativas entre los tratamientos. Esto indicó que el incremento del CO2 en el frasco de cultivo fue un factor favorable para el desarrollo de los embriones somáticos en etapa globular. Lo anterior se reafirmó a través de los resultados del control con intercambio pasivo, cuyos valores fueron superiores al control con ventilación forzada (Tabla 3).

Con el tratamiento con 5.0% de CO2 se obtuvo el mayor número de embriones somáticos con embriogénesis secundaria seguido por los tratamientos con 2.5% de CO2 y el control con ventilación forzada, respectivamente (Figura 5). Aunque con este último se obtuvo un elevado número de embriones somáticos con embriogénesis secundaria, los embriones formados no se desarrollaron o diferenciaron a etapa de torpedo al final del periodo evaluado como en los tratamientos con 2.5 y 5.0% de CO2. Esto podría ser debido a un efecto del O2 del aire en la multiplicación de los embriones somáticos globulares (Hohe et al., 1999). Sin embargo, la pobre aparición de embriones somáticos secundarios maduros podría estar asociada a la baja acumulación de CO2 en el frasco de cultivo. Según de Feria et al. (2003) existe un efecto positivo de altas concentraciones de oxígeno en la multiplicación de los embriones somáticos en etapa globular sin pasar a las otras etapas de desarrollo; sin embargo hay una mayor maduración de los embriones somáticos a bajas concentraciones de oxígeno.
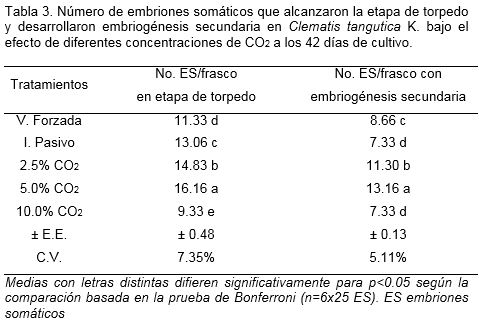
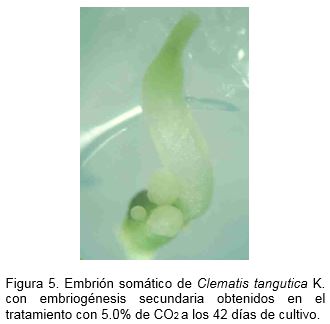
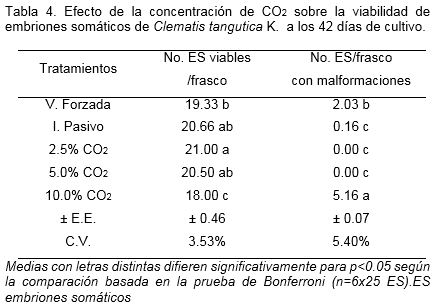
Los embriones somáticos de clematis durante su desarrollo de la etapa globular a la de torpedo mantuvieron un alto porcentaje de supervivencia y los valores más altos se alcanzaron en los tratamientos con 2.5 y 5.0% de CO2 e intercambio pasivo de la atmósfera gaseosa (82.4, 84 y 77.3%, respectivamente) (Tabla 4). En el tratamiento con 10.0% de CO2 se obtuvo la menor supervivencia y el mayor número de embriones somáticos malformados; mientras que en los otros tratamientos con 2.5% y 5.0% de CO2 no hubo malformación de los embriones somáticos. En estudios similares pero en zanahoria (Daucus carota L.) se obtuvo que la dinámica de control del ambiente in vitro en el frasco de cultivo contribuye a la diferenciación de los embriones somáticos durante la etapa de torpedo (Shimazu y Kurata, 2003).
Basados en los resultados se puede plantear que el ambiente in vitro influye de una forma u otra sobre el proceso de formación de los embriones somáticos independientemente del origen y características de las especies. Por ello los procesos morfogenéticos podrían ser modelados por la atmósfera gaseosa lo cual apunta al papel del CO2 en los procesos naturales y que puede ser simulado in vitro para aumentar la eficiencia de la embriogénesis somática.
CONCLUSIONES
Con concentraciones de CO2 (2.5% y 5.0%) se estimula el proceso de diferenciación de embriones somáticos en etapa globular, pues en los tratamientos con 2.5 % de CO2 para cafeto y 5.0% de CO2 para clematis y cafeto se obtuvo la mayor proporción de embriones en etapas de torpedo y bajos niveles de malformación.
AGRADECIMIENTOS
Al Sistema de Intercambio Académico Alemán (DAAD) y al Prof. Dr. Walter Preil que contribuyeron a la realización de esta investigación.
REFERENCIAS
Aslam J, Khan SA, Cheruth AJ, Mujib A, Sharma MP, Srivastava MS (2011) Somatic embryogenesis, scanning electron microscopy, histology and biochemical analysis at different developing stages of embryogenesis in six date palm (Phoenix dactylifera L.) cultivars. Saudi Journal of Biological Sciences 18 (4): 369–380. doi: 10.1016/j.sjbs.2011.06.002
Auboiron E, Carron MP, Michaux-Ferrière N (1990) Influence of atmospheric gases, particularly ethylene, on somatic embryogenesis of Hevea brasiliensis. Plant Cell Tiss Org Cult 21 (1): 31-37; doi: 10.1007/BF00034488
Barbón R, Jimenez E, Capote A (2003) Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv. Robusta. Biotecnología Vegetal 3(3): 131-135
Barbón R, Jiménez E, Preil W (2008) Influence of in vitro environment on somatic embryogenesis of Coffea arabica L. cv. Caturra rojo: the effects of carbon dioxide on embryogenic cell suspensions. Plant Cell, Tissue and Organ Culture 95 (2): 155–161; doi: 10.1007/s11240-008-9427-4
De Feria M, Jiménez E, Barbón R, Capote A, Chávez M, Quiala E (2003) Effect of dissolved oxygen concentration on differentiation of somatic embryos of Coffea arabica cv. Catimor 9722. Plant Cell, Tissue and Organ Culture 72(1):1–6; doi: 10.1023/A: 1021202305692
Etienne H, Bertrand B, Dechamp E, Maurel P, Georget F, Guyot R, Breitler JC (2016) Are genetics and epigenetic instabilities of plant embryogenic cells a fatality? The experience of coffee somatic embryogenesis. Human Genetics and Embryology 6 (136): 5; doi: 10.4172/2161-0436.1000136
Hohe A, Winkelmann T, Schwenkel HG (1999) CO2 accumulation in bioreactors suspension cultures of Cyclamen persicum Mill. and its effect on cell growth and regeneration of somatic embryos. Plant Cell Reports 18 (10): 863-867; doi: 10.1007/s002990050675
Huang SY, Chan HS, Wang TT (2006) Induction of somatic embryos of celery by control of gaseous compositions and other physical conditions. Plant Growth Regulation 49 (2): 219–227; doi: 10.1007/s10725-006-9113-7
Kvaalen H, von Arnold S (1991) Effects of various partial pressures of oxygen and carbon dioxide on different stages of somatic embryogenesis in Picea abies. Plant Cell an Organ Culture 27 (1): 49-57; doi: 10.1007/BF00048206
Meskaoui AE, Desjardins Y, Tremblay FM (2006) The effects of in vitro gaseous environment on the maturation of somatic embryo of black spruce (Picea mariana [Mill.] B.S.P.) and white spruce (Picea glauca [Moench] Voss). Moroccan Journal of Biology 1(2-3): 12-20
Miyoshi K, Sato T (1997) Removal of the pericarp and testa of seeds of japonica and indica rice (Oryza sativa) at various oxygen concentrations has opposite effects on germination. Physiologia Plantarum 99: 1-6; doi: 10.1111/j.1399-3054.1997.tb03423.x
Shimazu T, Kurata K (1999) Relationship between production of carrot somatic embryos and dissolved oxygen concentration in liquid culture. Plant Cell, Tissue and Organ Culture 57 (1): 29-38; doi: 10.1023/A:1006267002706
Shimazu T, Kurata K (2003) Dynamic dissolved oxygen concentration control for enhancing the formation rate of torpedo-stage embryos in carrot somatic embryo culture. Journal of Bioscience and Bioengineering 95 (4):384-390
Widholm JM (1972) The use of fluorescein diacetate and phenosafranine for determining viability of cultured plant cells. Journal Stain Technology 47(4):189-94; doi: 10.3109/10520297209116483
Zavattieri MA, Frederico AM, Lima M, Sabino R, Arnholdt-Schmitt B (2010) Induction of somatic embryogenesis as an example of stress-related plant reactions. Electronic Journal of Biotechnology 13 (1): 1-9; doi: 10.2225/vol13-issue1-fulltext-4
Recibido: 23-03-2016
Aceptado: 14-06-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
