Artículo original
Biotecnología Vegetal Vol. 16, No. 3: 161 - 169, julio - septiembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del sustrato en la aclimatización de plantas in vitro de Aloe vera L.
Effect of substrate in the acclimatization of Aloe vera L. in vitro plants
Naivy Pérez-Alonso, Alina Capote, Anabel Pérez, Leticia Gómez, Borys Chong-Pérez
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: naivy@ibp.co.cu
RESUMEN
Aloe vera L. por sus propiedades terapéuticas excepcionales tiene gran importancia económica. Sin embargo, la principal problemática, especialmente en Cuba, radica en las escasas plantaciones comerciales. El desarrollo de protocolos de propagación in vitro puede contribuir a este fin. El presente trabajo se realizó con el objetivo de determinar el efecto del sustrato en la aclimatización de plantas in vitro de Aloe vera. Se formularon sustratos con diferentes proporciones de Compost y zeolita (100:0, 75:25, 50:50, 25:75, 0:100). Se logró un 100% de supervivencia, 8.38 hojas por planta con una altura de 9.02 cm y el mayor número de raíces por planta (7.69) en el sustrato que contenía el 100% de compost. Las plantas in vitro mostraron en condiciones de campo 100% de supervivencia, similar a las plantas obtenidas por métodos tradicionales. Sin embargo, el número de hijuelos por planta in vitro cultivada en campo fue de cinco mientras que las plantas cultivadas por métodos tradicionales fue de 2.7 a los 60 días de plantadas. En Cuba la presente investigación constituye el primer informe del efecto del sustrato en la aclimatización de plantas in vitro como última fase de un protocolo de propagación in vitro y su respuesta en condiciones de campo. Estos resultados cierran el ciclo de cultivo de plantas in vitro que corroboran la posibilidad de emplearlas en el establecimiento de plantaciones comerciales para el uso en las industrias farmacéuticas y de cosméticos.
Palabras clave: condiciones ex vitro, compost, plantas in vitro, zeolita
ABSTRACT
Aloe vera L. for its exceptional therapeutic properties has great economic importance. However, the main problem, especially in Cuba, lies in the scarce commercial plantations. The development of in vitro propagation protocols may contribute to this end. The present work was carried out with the objective of determining the effect of the substrate in the acclimatization of in vitro plants of Aloe vera. Substrates were formulated with different ratios of compost and zeolite (100: 0, 75:25, 50:50, 25:75, 0: 100). A 100% survival rate was achieved, 8.38 leaves per plant with a height of 9.02 cm and the highest number of roots per plant (7.69) in the substrate containing 100% compost. In vitro plants showed 100% survival in field conditions, similar to plants obtained by traditional methods. However, the number of shoots per in vitro plant cultivated in the field was five while the plants cultivated by traditional methods were 2.7 after 60 days of planted. In Cuba, the present research constitutes the first report about the effect of the substrate on the acclimatization of in vitro plants as the last stage of an in vitro propagation protocol and its response under field conditions. These results close the cycle of in vitro plant culture that corroborates the possibility of using them in the establishment of commercial plantations for use in the pharmaceutical and cosmetic industries.
Keywords: compost, ex vitro conditions, in vitro plants, zeolite
INTRODUCCIÒN
Las plantas son consideradas una fuente natural de sustancias activas empleadas en las industrias farmacéuticas, agroquímicas, bioplaguicidas, de alimentos y de cosméticos. El mercado internacional le ha concedido a la biotecnología un interés especial para la obtención y producción de metabolitos secundarios a través de la aplicación de técnicas más productivas y eficientes debido a la elevada demanda de dichos productos naturales (Parsaeimehr et al., 2011).
Aloe vera L. conocida como sábila, es una planta de la costa noroccidental de África que se cultiva principalmente en África del Sur, América Latina y el Caribe (Grace, 2011). Existen alrededor de 300 especies de Aloe, de las cuales se han demostrado científicamente que son cuatro las que presentan las mayores propiedades medicinales: Aloe barbadencis Miller, Aloe perry Baker, Aloe arborencens Miller. No obstante, A. barbadencis Miller (=Aloe vera L.), es considerada como la más utilizada en la medicina curativa y la más popular en el mundo entero (Vega et al., 2005).
La planta ha sido usada como laxante (Rivero et al., 2002), como calmante del dolor, regenerador de los tejidos, antimicótico analgésico, en la cicatrización de heridas y agente antimicrobiano (Jasso et al., 2005; Ndhlala et al., 2009) y en la industria alimentaria (Vega et al., 2005) y en la de cosméticos (Das et al., 2010) en la que se encuentra bajo muchas formas: gel, pomada, loción, crema y jabón.
La micropropagación de A. vera ha sido informada en los últimos años por Matos (2007), Das et al. (2010), Jayakrishna et al. (2011), Pérez-Alonso et al. (2015) quienes refieren el estudio de varios factores que influyen en la eficiencia de los procesos. La aclimatización de las plantas in vitro es un aspecto fundamental en la culminación de dicho proceso. En esta fase juega un papel fundamental el sustrato. Investigaciones como la desarrollada por Vilchez et al. (2007) informan del uso de fuentes de materia orgánica de disponibilidad local para la aclimatización de A. vera con buenos resultados al emplear el humus de lombriz.
Teniendo en cuenta lo anteriormente expuesto, en este trabajo se propuso como objetivo determinar la respuesta de las plantas in vitro a diferentes sustratos durante la aclimatización. En Cuba, hasta el momento no existen investigaciones previas sobre la aclimatización de plantas in vitro de A. vera y su respuesta en condiciones de campo. Este trabajo pretende dar continuidad a resultados previos (Pérez-Alonso et al., 2015) y constituye el primero descrito y utilizado para fomentar cultivos comerciales de la especie en Cuba.
MATERIALES Y METODOS
Material vegetal
Como material vegetal inicial se emplearon plantas in vitro en el noveno subcultivo en la fase de multiplicación. Estas presentaban una coloración verde bosque (#228B22, código hexadecimal) en sus hojas. Eran vigorosas y turgentes, sin síntomas de hiperhidricidad, con una altura entre 3.5 a 10.5 cm, con tres a doce hojas y raíces de una hasta cinco (Figura 1) obtenidas mediante el protocolo desarrollado por Pérez-Alonso et al. (2015).

Fase de aclimatización
Previo a la plantación en sustrato las plantas in vitro fueron separadas del medio de cultivo, lavadas con agua corriente e individualizadas. Posteriormente se plantaron según su tratamiento en bandejas de polipropileno negras de 28 alvéolos con una capacidad de 200 cm3 cada uno. Se formularon sustratos con distintas combinaciones de compost de cachaza y zeolita como se muestra en la tabla 1 que fueron mezclados manualmente.
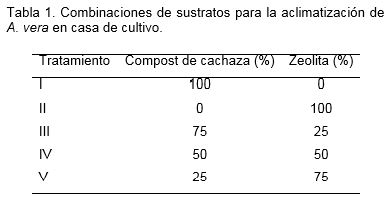
Las características físico-químicas de los sustratos utilizados se muestran en las tablas 2 y 3. La zeolita utilizada fue producida por la Empresa GEOMINERA de Villa Clara. La cachaza fue obtenida del Complejo Agroindustrial Azucarero Efraín Alfonso de Villa Clara.
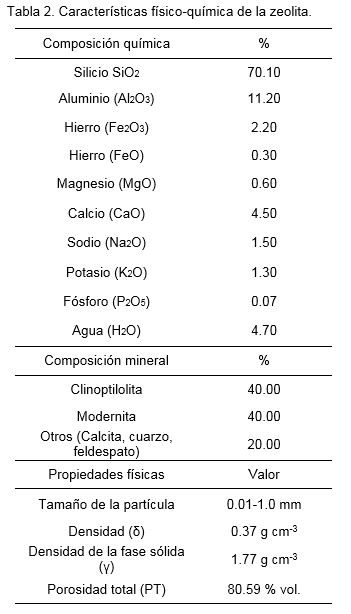

Una vez plantados, los brotes se colocaron en condiciones de casa de cultivo para su aclimatización, a una temperatura promedio durante el día de 30± 2ºC, humedad relativa del 70% e intensidad luminosa que osciló entre 224 y 457 µmol m-2 s-1 medida con un luxómetro EXTECH Light meter 401 025. Se utilizó un sistema de riego automatizado por micro-aspersión. La frecuencia de riego fue de 3.0 min de duración dos veces al día.
Se utilizaron 26 plantas por tratamiento para un total de 130. La supervivencia, se definió como el número de plantas que sobrevivieron a los 15 días. Luego de pasar 60 días se midió la altura de las plantas (cm) desde la base hasta el extremo distal de la hoja más larga, se cuantificó el número de hojas, de hijos y de raíces por planta. Además, se midió el largo de las raíces (cm) y se describió la coloración de los brotes para lo cual se utilizó el código hexadecimal de colores (http://www.cwp.linet.edu/cwis/cwp.html).
Para el análisis de los datos se realizó la prueba de Kruskal Wallis/ Mann Whitney al no cumplirse los supuestos de normalidad y homogeneidad de varianzas. Se utilizó el paquete estadístico SPSS versión 18.0 sobre Windows.
Plantación en condiciones de campo
Finalmente, para el cierre del ciclo del cultivo, se desarrolló el protocolo obtenido para la propagación de plantas in vitro de A. vera a partir de la integración de los resultados de Pérez-Alonso et al. (2015) y los obtenidos en el presente trabajo. La figura 2 muestra las plantas recién plantadas en fase de aclimatización (A) y a los 60 días de aclimatización (B) previo a la plantación en condiciones de campo. Las plantas in vitro fueron individualizadas y 200 de ellas plantadas en condiciones de campo (Figura 3).


Las plantas in vitro fueron plantadas en la Granja Suburbana Finca Sandino del municipio de Remedios, Villa Clara. Se utilizó un diseño de bloques al azar bajo iguales condiciones de cultivo y manejo con el fin de comparar su respuesta con hijuelos provenientes de plantas cultivadas por métodos tradicionales.
RESULTADOS Y DISCUSIÓN
Fase de aclimatización
Los resultados indicaron que el manejo realizado bajo condiciones de casa de cultivo garantizó una alta supervivencia de las plantas in vitro sin diferencias significativas entre los tratamientos. En el tratamiento que contenía 100% de zeolita la supervivencia de las plantas fue del 96.1%, mientras que en los restantes fue del 100%.
La capacidad de las plántulas de A. vera para adaptarse a condiciones ex vitro, sin mayor inconveniente, pudo deberse a que las hojas de esta planta contienen más de 98.5% de agua (Lee et al., 2011). Esta especie posee un mecanismo fotosintético ácido crasuláceo y al pasar de la condición heterótrofa (in vitro) a autótrofa (ex vitro) posee mayor resistencia a la pérdida de agua por excesiva transpiración lo cual se ha informado como una de las principales causas de muerte de plantas en diferentes especies en esta fase (Agramonte et al., 1998). Resultados similares en cuanto a un 100% de supervivencia fueron descritos por Vilchez et al. (2007) independientemente de la fuente de materia orgánica utilizada.
Por otra parte, es de destacar que las plantas in vitro durante la fase de multiplicación se encontraban en cámaras de crecimiento con luz solar con un fotoperíodo de 13/11h de luz/oscuridad e intensidad luminosa entre 23.2 y 44.5 µmol m-2 s-1. Matos (2007) demostró que la capacidad de las plantas de A. vera para resistir la aclimatización dependía del fotoperíodo. En su trabajo refiere que las plantas que se multiplicaron con 12 h de luz, iluminadas con lámparas fluorescentes Grolux presentaron 71% de supervivencia, mientras que aquellas que se multiplicaron con 16 h luz mostraron solo un 50%. Los porcentajes alcanzados en esta investigación (96.1 y 100 %) superaron los informados por dicho autor.
Por el contrario otros resultados en investigaciones realizadas en A. vera han mostrado como mejor composición de sustrato: suelo de jardín, compost y arena a una proporción de 1:1:1 (Jayakrishna et al., 2011); pero con este sustrato solamente alcanzaron 75% de supervivencia.
A los 10 días de estar las plántulas en condiciones ex vitro se observó un cambio de coloración de verde bosque (#228B22) a madera fornida (#DEB887) que comenzó a evidenciarse en el ápice y luego se extendió a toda la hoja (Figura 4, Panel superior). Esto fenómeno se hizo más evidente en las hojas más viejas. Luego de 30 días las plantas adquirieron su coloración inicial, como se muestra en la figura 4, panel inferior.

Estos resultados pudieran estar relacionados con las características que presentan las hojas de las plantas obtenidas in vitro. Frecuentemente, las plantas se desarrollan en condiciones de alta humedad relativa y moderada intensidad luminosa, por lo que presentan menor cantidad de cera epicutelar o una composición química alterada de esta y la cutícula no está totalmente desarrollada (Ziv y Chen, 2008). Igualmente, en algunas plantas los estomas formados son incapaces de completar el cierre estomático bajo las condiciones ex vitro, lo que conlleva a una pérdida excesiva de agua cuando son trasladadas a estas condiciones (George y Debergh, 2008). Sumado a lo anterior, esta especie es del tipo CAM y acumula gran cantidad de ácidos en sus vacuolas. Al enfrentarse entonces a un estrés debido al cambio de condiciones de in vitro a ex vitro, los ácidos son trasladados a los cloroplastos para transforma la clorofila a feofitina. Pasado los días, las plantas se adaptaron a su nuevo ambiente y cuando se eliminó el estrés regresaron a su coloración inicial. Al mismo tiempo, pudo influir en esta respuesta las diferencias en la intensidad de la luz que incidían en la cámara de crecimiento in vitro y la casa de cultivo ex vitro. Las mediciones promedio de la intensidad de la luz en ambos lugares fueron de 33.85 µmol m-2 s-1 y 345 µmol m-2 s-1 respectivamente, con una diferencia de aproximadamente 100 veces mayor ex vitro.
Los mejores resultados a los 60 días de aclimatizadas las plantas en la casa de cultivo, se obtuvieron con el sustrato que contenía 100% de compost de cachaza. En el análisis de la variable número de hojas el mayor valor se alcanzó con el sustrato referido anteriormente con diferencias significativas respecto a los demás tratamientos (Tabla 4). Sin embargo, para la variable altura de la planta se encontró que solo en el control que contenía 100% de zeolita se obtuvo el menor valor con diferencias significativas con los tratamientos restantes.
Asimismo, se observó que el tipo de sustrato influyó en el desarrollo de las raíces. El mayor valor en el número de raíces se obtuvo con el sustrato que contenía 100% de Compost de cachaza, con diferencias significativas con el resto de los tratamientos. Sin embargo, en la variable largo de las raíces no se observaron diferencias significativas entre los tratamientos con 100% de Compost de cachaza y 100% de zeolita respecto al sustrato que contenía una combinación de estos de 75:25%.
El sustrato no tuvo influencia sobre el número de brotes emitidos por planta. Para esta variable no se encontraron diferencias significativas entre los tratamientos estudiados.
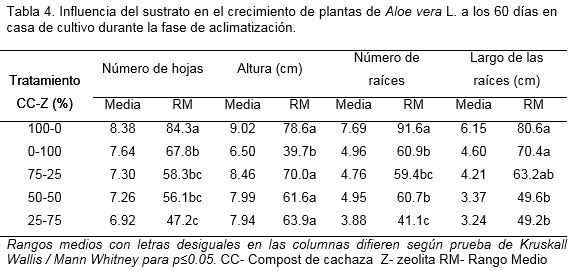
Esta respuesta de las plantas pudiera deberse a que la composición de este sustrato determina una adecuada retención de humedad y componentes químicos para proveer a la planta de agua y nutrientes. Al mismo tiempo ejerce una influencia significativa en la arquitectura del sistema radical influenciando el estado nutricional y la translocación de agua en la planta (Morales et al., 2009).
Dado que entre los factores que mayor influencia tienen en la aclimatización de las plantas in vitro se encuentran el tipo y composición del sustrato, se hace necesario prestar especial atención a su selección y uso (Morales et al., 2009). El compost de cachaza puede ser de gran utilidad en la aclimatización de plantas in vitro debido a la alta disponibilidad a nivel nacional.
Jiménez-Terry et al. (2012) señalaron que no solo el tipo de sustrato beneficia la aclimatización de las plantas in vitro, sino también la procedencia y calidad morfológica de las plantas. Se describe en la literatura científica la importancia de adecuadas dimensiones y buena calidad de las plantas in vitro para su desarrollo durante la fase de aclimatización, porque de esto depende la supervivencia, velocidad de crecimiento y producción final en la fase de campo (Díaz et al., 2004). En el presente trabajo con el protocolo de propagación in vitro desarrollado por Pérez-Alonso et al. (2015) se obtuvieron plantas con adecuadas condiciones fisiológicas y morfológicas para ser trasladadas a condiciones ex vitro. Esto contribuyó a los resultados obtenidos en esta fase.
Teniendo en cuenta que la fase de aclimatización culmina el proceso de propagación in vitro, se presenta en la figura 5 la integración de los resultados previos (Pérez-Alonso et al., 2015) con los obtenidos en la presente investigación.

Plantación en condiciones de campo
Las plantas in vitro obtenidas por el protocolo de propagación descrito en la figura 5, mostraron en condiciones de campo un 100% de supervivencia, similar a las plantas obtenidas por métodos tradicionales. La coloración de las hojas fue verde bosque (#228B22) y tuvieron una forma lanceolada sin diferencias respecto a las características mostradas por las plantas desarrolladas a partir de los hijuelos obtenidos por métodos tradicionales. En cuanto a la altura de las hojas no se encontraron diferencias significativas con un valor entre 60 y 70 cm en el momento de la evaluación (60 días). Este aspecto es de gran significación si se tiene en cuenta que es el producto que tiene utilidad en las industrias farmacéuticas y de cosméticos. Sin embargo, en cuanto al número de hijuelos el promedio en las plantas in vitro cultivadas en campo fue de cinco mientras que las plantas cultivadas por métodos tradicionales fue de 2.7 hijuelos a los 60 días de plantadas (Figura 6).

Hasta la fecha, muy pocos trabajos refieren la respuesta en condiciones de campo de plantas obtenidas in vitro. Das et al. (2015) describe la caracterización morfológica y genética en condiciones de campo de plantas in vitro de A. vera obtenidas a partir de ápices meristemáticos. Los autores refieren la importancia de dicha evaluación en campo para predecir la fidelidad genética de las plantas micropropagadas y muestran el empleo de técnicas moleculares para dicha caracterización. Sin embargo, no plantean la posibilidad de fomentar producciones comerciales.
CONCLUSIONES
Los resultados del presente trabajo corroboran la posibilidad de obtener plantas en condiciones in vitro con una calidad que permitan el 100% de aclimatización en un sustrato de compost de cachaza. Luego de 60 días en estas condiciones pueden ser utilizadas para el establecimiento de plantaciones comerciales con iguales características morfológicas a las plantas que le dieron origen y que son cultivadas por métodos tradicionales.
REFERENCIAS
Agramonte D, Jiménez F, Dita M (1998) Aclimatización. En: Pérez J (ed) Propagación y mejora genética de plantas por Biotecnología, pp. 193-206. Instituto de Biotecnología de las Plantas. Santa Clara, ISBN: 959-7122-02-2
Das A, Moquammel SK, Ghosh B, Nandagopal K, Jha TB (2015) Morphological and genetic characterization of micropropagated field grown plants of Aloe vera L. Plant Tissue Cult & Biotech 25(2):231‐246; doi: 10.3329/ptcb.v25i2.26257
Das A, Mukherjee P, Jha TB (2010) High frequency micropropagation of Aloe vera L.Burm. f. as a low cost option towards commercialization. Plant Tissue Cult & Biotech 20 (1): 29‐35; doi: 10.3329/ptcb.v20i1.5962
Díaz LP, Medina LF, Latife J, Digonzelli PA, Sosa SB (2004) Aclimatación de plantas micropropagadas de caña de azúcar utilizando el humus de lombriz. RIA 33(2):115-128
George EF, Debergh PC (2008) Micropropagation: Uses and Methods. En: George EF, Hall MA, de Klerk G-J (eds) Plant Propagation by Tissue Culture, pp. 29-64. Springer, Dordrecht, ISBN: 978-1-4020-5005-3
Grace OM (2011) Current perspectives on the economic botany of the genus Aloe L. (Xanthorrhoeaceae). S Afr J Bot 77:980-987
Jasso D, Hernández D, Rodríguez R, Angulo J (2005) Antifungal activity in vitro of Aloe vera pulp and liquid fraction against plant pathogenic fungi. Ind Crop Prod 21(1): 81-87; doi: 10.1016/j.indcrop.2004.01.002
Jayakrishna C, Karthik C, Barathi S, Kamalanathan D, ArulSelvi P (2011) In vitro propagation of Aloe barbadensis Miller, a miracle herb. Research in Plant Biology 1(5):22-26
Jiménez-Terry F, Agramonte D, Ramírez M, Pérez M, La O M, Pons M, Collado R (2012) Uso de humus de lombriz en la formulación de sustratos para la aclimatización de cultivos tropicales. Centro Agrícola 39(3):37-44
Lee YS, Yang TJ, Park SU, Baek JH, Wu SQ, Lim KB (2011) Induction and proliferation of adventitious roots Aloe vera leaf tissues for in vitro production of aloe-emodin. POJ 4(4):190-194
Matos A (2007) Optimización de un protocolo de cultivo in vitro de Aloe vera L. (zábila). Ciencia 15(3):319-330
Morales C, Corbera J, Paneque VM, Calaña JM (2009) Efecto del sustrato en la aclimatización del cultivo de anturio (Anthurium andreanum). Cultivos Tropicales 29(3):75-79
Ndhlala A, Amoo S, Stafford G, Finnie J, Staden J (2009) Antimicrobial, anti-inflammatory and mutagenic investigation of the South African tree aloe (Aloe barberae). J Ethnopharm 124(3): 404-408; doi: 10.1016/j.jep.2009.05.037
Parsaeimehr A, Sargsyan E, Vardanyan A (2011) Expression of secondary metabolites in plants and their useful perspective in animal health. ABAH Bioflux 3 (2):115-124
Pérez-Alonso N, Capote A, Pérez A, Gómez L, Jiménez E (2015) Establecimiento y multiplicación in vitro de brotes de Aloe vera L. Biotecnología Vegetal 15(2):85-95
Rivero R, Rodríguez E, Menéndez R, Fernández J, Del Barrio G, González M (2002) Obtención y caracterización preliminar de un extracto de Aloe vera L. con actividad antiviral. Plant Med 7(1):32-38
Vega A, Ampuero N, Díaz L, Lemus R (2005) El aloe (Aloe barbadensis Miller) como componente de alimentos funcionales. Rev Chil Nutr 32 (3):208-214
Vilchez J, Ramírez E, Villasmil M, Albany N, León de Sierralta S, Molina M (2007) Aclimatización de vitroplantas de zábila (Aloe vera (L.) Burm. f): efectos del sustrato. Rev Fav Agron (LUZ) 24(1):57-61
Ziv M, Chen J (2008) The Anatomy and Morphology of tissue Cultured Plants. En: George EF, Hall MA, de Klerk G-J (eds) Plant Propagation by Tissue Culture, pp. 465-478. Springer, Dordrecht, ISBN: 978-1-4020-5005-3
Recibido: 18-05-2016
Aceptado: 05-09-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
