Artículo original
Biotecnología Vegetal Vol. 16, No. 3: 171 - 177, julio - septiembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Control químico de arvenses durante la aclimatización de plantas in vitro de caña de azúcar cv. ‘CP52-43’
Chemical control of weeds during the acclimatization of in vitro sugarcane plants cv. 'CP52-43'
Inoel García Ruiz, Maritza Sánchez Ortiz, Dunia Núñez Jaramillo, Yaimí Otero Quintero
Estación Territorial de Investigaciones de la Caña de Azúcar Centro Villa Clara. Autopista Nacional km 246. Ranchuelo. Villa Clara. Cuba. CP 53100.
e-mail: inoel.garcia@inicavc.azcuba.cu
RESUMEN
El control de arvenses en la fase de aclimatización de plantas in vitro de caña de azúcar (Saccharum spp.) se realiza de forma manual lo que eleva el costo de producción. Con el objetivo de determinar la efectividad del control químico de arvenses con Dual Gold CE 96 (Mesotrione), se aclimatizaron plantas in vitro de caña de azúcar cv. ‘CP52-43’ en humus de lombriz y compost de cachaza. Se emplearon dosis de 0.5, 1.0 y 1.5 l ha-1 p.c. del herbicida Dual Gold CE 96, aplicado antes e inmediato al trasplante de plantas in vitro cuyos resultados se compararon con la escarda manual. A los 50 días de cultivo se extrajeron 15 plantas por tratamiento y se cuantificó el número de hojas e hijos, se midió la longitud y se determinó la masa fresca de la parte aérea y de las raíces. Los resultados demostraron que Dual Gold CE 96 a dosis de 0.5 l ha-1 aplicado antes o después del trasplante, controla las arvenses Portulaca oleracea (L.), Amaranthus sp. (Mart), Sida acuta (Burm. F.) y Eleusine índica (L.), sin afectar el crecimiento de las plantas de caña de azúcar cv. ‘CP52-43’, comparado con la escarda manual.
Palabras clave: herbicidas, Saccharum, supervivencia, sustratos
ABSTRACT
Control of weeds in the acclimatization phase of in vitro sugarcane (Saccharum spp.) plants is done manually which raises the cost of production. In order to determine the effectiveness of the chemical control of weeds with Dual Gold CE 96 (Mesotrione), in vitro plants of sugar cane cv. 'CP52-43' were acclimatized in worm humus and cachaça compost. Doses of 0.5, 1.0 and 1.5 l ha-1 p.c. Dual Gold CE 96 herbicide, were applied before and immediately to in vitro plants transplantation and the results were compared to manual weeding. After 50 days of culture, 15 plants were extracted per treatment and the number of leaves and shoots were quantified, the length was measured and the fresh mass of the aerial part and of the roots were determined. The results showed that Dual Gold CE 96 at doses of 0.5 l ha-1 applied before or after transplant, controls the weeds Portulaca oleracea (L.), Amaranthus sp. (Mart), Sida acuta (Burm. F.) and Eleusine indica (L.), without affecting the growth of sugarcane cv. ‘CP52-43’ plants, compared to manual weeding.
Keywords: herbicides, Saccharum, substrate, survival
INTRODUCCIÓN
La propagación in vitro de plantas requiere un período de aclimatización ex vitro para la adaptación gradual a las nuevas condiciones de humedad relativa, intensidad de luz, fluctuaciones de temperatura y limitado abastecimiento de nutrientes (Enríquez del Valle et al., 2013). Según Díaz et al. (2004) la eficiencia del proceso de adaptación de plantas de caña de azúcar (Saccharum spp.) depende también de la elección del sustrato y de la obtención de una relación adecuada entre los componentes de la mezcla, que asegure buena supervivencia.
Sin embargo, en muchas ocasiones los componentes del sustrato contienen semillas viables de especies de arvenses que germinan y encarecen el proceso de producción. Según Alfaro (2013) durante la fase de aclimatización de plantas de caña de azúcar obtenidas in vitro la mayor parte de los recursos invertidos se destinan al sustrato y al control de arvenses.
Por ejemplo, cuando se utiliza compost en las mezclas de sustrato pueden permanecer viables semillas de arvenses. Robinson (2010) señaló que varios factores contribuyen a la mortalidad de dichas semillas durante el compostaje, donde el más importante es la interacción entre los factores especie de maleza, temperatura, tiempo y la humedad.
Ante esta problemática la búsqueda de opciones de control de arvenses durante la fase de aclimatización es vital. La escarda manual es el método más utilizado pero es laborioso, consume mucho tiempo y recursos humanos aunque el resultado final no siempre es satisfactorio. En el cultivo de la caña de azúcar en campo se utilizan herbicidas para el control químico de arvenses, pero se desconoce la tolerancia de las plantas in vitro a estos productos. El objetivo del trabajo fue determinar la efectividad del control químico de arvenses con Dual Gold CE 96 (Mesotrione), durante la aclimatización de plantas in vitro de caña de azúcar cv. ‘CP52-43’.
MATERIALES Y MÉTODOS
Este trabajo se desarrolló en el área de aclimatización de plantas in vitro perteneciente a la biofábrica de la Estación Territorial de Investigaciones de la Caña de Azúcar Centro Villa Clara.
Material vegetal
Se emplearon plantas de caña de azúcar cv. ‘CP52-43’ obtenidas por cultivo in vitro según lo descrito por Jiménez (1997) que se encontraban en fase de enraizamiento.
Herbicida
Se utilizó el herbicida Dual Gold CE 96 (Mesotrione) que tiene efecto residual, con alta selectividad a caña de azúcar y particularmente activo contra gramíneas anuales en preemergencia (Syngenta, 2015).
Condiciones de cultivo y diseño experimental
Como sustrato se emplearon humus de lombriz procedente de la Biofábrica de Malezas y compost a base de cachaza descompuesta de caña de azúcar de la Unidad Empresarial de Base Ifraín Alfonso de Villa Clara.
Los métodos de control de arvenses utilizados fueron los siguientes: escarda manual y químico con el herbicida Dual Gold CE 96 a dosis de 0.5, 1.0 y 1.5 l ha-1 p.c. que se aplicaron en dos momentos: antes e inmediato al trasplante de las plantas in vitro a la fase de aclimatización. Se conformó una matriz trifactorial con los factores: sustrato x momento de aplicación del herbicida x dosis del herbicida. Cada tratamiento se replicó tres veces. En total se emplearon 48 bandejas de 60 alveolos cada una.
La aplicación del herbicida se realizó con mochila manual Matabi de 16 litros de capacidad, boquilla de inundación (Flood-jet) Lurmark AN 3.0, presión de 1.0 bar, ancho de trabajo de 1.60 m y solución final calibrada de 200 l ha-1.
A los 7, 15 y 22 días del trasplante se evaluó la supervivencia de las plantas in vitro como el número de plantas vivas. El control de arvenses se evaluó a los 7, 15, 22 y 35 días del trasplante, y para ello se empleó como criterio evaluativo el porcentaje de cobertura de arvenses (Fischer, 1975) de la superficie de cada bandeja.
A los 50 días de cultivo se extrajeron cinco plantas por bandeja. Se cuantificó el número de plantas con cepellones bien conformados y el número de hojas e hijos por planta, se midió la longitud desde la unión raíz-tallo hasta la última unión limbo-vaina visible, así como se determinó la masa fresca de raíces (g) y de la parte foliar (g).
Durante el ciclo del experimento se mantuvieron las atenciones culturales establecidas en la fase de aclimatización según Montes de Oca et al. (2013), tales como: un riego diario por microjet durante 60 minutos, aplicación foliar de una solución de 5.0 g de urea y 5.0 ml de Fitomas-E por litro de agua a los 2, 10 y 20 días del trasplante y control preventivo de plagas y enfermedades con una aplicación foliar cada 15 días de 1 ml de cipermetrina CE 25 mezclado con 0.6 ml de propiconazol (Tilt CE 250) por litro de solución.
El procesamiento estadístico de los datos se realizó con el programa STATISTICA 7.0 que incluyó análisis de componentes principales para excluir causas de variación de poca influencia y análisis de varianza (Tukey, p˂0.05) para las variables longitud, número de hojas e hijos, así como la masa fresca de raíces y parte foliar de las plantas in vitro por tratamiento. Las variables cobertura de arvenses y supervivencia expresadas en porcentaje, los datos originales se transformaron por la expresión:
P es el valor porcentual más 0.5 por la presencia de valores cero (Lerch, 1977).
RESULTADOS Y DISCUSIÓN
En el análisis de componentes principales se comprobó que el componente 1 permitió descartar el factor momento de aplicación del herbicida respecto al trasplante de las plantas in vitro, así como las variables número de hojas e hijos, masa fresca de raíces y conformación del cepellón, por su poca influencia en la explicación de la variabilidad de los datos. Según Terrádez (2000) el componente principal es una técnica estadística de reducción del número de variables con pérdida de la menor cantidad de información posible.
Los coeficientes de correlación de las variables con los ejes en el segundo componente (Tabla 1) demostraron que el primer eje se asoció de forma positiva y estrecha con el sustrato (S), longitud (L), masa fresca de la parte foliar (PF) y la supervivencia de las plantas in vitro (SU) y a la vez, dicho eje tuvo una relación negativa con la cobertura de arvenses a los 7(C7), 15(C15), 22(C22) y 35(C35) días del trasplante, lo cual indicó que la calidad del sustrato influyó marcadamente en el crecimiento y supervivencia de las plantas in vitro, pero también sobre la presencia de arvenses. El segundo eje tuvo relación fuerte y positiva con la dosis del herbicida (D) y negativa con la cobertura y supervivencia. En este segundo análisis los dos primeros componentes explicaron el 74% de la variabilidad total, distribuida en 46% por la influencia del sustrato y el crecimiento de las plantas in vitro y 28% por la dosis del herbicida, la cobertura de arvenses y la supervivencia.
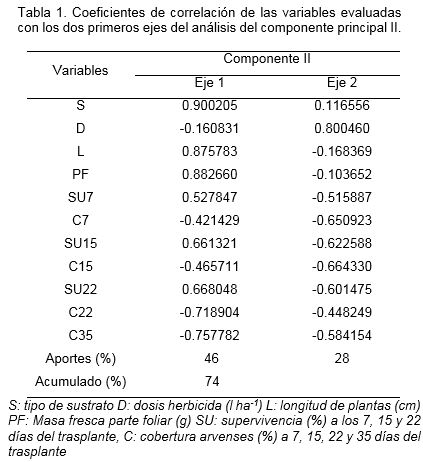
La ubicación de los centroides en el gráfico (Fig.1) demostró que las variables sustrato (S), longitud (L) y masa fresca de la parte foliar (PF) de las plantas in vitro estuvieron muy asociadas, y formaron un grupo muy bien delimitado que mostró asociación positiva con la supervivencia (SU7, SU15 y SU22) y negativa con la cobertura de arvenses (C7, C15, C22 y C35). Esto sugirió la existencia de diferencias en la calidad y cantidad de semillas viables de arvenses entre los sustratos utilizados. Estos resultados guardan relación con los informados por Díaz et al. (2004) quienes demostraron que en la adaptación de plantas in vitro de caña de azúcar, un sustrato con 60% de humus de lombriz favoreció el crecimiento de raíces y número final de plantas.
Se observó también que la dosis (D) del herbicida estableció una relación inversa con la supervivencia (SU) y la cobertura (C) de arvenses, lo cual supone que incrementos en la dosis del herbicida conllevaron a menos presencia de arvenses pero también mayor mortalidad, razón por la cual lograr la dosis exacta del herbicida es un factor primordial durante la aclimatización de plantas in vitro.
En relación con lo anterior, Domínguez y Donayre (2006) consideraron que el éxito de la propagación in vitro radica en lograr la máxima supervivencia durante la aclimatización de las plántulas a las nuevas condiciones de humedad y temperatura. Por su parte, Díaz et al. (2010) señalaron que durante la fase de aclimatización ocurren pérdidas de plantas porque la supervivencia depende del tamaño de las plántulas, calidad del sustrato y del desarrollo radical, entre otros factores.
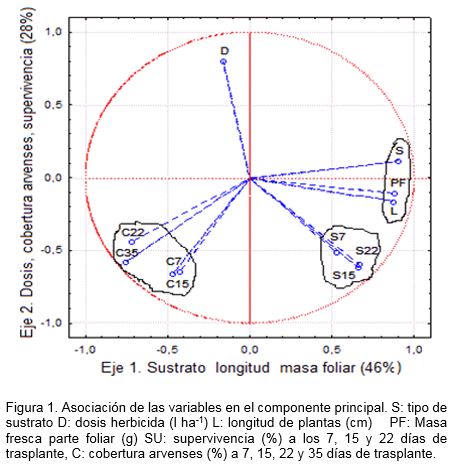
Respecto a la supervivencia de las plantas in vitro a los 22 días del trasplante se observaron diferencias significativas entre los sustratos y la dosis del herbicida, pero no entre la aplicación del herbicida antes o después del trasplante (Fig.2). El humus de lombriz fue significativamente superior al compost de cachaza con más de 7.0% de diferencia en la supervivencia, lo que se puede atribuir a mejores propiedades físicas del humus como textura y retención de humedad que favorecieron la adaptación de las plantas in vitro.
Con la dosis de 0.5 l ha-1 p. c. de Dual Gold CE 96 no se observaron diferencias significativas en la supervivencia con respecto al control de escarda manual de las arvenses y, por el contrario, 1.0 y 1.5 l ha-1 p. c. del herbicida afectaron el porcentaje de plantas vivas.
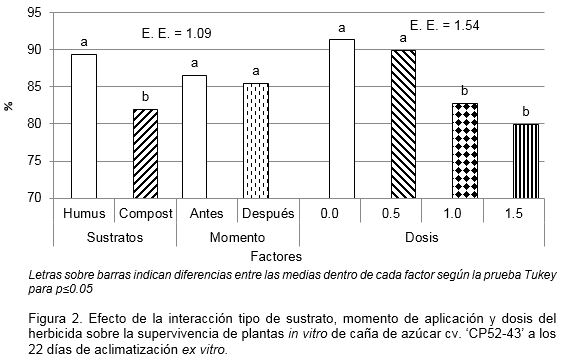
Relacionado con las variables de crecimiento hubo diferencias significativas para la interacción sustrato - dosis del herbicida (Fig. 3). En el sustrato humus de lombriz a los 50 días de cultivo la longitud y la masa fresca de la parte aérea de las plantas, disminuyó en la misma medida que la dosis del producto aumentó, aunque sin diferencias significativas entre la dosis de 0.5 l ha-1 p.c. de Dual Gold CE 96 y el control sin herbicida. En el caso del compost de cachaza el efecto de las dosis de herbicidas sobre la longitud y masa fresca de la parte foliar de las plantas no fue significativo, aunque ambas variables alcanzaron valores muy inferiores a los logrados en el humus de lombriz, lo cual expresa diferencias entre la calidad de los sustratos empleados.

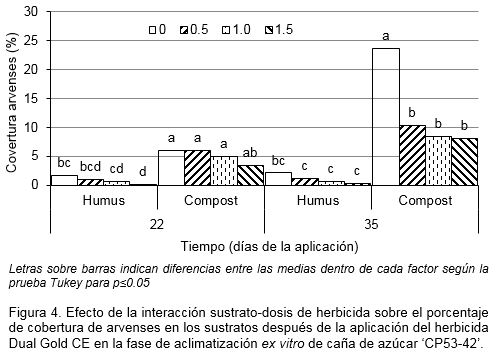
Respecto al control de arvenses hubo significación estadística en la interacción de los factores sustratos x dosis a los 22 y 35 días de cultivo. A los 22 días la presencia de arvenses aún no alcanzaba valores muy elevados en ninguno de los dos sustratos, aunque el compost de cachaza ya mostraba valores de cobertura entre 3 y 6% que, sin diferencia significativa entre ellos, superaban los valores del humus de lombriz que no rebasaba el 2% en el control sin herbicidas. A los 35 días había cobertura de arvenses mayor de 20% en el control del sustrato compost que superaban significativamente a la cobertura en las dosis de 0.5, 1.0 y 1.5 l ha-1 del herbicida y todos a la vez, tenían diferencias significativas con el humus de lombriz, el cual mantenía niveles máximos de arvenses cercanos al 2% (Fig. 4). En los dos sustratos el promedio de cobertura de arvenses disminuyó desde la variante control hasta la dosis máxima del herbicida, como expresión de la efectividad del producto para controlar las especies anuales mono y dicotiledóneas predominantes Portulaca oleracea (L.), Amaranthus sp. (Mart), Sida acuta (Burm. F.), Chamaesyce hirta (L.) Millsp., Ipomoea sp. (L.), así como la monocotiledónea Eleusine índica (L.) Gaertn y la Ciperácea Cyperus rotundus (L).
Los resultados del experimento sobre el efecto de la calidad del sustrato en el crecimiento de las plantas aclimatizadas coinciden con los obtenidos por Agramonte et al. (1998) en plátano (Musa spp.), Ortiz (2000) en caña de azúcar (Saccharum spp. híbrido), Hurtado et al. (2012) en bambú (Bambusa vulgaris L.) y Jiménez-Terry et al. (2013) en papa (Solanum tuberosum L.). Ello ratifica la necesidad de utilizar sustratos con propiedades físicas, químicas y biológicas adecuadas para favorecer el desarrollo de las plantas in vitro y que formen un cepellón que proteja las raíces en su traslado a campo.
Respecto a la efectividad del control preemergente de arvenses se demostró que la opción química es posible durante la aclimatización de plantas in vitro de caña de azúcar, utilizando la dosis mínima estudiada de 0.5 l ha-1 p.c. de Dual Gold CE 96, la cual logró control de las arvenses sin afectar el crecimiento y supervivencia de las plantas. Este resultado concuerda con lo planteado por Alfaro (2013) en cuanto a la necesidad de precisar la dosis mínima efectiva de los herbicidas de posible uso durante la fase de aclimatización, debido a la elevada sensibilidad de las plantas in vitro.
CONCLUSIONES
La dosis de 0.5 l ha-1 p.c. del herbicida Dual Gold CE 96 es una opción factible para el control químico de arvenses en sustratos con alta infestación durante la aclimatización de plantas in vitro de caña de azúcar (Saccharum spp. híbrido).
REFERENCIAS
Agramonte D, Jiménez F, Dita M A (1998) Aclimatización En: Pérez JN (ed) Propagación y mejora genética de plantas por biotecnología. Instituto Biotecnología de las Plantas, Santa Clara; ISBN: 959-7122-02-2
Alfaro J (2013) Control de arvenses en invernadero en plantas in vitro de caña de azúcar, Costa Rica. En: Memoria del XIX Congreso de la Asociación de Técnicos Azucareros de Centroamérica, San José 11-13/09/2013. ATACA, Costa Rica
Díaz Romero C, Cuenya M I, García M B (2010) Etapa de aclimatación y crianza de vitroplantas de caña de azúcar en invernáculo. EEAOC. Disponible en: http://www.eeaoc.org.ar/publicaciones/categoria/16/259/Publicacion-Especial-Vitroplantas.html Consultado 15/06/2016
Díaz L P, Medina L F, Latife J (2004) Aclimatación de plantas micropropagadas de caña de azúcar utilizando el humus de lombriz. RIA 33 (2): 115-128
Domínguez G Y Donayre M (2006) Aclimatization of Uncaria tomentosa (Willd.) DC. produced in vitro. Ecología Aplicada 5(1-2):67-74
Enríquez del Valle J R, Estrada Silias A, Rodríguez Ortíz G, Velasco Velasco V A, Campos Ángeles G V (2013) Sustrato y dosis de fertirriego en la aclimatización de vitroplantas de Agave americana var. oaxacencis. Rev. FCA UNCUYO 45 (2): 341-348
Fischer F (1975) Comparación de dos métodos de evaluación para determinar el grado de efectividad herbicida. Rev Agric 8 (1): 70-80
Hurtado O, Freire Seijo M, Leiva Mora M, García Ramírez Y (2012) Efecto del tipo de sustrato en la aclimatización de plantas cultivadas in vitro de B. vulgaris var. vulgaris. Biotecnología Vegetal 12 (2): 85 - 89
Jiménez E, García L, Suárez M, Alvarado Y (1997) Instructivo técnico para la micropropagación de la caña de azúcar. Instituto de Biotecnología de las Plantas, Santa Clara
Jiménez-Terry F, Agramonte D, Pérez M, Pons M, Rodríguez M, La O M, Hurtado O, Pérez A, Leiva-Mora M (2013) Efecto del sustrato sobre la producción de minitubérculos de papa en casa de cultivo a partir de plantas in vitro. Biotecnología Vegetal 13 (3):169 - 180
Lerch G (1977) La experimentación en las ciencias biológicas y agrícolas. Editorial Científico técnica, La Habana
Montes de Oca J L, Jiménez M, Machado P (2013) Manual para el manejo agronómico de plantas in vitro de caña de azúcar (Sacharum sp. híbrido), ETICA, Santa Clara
Ortiz R (2000) Factores que afectan el desarrollo de vitroplantas de caña de azúcar en la fase adaptativa. Instituto Nacional de Ciencias Agrícolas, La Habana
Robinson J (2010) Composta para la reducción de malezas y patógenos. Disponible en: http://www.hortalizas.com/proteccion-de-cultivos/composta-para-la-reduccion-de-malezas-y-patogenos/ Consultado 12/07/2016
Syngenta (2015) Ficha Técnica Dual Gold, características y modo de acción. Syngenta España SA, Madrid
Terrádez M (2000) Análisis de componentes principales. UOC, Catalunya
Recibido: 20-05-2016
Aceptado: 28- 07-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
