Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 3 - 9, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Protocolo para seleccionar cultivares de caña de azúcar resistentes a la roya naranja mediante inoculación artificial en casa de cultivo
Protocol for selecting orange rust resistant sugarcane cultivars by artificial inoculation in greenhouse
Borys Luis Valdés1,2, Osmany Aday1, Bárbara Ocaña2, Luis E Rojas Jiménez2, Marilin Hernández2, Mayra Acosta-Suárez2, Víctor Gil3, Annia González4, Leonardo Rivero2, María Ileana Oloriz2
1Instituto de Investigaciones de la Caña de Azúcar. Carretera al CAI Martínez Prieto km 1½. Boyeros. La Habana. Cuba. CP 19390.
2Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: maria@ibp.co.cu
3Centro de Investigaciones Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
4Centro de Información y Gestión Tecnológica. Buen viaje 18 e/ Maceo y Parque. Santa Clara. Villa Clara. Cuba. CP 50100.
RESUMEN
La roya naranja [Puccinia kuehnii (W. Kruger) E. J. Butler] de la caña de azúcar (Saccharum spp.) constituye una enfermedad de importancia potencial para la agricultura cañera cubana. Sin embargo, en condiciones naturales la presencia de síntomas no ha mantenido estabilidad en los focos de infección lo cual dificulta la evaluación de la respuesta fenotípica de resistencia de los cultivares a esta enfermedad. El presente trabajo se realizó con el objetivo de establecer un protocolo para seleccionar cultivares de caña de azúcar por su resistencia a roya naranja en casa de cultivo. Incluye los cultivares de referencia, la fuente de inóculo, caracterización morfológica y molecular de las uredosporas de P. kuehnii, condiciones de inoculación y método de inoculación, variables para evaluar la respuesta de las plantas inoculadas y su clasificación según el grado de resistencia a P. kuehnii.
Palabras clave: inoculación, Puccinia kuehnii, resistencia, Saccharum spp.
ABSTRACT
Orange rust [Puccinia kuehnii (W. Kruger) E. J. Butler] from sugarcane (Saccharum spp.) is a disease of potential importance for Cuban sugarcane farming. However, under natural conditions, the presence of symptoms has not maintained stability in the foci of infection, which makes it difficult to evaluate the phenotypic resistance response of the cultivars to this disease. The present work was carried out with the objective of establishing a protocol to select sugarcane cultivars for their resistance to orange rust in the greenhouse. Includes, reference cultivars, source of inoculum, morphological and molecular characterization of P. kuehnii uredospores, inoculation conditions and inoculation method, variables to evaluate the response of the inoculated plants and their classification according to the degree of resistance to P. kuehnii.
Keywords: inoculation, Puccinia kuehnii, resistance, Saccharum spp.
INTRODUCCIÓN
El efecto de las enfermedades en la caña de azúcar (Saccharum spp.), como en otros cultivos ha sido una de las principales causas de pérdidas en la industria azucarera. La evolución de enfermedades en el mundo cañero y en Cuba en particular, ha tenido un crecimiento vertiginoso en las últimas décadas y lo que es más importante aún, se ha incrementado al mismo tiempo la intensidad con la que atacan las plantaciones (Mesa et al., 2016).
Una de las enfermedades más importantes para la caña de azúcar, es la roya naranja ocasionada por Puccinia kuehnii (W. Kruger) E. J. Butler, ya que se encuentra distribuida en casi todas las regiones productoras del mundo (Pérez, 2014). Presenta un elevado potencial de daño sobre cultivares susceptibles y causa disminución en los rendimientos de este cultivo, con las consecuentes pérdidas económicas para los productores cañeros.
P. kuehnii es un hongo biotrófico (Virtudazo et al., 2001), que se caracteriza por causar lesiones foliares que cuando maduran rompen la epidermis de la hoja y afectan la superficie foliar (Magarey, 2000). Condiciones favorables, caracterizadas por la ocurrencia de ciclos alternos de lluvia con días secos y la presencia de rocío durante las noches y parte de la mañana favorece la infección, producción de esporas y diseminación de la enfermedad (Barrantes y Chavarría, 2008).
En Cuba, la roya naranja es considerada de importancia potencial, estudios realizados por Pérez et al. (2012) y Aday et al. (2014) en condiciones naturales de infección, muestran que la presencia de síntomas no ha mantenido estabilidad en los focos de infección informados, por lo que consideraron que el comportamiento epifitiológico de la enfermedad ha sido inestable para estas condiciones. Esto sugiere la necesidad de establecer métodos eficientes y reproducibles que permitan un monitoreo más preciso de la respuesta de la planta P. kuehnii para la posterior selección cultivares de caña de azúcar resistentes a la roya naranja.
En estudios previos en casa de cultivo se identificaron respuestas diferenciales de cultivares de caña de azúcar a la infección por P. kuehnii (Valdés et al., 2016) que variaron desde resistencia al hongo a través de interacciones no compatibles a diferentes grados de susceptibilidad.
Teniendo en cuenta lo anteriormente expuesto, el objetivo del presente trabajo fue proponer un protocolo para seleccionar cultivares de caña de azúcar por su resistencia a la roya naranja mediante inoculación artificial en casa de cultivo.
MATERIALES
Materiales biológicos
Como fuente de P. kuehnii se tomaron hojas del cultivar ‘C01-227’ con síntomas característicos de roya naranja.
Cultivares de caña de azúcar (Saccharum spp.)
Se emplearán cultivares controles de resistencia y susceptibilidad, así como aquellos que serán incluidos en la investigación para evaluar su respuesta a P. kuehnii. Se recomienda utilizar los siguientes controles:
Controles de resistencia y susceptibilidad:
‘Q124’: susceptible en Australia (Magarey et al., 2005)
‘Q124’: susceptible en Australia (Magarey et al., 2005)
‘CP72-2086’: susceptible en Costa Rica y Guatemala (Chavarría et al., 2009; Ovalle et al., 2010)
‘C01-227’: susceptible en Cuba (Aday et al., 2016)
‘C90-469’: moderadamente resistente en Cuba (Valdés et al., 2016)
-
‘IBP8830’: resistente en Cuba (Valdés et al., 2016)
Materiales y equipos
1. Agua desionizada estéril
2. Agitador magnético
3. Bandejas plásticas mediana
4. Vaso de precipitado
5. Bisturí No. 23
6. Bolsas de polietileno (1000 g)
7. Cámara fotográfica digital
8. Cámara de Neubauer (hematocímetro)
9. Cesto o bandeja para desechos
10. Cuaderno de trabajo
11. Guantes
12. Higrotermógrafo
13. Hojas cuadriculadas
14. Lactofenol (fenol 20 g, ácido láctico 20 g, glicerol 40 g, agua 20 ml)
15. Luxómetro
16. Machete
17. Marcadores permanentes
18. Micropipetas 1000 µl
19. Microscopio óptico
20. PC
21. Papel de filtro
22. Pinzas
23. Portaobjetos y cubreobjetos
24. Puntas estériles para micropipetas 1000 µl
25. Regla milimetrada
26. Tijeras
27. Tijeras de poda
28. Tapa boca
29. Tamizadora de compost
30. Sustrato (mezcla de compost y zeolita, proporción 80:20)
PRECAUCIONES Y MEDIDAS DE SEGURIDAD
Aunque P. kuehnii no se considera patógeno para la salud humana se recomienda emplear los medios de protección necesarios (guantes, batas sanitarias, tapaboca) para la manipulación de este hongo fitopatógeno con el fin de prevenir riesgos a la salud del personal que participe en el proceso de inoculación.
PROCEDIMIENTO
Preparación del material vegetal
1. Seleccionar material vegetal con el objetivo de garantizar: semilla agámica proveniente de caña planta, edad en el rango de 9 a 11 meses, pureza genética (en correspondencia con la caracterización de cada cultivar), adecuado estado fitosanitario y vigor fisiológico que garantice una elevada capacidad de brotación y crecimiento.
2. Seccionar el material vegetal en pequeños esquejes de una sola yema. Esta técnica permite obtener propágulos de mayor calidad que garanticen niveles altos de brotación.
3. Colocar los esquejes sobre bandejas con lámina de agua durante un periodo de 48 horas, con cambio del agua cada 12 horas para la pre-brotación de las yemas.
4. Plantar los esquejes en bolsas de polietileno (12.5 x 20.0 cm) con 1000 g de capacidad en un sustrato compuesto de una mezcla de compost y zeolita (proporción 80:20).
Nota: Los esquejes deben ser colocados a una profundidad que no sobrepase los 5 cm, en el centro de la bolsa, evitando contacto con las paredes del envase para que no se produzcan daños o retardo en el crecimiento de las yemas y lograr uniformidad en la brotación. Se sugiere plantar entre 15 y 20 esquejes de cada cultivar para lograr un alto volumen de plantas. Cada bolsa debe identificarse con el código de los cultivares plantados.
5. Colocar el material vegetal en casa de cultivo durante un periodo de 60 días. Aplicar riego por aspersión con una frecuencia de dos veces al día (mañana y tarde) durante un periodo de 15 minutos cada. Durante este tiempo las plantas deben alcanzar entre 25-30 cm de altura y de 4 -5 hojas activas.
6. Transferir las plantas a un cuarto de inoculación 7 días antes de inocular (Figura 1a). Se debe asegurar la iluminación y el riego uniforme de todas las plantas.
Nota: Se recomienda seleccionar 10 o más plantas de cada cultivar para lograr un adecuado número de réplicas, que garanticen resultados que reflejen de manera representativa la respuesta del conjunto de los cultivares a evaluar, bajo las condiciones experimentales.
Preparación del inóculo
1. Con el auxilio de un pincel, colectar uredosporas de P. kuenhii de pústulas en hojas de caña de azúcar del cultivar susceptible ‘C01-227’ (Figura 1b).
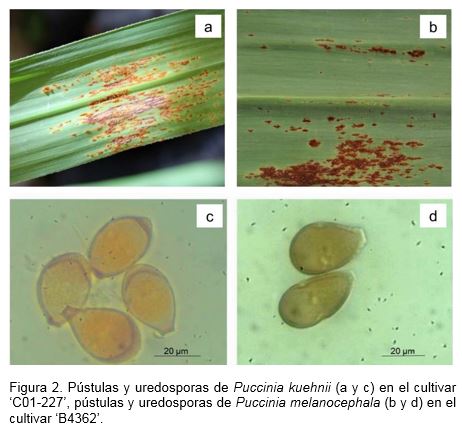
2. Diagnosticar mediante microscopía óptica la presencia de P. kuehnii en las muestras colectadas y la ausencia Puccinia melanocephala Sydow (Figura 2).
Nota: Las pústulas o uridenios de P. kuehnii son generalmente naranja a marrón amarillento, lineales, hasta 1.5 mm de largo. Las uredosporas de color (naranja-amarillo), obovoides o piriformes, a veces elipsoidales, de tamaño muy variable, 25-57 x 17-34 μm, con paredes doradas a naranjas o canela-marrón, de 1-2 μm de espesor lateralmente, pero usualmente con un pronunciado engrosamiento apical de 5 μm o más. Las esporas son moderadamente equinuladas (CABI, 2016). Más detalles de las pústulas y uredosporas de P. kuehnii que las diferencian de P. melanocephala se muestran en la Figura 2.
3. Confirmar, según las posibilidades, la presencia de P. kuenhii a través de diagnóstico molecular. Para ello se recomienda la extracción del ADN total de uredosporas o de tejido foliar con presencia de pústulas acorde con el protocolo de extracción in situ propuesto por Xin et al. (2003). La Reacción en Cadena de la Polimerasa (RCP) se realizará con los cebadores PKPM-F (AAGAGTGCACTTAATTGTGGCTC) y PKPM-R (TCCCACCTGATTTGAGGTCT) según (Glynn et al., 2010).
Nota: Estos cebadores permiten amplificar un fragmento de ADN de la región ITS de las dos especies de roya de la caña de azúcar con productos esperados de tamaños diferente: 585 pb (pares de base) para P. melanocephala y 606 pb para P. kuehnii.
4. Preparar una suspensión de esporas con agua destilada, con la ayuda de un pincel, directamente en un vaso de precipitado. El volumen de suspensión dependerá del número de plantas empleadas en el experimento (Figura 1b).
5. Homogenizar la suspensión con el empleo de un agitador magnético a baja velocidad, durante un periodo de 2 a 3 min. Determinar la concentración de inóculo a través del conteo de esporas en cámara de Neubauer (Hematocímetro) en un microscopio óptico (aumento 400x).
6. Ajustar la concentración de esporas con agua destilada estéril hasta un valor aproximado de 4-5x105 uredosporas ml-1.
Nota: Es importante no emplear concentraciones de uredosporas superiores para evitar la auto inhibición de la germinación.
Inoculación
1. Aplicar 250 µl de una suspensión de 4-5x105 uredosporas ml-1 con una micropipeta en la hoja enrollada de acuerdo con lo descrito por Sood et al. (2009) (Figura 1c). Marcar el extremo la hoja inoculada con un marcador indeleble.
Nota: Las ventajas de esta técnica de inoculación artificial según Sood et al. (2013) incluyen: 1) exposición uniforme de todas las plantas bajo condiciones favorables para la enfermedad, 2) concentración óptima de inóculo del patógeno, 3) método apropiado para evaluar diferentes concentraciones de inóculo y condiciones ambientales para el desarrollo de la enfermedad.
2. Dejar secar las hojas inoculadas durante un periodo de 2 a 3 horas y luego aplicar un riego de 20 min. Continuar con una frecuencia de dos riegos diarios con una duración de 10 min para mantener una alta humedad relativa entre 70-90%. La temperatura debe mantenerse entre 20 y 25 ºC en el cuarto de inoculación, con ayuda de sistemas de climatización si es necesario.
3. Observar diariamente las plantas hasta detectar la aparición de los primeros síntomas de la enfermedad (puntos cloróticos), seguido de lesiones naranja-carmelitas, así como la emergencia y desarrollo de pústulas esporuladas en cultivares susceptibles a la enfermedad.
Evaluación
Para seleccionar cultivares de caña de azúcar por su resistencia a P. kuehnii empleando el método de inoculación artificial sobre la hoja enrollada se recomienda determinar las siguientes variables:
Periodo de incubación: días comprendidos entre la inoculación y la aparición de los primeros síntomas visibles observados en más del 50% de las plantas. Se evaluará a partir de los 3 y hasta los 10 días posteriores a la inoculación (dpi).
Periodo de latencia: días transcurridos entre la inoculación y la esporulación en al menos una pústula en el 50% o más de las plantas (Martin, 2010; Pérez, 2013). Se evaluará entre los 10 y hasta 25 dpi.
Número de pústulas/cm2: entre los 25 y 30 dpi se cuantificará el número de pústulas en el área de inoculación. Esto permitirá ubicar a los cultivares en una escala que describe la respuesta de cada cultivar según lo referido por Sood et al. (2009) (Tabla 1).
El conteo de pústulas se realiza en aquellos cultivares que completen el ciclo de infección de la enfermedad. Se toman imágenes con una cámara digital de las hojas inoculadas en la sección donde se concentra la mayor cantidad de pústulas. Debe incluirse en la foto una regla milimetrada (Figura 1d). Luego las imágenes se procesan a través del programa de análisis y procesamiento de imágenes ImageJ 1.43u (Abramoff et al., 2004; Ferreira y Rasband, 2012) u otro con similares funciones que permitan el conteo de las pústulas y sus dimensiones.
En caso de no contarse con cámara digital, alternativamente puede emplearse una plantilla con una ventana de 1 cm2, en la que se puede hacer el conteo de las pústulas de modo manual. No se recomienda determinar el resto de las variables cuantitativas por este método.
El grado de la respuesta a la roya naranja está correlacionado con el proceso de formación, presencia, cantidad y tamaño de las pústulas así como la cantidad de esporulación producida por unidad de área foliar infectada. Se estima tomando como referencia la escala de clasificación de cinco grados de la respuesta a P. kuehnii en caña de azúcar propuesta por Sood et al. (2009) (Tabla 1) entre los 25 y 30 dpi.

Largo, ancho y área de cada pústula: variables cuantitativas que facilitarán una mejor caracterización de la respuesta. Se aplica un procedimiento similar al conteo de pústulas con un programa de análisis y procesamiento de imágenes.
Nota: El protocolo que se ofrece cuenta con tres patrones de resistencia y susceptibilidad que fueron los encontrados entre los cultivares disponibles, no obstante este protocolo puede ser perfeccionado con la posterior inclusión de cultivares que presenten otros grados de respuesta (0 y 3) a P. kuehnii en la escala de Sood et al. (2009).

CULMINACIÓN DEL ENSAYO
Con la conclusión de la última evaluación se procede a desmontar el experimento. Las plantas inoculadas se extraerán de las bolsas y serán colocadas en bolsas de polietileno, para evitar de esta forma la propagación del patógeno. Luego las bolsas pasarán por un proceso de incineración para eliminar todos los restos vegetales.
CONSIDERACIONES FINALES
El presente protocolo garantiza la selección en casa de cultivo de cultivares de caña de azúcar por su resistencia a la roya naranja. Constituye una herramienta útil y reproducible en el monitoreo de la infección por P. kuehnii para un amplio número de cultivares. Logra uniformidad del material vegetal en cuanto a edad fisiológica, número de hojas activas, altura y calidad fitosanitaria de las plantas. Posibilita aplicar igual concentración de inóculo en todas las plantas y con ello asegura homogeneidad durante el desarrollo de los síntomas. En comparación con la infección natural en campo brinda una mayor precisión en la determinación de las variables que caracterizan el proceso de infección (periodo de incubación y latencia). Además, permite determinar la respuesta de los cultivares a P. kuehnii mediante una escala de clasificación, así como evaluar otras variables que caracterizan la resistencia a la roya naranja.
REFERENCIAS
Abramoff MD, Magalhaes PJ, Ram SJ (2004) Image Processing with Image J. Biophotonics International 11 (7): 36-42
Aday OD, Alfonso I, González R, Díaz FM, Gil YC, Reyes SP, Barroso JM (2014) Severidad de la roya naranja en cultivares de caña de azúcar infectados en la provincia de Villa Clara. Fitosanidad 18 (3): 143-150
Aday OD, Alfonso I, Rodríguez E, Díaz FR, Gil Y, Valdés BL, Barroso J (2016) Caracterización de los síntomas de la roya naranja [Puccinia kuehnii (W. Kruger) E. J. Butler] en cuatro cultivares de caña de azúcar en Cuba. Centro Agrícola, Edición
Barrante J, Chavarría E (2008) Acciones estratégicas realizadas y en proceso como respuesta para enfrentar el ataque de roya en la zona sur, informe presentado por la Liga Agrícola Industrial de Caña de Azúcar (Laica), Costa Rica. Disponible en: http://www.cengicaña.org/Portal/ Consultado 4/01/2009
CABI (2016) Puccinia kuehnii (orange rust). Disponible en: http://www.cabi.org/isc/ Consultado: 14/09/2016
Chavarría E, Subirós F, Vega J, Ralda G, Glynn NC, Comstock JC, Castlebury LA (2009) First report of Orange Rust of sugarcane caused by Puccinia kuehnii in Costa Rica and Nicaragua. Plant Disease 93 (4): 425; doi:10.1094/PDIS-93-4-0425C
Chávez, M, Durán J R (1999) Actualidad de las enfermedades que afectan la caña de azúcar en Costa Rica. En: Colegio de Ingenieros Agrónomos de Costa Rica (ed) XI Congreso nacional Agronómico y de Recursos Naturales, San José, 19-23/07/1999, pp. 30-x, MAG, San José Costa Rica
Ferreira T, Rasband W (2012) ImageJ User Guide, IJ146r. Disponible en: http://imagej.nih.gov/ij/docs/guide Consultado: 25/5/2015
Glynn NC, Dixon LJ, Castlebury LA, Szabo LJ, Comstock JC (2010) PCR assays for the sugarcane rust pathogens Puccinia kuehnii and P. melanocephala and detection of a SNP associated with geographical distribution in P. kuehnii. Plant Pathology 59(4):703-711; doi:10.1111/j.1365-3059.2010.02299.x
Magarey RC (2000) Orange rust. En: Rott P, Bailey RA, Comstock JC, Croft BJ, Girad JC, Saumtally S (eds). A Guide to Sugarcane Diseases, pp.121–125. CIRAD – ISSCT, Montpellier; ISBN: 2876143860
Magarey R, Staier T, Bull J, Croft B, Willcox T (2005) The Australian sugarcane orange rust epiphytotic. Proceeding International Society Sugar Cane Technologists 25: 648–654
Martins TD (2010) Aspectos epidemiológicos da ferrugem alaranjada da cana-de-acucar. Tese apresentada para obtencao do título de Doutor em Ciencias, Universidad de São Paulo, Escola Superior do Agricultura Luiz de Queiroz, Piracicaba, Brasil
Mesa, J M L, González R M, Rodríguez M R, García H P (2016) XXIII Reunión Nacional de Variedades, Semillas y Sanidad Vegetal. Cuba & Caña (Suplemento Especial): 32- 49
Pérez JR, Rufín Y, Pérez Y, Alfonso I (2012) Desarrollo alcanzado por la roya naranja Puccinia kuehnii (Krüger) Butler de la caña de azúcar en Cuba evaluado a partir de la evolución de Focos de la enfermedad. Cuba & Caña 1: 35-40
Pérez SG (2013) Quantificação de parãmetros monocíclicos da ferrugem alaranjada (Puccinia kuehnii) em cana de açúcar. Dissertação apresentada para obtenção do título de Mestre em Ciências, Universidade São Paulo Escola Superior do Agricultura Luiz de Queiroz, Piracicaba, Brazil
Pérez SH (2014) Diagnóstico de la presencia de roya naranja (Puccinia kuehnii (Krüger) Butler) en clones comerciales de caña de azúcar (Saccharum spp.) en el sureste de México. Tesis presentada como requisito parcial para obtener el grado de Maestro en Ciencias, programa Producción Agroalimentaria en el Trópico. Colegio de Postgraduados,Tabasco, México
Ovalle W, Orozco H, Fong E, Garcia S (2010) The effect of orange rust (Puccinia kuehnii) on sugar yield in six sugarcane varieties in Guatemala. Proceeding International Society Sugar Cane Technologists 27: 1-9
Sood S, Comstock J, Glynn N (2009) Leaf whorl inoculation method for screening sugarcane rust resistance. Plant Disease 93 (12):1335-1340; doi: 10.1094/PDIS-93-12-1335
Sood S, Comstock JC, Raid RN (2013) Evaluation of sugarcane clones in the CP-cultivar program for resistance to Puccinia kuehnii, the pathogen of orange rust. Proc Int Soc Sugar Cane Technol 28: 1-7
Valdés B L, Aday O, Ocaña B, Rojas LE, Hernández M., Acosta M, Gil V, González A, Rivero L, Oloriz M I (2016) Caracterización de la respuesta de cultivares de caña de azúcar a la roya naranja en casa de cultivo. Biotecnología Vegetal 16 (1): 21-29
Virtudazo, E V, Nojima H, Kakishima M (2001) Taxonomy of Puccinia species causing rust diseases on sugarcane. Mycoscience 42 (2): 167-175; doi: 10.1007/BF02464133
Xin Z, Jeff PV, Melvin JO, John JB (2003) High throughput DNA extraction method suitable for PCR.
BioTechniques 34 (4): 820-826; doi: 10.1.1.453.6278
Recibido: 15-11-2016
Aceptado: 23-12-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
