Artículo original
Biotecnología Vegetal Vol. 16, No. 3: 179 - 188, julio - septiembre, 2016
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Concentración óptima de Metano Sulfonato de Etilo en Phaseolus vulgaris L. cv. ‘DOR 364’ para inducir variaciones fenotípicas
Optimal concentration of Ethyl Methane Sulfonate for phenotypic variation induction in Phaseolus vulgaris L. cv. 'DOR 364'
Luis Rojas 1, Raúl Collado1, Aidelyn León García2, Leonardo Rivero1. Bárbara Ocaña1, Marilín Hernández1, Novisel Veitía1, Amanda Martirena-Ramírez1, Dámaris Torres1, Lourdes R García1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: luis@ibp.co.cu
2 Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
RESUMEN
El frijol común (Phaseolus vulgaris L.) es la principal leguminosa utilizada para la alimentación humana a nivel mundial, por lo que es un objetivo importante en los programas de mejoramiento genético para favorecer determinados caracteres de interés agronómico. Con el propósito de determinar la concentración óptima de metano sulfonato de etilo, para inducir variaciones fenotípicas en Phaseolus vulgaris L. cv. ‘DOR 364’ se realizó este trabajo. Las semillas se trataron con diferentes concentraciones de metano sulfonato de etilo (0, 20, 30, 40, 50, 60 mM) y se sembraron en bolsas de polietileno que contenían 4 kg de sustrato. Las evaluaciones se realizaron en variables involucradas en la germinación, crecimiento, desarrollo foliar, morfología de las plantas así como componentes del rendimiento. El metano sulfonato de etilo influyó sobre las diferentes etapas de desarrollo del cultivo que fueron analizadas. Basados en la germinación y desarrollo de las plantas, la supervivencia, los componentes del rendimiento y la frecuencia de variaciones fenotípicas se seleccionó 30 mM de metano sulfonato de etilo como la concentración óptima para establecer una población de posibles mutantes en frijol común cv. ‘DOR 364’. Hasta la fecha no se han informado estudios previos al respecto. Con la concentración óptima se logró generar el mayor número de variaciones fenotípicas en la población analizada.
Palabras clave: componentes del rendimiento, frijol común, morfología, mutaciones
ABSTRACT
Common bean (Phaseolus vulgaris L.) is the main legume used for human consumption worldwide and is an important objective in breeding programs to favor certain characteristics of agronomic interest. In order to determine the optimal concentration of ethyl methane sulfonate to induce phenotypic variation in Phaseolus vulgaris L. cv. 'DOR 364' a study was carried out. The seeds were treated with different concentrations of ethyl methane sulfonate (0, 20, 30, 40, 50, 60 mM) and seeded in polyethylene bags containing 4 kg of substrate. Evaluations were carried out on variables involved in germination, growth, foliar development, plant morphology as well as yield components. The ethyl methane sulfonate influenced the different stages of development of the culture that were analyzed. Based on germination and plant development, survival, yield components and frequency of phenotypic variations, 30 mM ethyl methane sulfonate was selected as the optimal concentration to establish a population of possible mutants in common bean cv. 'DOR 364'. To date, no previous studies have been reported. With the optimum concentration it was possible to generate the greatest number of phenotypic variations in the analyzed population.
Keywords: common bean, morphology, mutation, phenology, yield components
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.), es una especie diploide (2n = 2x 11 = 22), de ciclo anual y predominantemente autógama. Esta especie fue domesticada hace más de 7000 años y se han identificado dos centros de origen: Mesoamérica (México y América Central) y la región Andina (Bitocchi et al., 2012). Esta leguminosa se considera una fuente importante de proteínas (~ 22%), vitaminas y minerales (Ca, Cu, Fe, Mg, Mn, Zn) para la dieta humana, especialmente en los países en desarrollo (Broughton et al., 2003). La producción mundial en el 2013 fue de 23.1 millones de toneladas y su rendimiento 1.7 t ha -¹ (FAO, 2014).
En Cuba este cultivo es afectado por varios factores abióticos que inciden negativamente en su rendimiento, como son la poca disponibilidad de agua, altas temperaturas y salinidad de los suelos. Además, hay factores bióticos como virus, hongos fitopatógenos, bacterias e insectos plaga que también comprometen su producción (Corzo López et al., 2015). La obtención de cultivares capaces de enfrentar las condiciones adversas mencionadas sin afectar su rendimiento, es un propósito fundamental de los programas de mejoramiento genético en esta importante leguminosa.
El empleo de la mutagénesis inducida puede ser una vía para lograr estos fines. El uso de agentes mutagénicos, como el metano sulfonato de etilo (EMS, por sus siglas en inglés), ha jugado un papel fundamental en este sentido (Porch et al., 2009). El EMS es el agente mutagénico más utilizado en las plantas para desarrollar grandes poblaciones de mutantes, ya que crea un alto número de mutaciones puntuales, en casi todas las especies estudiadas. La frecuencia de mutaciones inducidas es independiente del tamaño del genoma (Greene et al., 2003).
A principios del siglo XX se comenzaron a aplicar técnicas de mutagénesis para incrementar la variabilidad en plantas y acelerar la obtención de individuos mutantes. Es a partir de 1950 que se lograron cultivares mejorados a través de este procedimiento. La FAO en 1994, publicó una lista con más de 1800 cultivares obtenidos por mutagénesis. La mayoría de los cultivos explotados en el mundo provienen de cruzamientos de cultivares mutados, por ejemplo, el 70% del trigo (Triticum aestivum L.) sembrado en Italia provenía de cultivos mutados (González, 2014). Sin embargo, no es posible extrapolar los resultados obtenidos en investigaciones previas con el empleo del EMS, ya que la concentración óptima para la inducción de mutagénesis varía en dependencia de la especie y dentro de esta con el cultivar (Till et al., 2007).
El cultivar de frijol común ‘DOR 364’ tiene una amplia aceptación en diferentes regiones de Centro América. En Cuba se cultiva principalmente en la región oriental por su tolerancia a las altas temperaturas y su adaptabilidad a un amplio rango de suelos, es resistente al Virus del mosaico amarillo dorado, pero tiene ciclo vegetativo largo por lo cual no se adapta a períodos lluviosos cortos (CNIA-INTA, 1995). Por tanto, reviste gran importancia, la obtención de mutantes con tolerancia al estrés hídrico a partir de este cultivar. Para ello, el empleo de EMS puede ser una vía factible. Sin embargo, la concentración óptima de este agente mutagénico para la inducción de mutaciones en dicho cultivar no se ha informado en la literatura científica internacional. Esta investigación se realizó con el objetivo de determinar la concentración óptima de metano sulfonato de etilo en Phaseolus vulgaris L. cv. ‘DOR 364’ para establecer una población de posibles mutantes.
MATERIALES Y MÉTODOS
Material vegetal
Para el presente estudio se utilizaron semillas del cv. ‘DOR 364’ conocido como ‘Delicias 364’ (testa roja oscura). Según CNIA-INTA (1995), este cultivar fue desarrollado por el proyecto de Mejoramiento Genético del Centro Internacional de Agricultura Tropical. Usaron como progenitores ‘Revolución 83’ y ‘RAB 166’ x ‘DOR 125’.
Mutagénesis
Para inducir mutaciones en las semillas del cultivar ‘DOR 364’ se empleó el protocolo propuesto por Pankhurst et al. (2004) que incluye el uso de EMS como agente mutagénico. Los ensayos se realizaron con concentraciones de 0, 20, 30, 40, 50 y 60 mM de EMS, que anteriormente habían sido propuestas por Porch et al. (2009) para el trabajo con Phaseolus vulgaris L. cv. ‘BAT 93‘.Se utilizaron 125 semillas para cada tratamiento.
La siembra de las semillas se realizó en bolsas de polietileno con 4 kg de sustrato (80% de materia orgánica y 20% de zeolita) a una densidad de siembra de cinco semillas por bolsa y 25 bolsas por tratamiento. Estas fueron colocadas en un cantero, en casa de cultivos protegidos, con un área de 30 m², 20 m de largo por 1.50 m de ancho. Se depositó una semilla por nido. Se utilizó riego por aspersión dos veces al día durante 3 min. Tanto para la aplicación del agente mutagénico como para la siembra de las semillas se tomaron las medidas de seguridad recomendadas para este tipo de producto químico, según Shu et al. (2011).
Evaluaciones fenotípicas
A los 7 y 14 días después de la siembra se contabilizó el número de semillas germinadas en todos los tratamientos y se calculó el porcentaje de germinación tomando en cuenta aquellas plantas que tuvieran totalmente abiertos los dos primeros foliolos.
Con el objetivo de determinar el efecto del EMS en el crecimiento y desarrollo de las plantas de frijol, a los 14 días de cultivo se midió la altura (cm) desde la base al nivel del sustrato hasta el extremo superior el ápice de la planta. Posteriormente, al inicio de la floración se determinó el área foliar (cm2). Para ello, se utilizaron 10 plantas por tratamiento, excepto en los tratamientos con las concentraciones de 50 y 60 mM de EMS donde solo se muestrearon cuatro plantas que alcanzaron desarrollo fenotípico similar al control. Para la colecta de los datos se midió la longitud y ancho de cada foliolo (cm). El área foliar se calculó a través de la fórmula:
AF= Σ (l * a) * 0.73
Dónde: AF: área foliar, l: largo de cada foliolo (cm), a: ancho de cada foliolo (cm) y 0.73: coeficiente de área foliar para frijol común determinado por Lazarov (1965).
Mediante observación visual, se detectaron las posibles variaciones morfológicas ocurridas en las plantas provenientes de semillas tratadas con EMS. Teniendo en cuenta el tipo de cambio en la morfología, se cuantificó el número de plantas que presentaron variaciones y se calculó la frecuencia de estas en cada tratamiento. A través de evaluaciones en el transcurso del desarrollo de las plantas se determinó el efecto del EMS en la duración de las fases fenológicas. Basado en la descripción de las fases fenológicas del frijol indicadas por Fernández et al. (1986), se seleccionaron en la fase vegetativa la etapa de emergencia (V1) y en la reproductiva las etapas floración (R6), llenado de vainas (R8) y maduración (R9).
A los 35 y 45 días de cultivo se determinó la influencia de EMS en la floración. Para ello, se cuantificó el número de plantas con flores en cada tratamiento y se tuvo en cuenta que cada individuo presentara al menos dos flores abiertas. A partir de los datos colectados se determinó el porcentaje de plantas con flores.
Al final del ciclo del cultivo, se realizó un conteo por tratamiento del número de plantas fértiles (presencia de legumbres) que llegaron a la cosecha y se calculó el porcentaje de supervivencia total, tomando como referencia el número de semillas sembradas.
Para la evaluación del rendimiento (número de legumbres por planta) se tomaron 10 plantas por tratamiento, excepto en los tratamientos con las concentraciones de 50 y 60 mM de EMS donde solo se muestrearon cuatro plantas que alcanzaron desarrollo fenotípico similar al control. Estas se secaron expuestas a la luz solar por dos días durante 8 horas. Transcurrido este período, se cuantificó el número de legumbres por planta, el número de semillas por legumbre y la masa fresca de las semillas por legumbre (g) en cada tratamiento, además para cada tratamiento se determinó el peso de 100 semillas.
Teniendo en cuenta las variables analizadas en el transcurso de la investigación se seleccionó la concentración óptima de EMS (mayor número de variaciones fenotípicas observadas con una supervivencia entre el 40 y 50% en las plantas provenientes de semillas tratadas con EMS) para poder establecer una población de mutantes en el cultivar ‘DOR 364’.
En el montaje del experimento se empleó un diseño experimental aleatorio. Se utilizaron seis tratamientos y 125 muestras por tratamiento. Cada muestra se definió como una unidad experimental, por lo que el número de réplicas establecidas por tratamiento dependió del número de plantas que sobrevivieron y fueron capaces de pasar de una fase fenológica a otra. Para el análisis de los resultados se aplicó el paquete estadístico SPSS versión 22. A causa de que los datos colectados a partir de algunos de los tratamientos, no presentaron distribución normal, se aplicó la prueba de Kruskall Wallis para la comparación de las medias. En la búsqueda de los grupos homogéneos o diferencias significativas entre grupos se aplicó la prueba de rango múltiple Scheffe (α=0.05). El cálculo del error estándar se realizó mediante la raíz cuadrada del producto de la media cuadrática dividida entre el tamaño de la muestra.
RESULTADOS Y DISCUSIÓN
Con el incremento de la concentración de EMS disminuyó del porcentaje de germinación de las semillas tratadas (Tabla 1). A los siete días de cultivo, el mayor porcentaje de germinación se observó en el control con diferencias significativas con el resto de los tratamientos (Tabla 1). En este período de tiempo, no se presentaron diferencias entre los tratamientos de semillas tratadas con 20 y 30 mM de EMS. Sin embargo, esta variable decreció significativamente para los tratamientos con concentraciones superiores a 40 mM (Tabla 1).
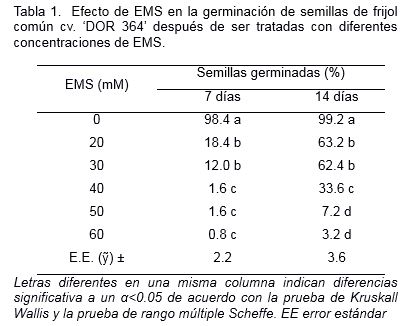
Al comparar el porcentaje de semillas germinadas obtenido a los 7 y 14 días, se observó un incremento de esta variable, en todos los tratamientos estudiados cuando aumentó el período de cultivo (Tabla 1). Con la aplicación de 20 y 30 mM de EMS, la germinación disminuyó en un 36 y 37% en comparación con el control. Esta afectación fue significativamente mayor con un 65.6% de semillas que no germinaron para las semillas tratadas con 40 mM de EMS. Similar a los resultados observados a los siete días después de la siembra, las semillas tratadas con las concentraciones de 50 y 60 mM de EMS presentaron el menor porcentaje de germinación (Tabla 1).
El porcentaje de germinación es una variable importante en la determinación de la concentración óptima de EMS, para establecer poblaciones de mutantes de frijol común según Porch et al. (2009). Estos autores informaron que la aplicación de EMS afectó drásticamente el porcentaje de germinación e incluso provocó dilatación de la etapa de germinación. Se ha descrito, que la determinación de la concentración óptima de EMS para la obtención de poblaciones de mutantes, está influenciada por la especie y dentro de una misma especie por el cultivar (Wu et al., 2005; Till et al., 2007). Esta respuesta diferente es causada por la sensibilidad de la especie o cultivar objeto de estudio al agente mutagénico empleado. Un ejemplo de ello, lo constituyen los resultados obtenidos en este trabajo para ‘DOR 364’, comparados con los mencionados por Porch et al. (2009) en ‘BAT 93‘, donde se empleó también el protocolo de Pankhurst et al. (2004). Al parecer el cv. ‘DOR 364’ es más sensible al efecto del EMS que el cv. ‘BAT 93‘, pues para las semillas tratadas con 20 mM de EMS, el porcentaje de germinación en ‘DOR 364’ fue de 63.2%, mientras que en ‘BAT 93‘ superó el 96% (Porch et al., 2009).
El EMS influyó también sobre las variables relacionadas con el crecimiento de plantas de frijol común cv. ‘DOR 364’. La altura de las plantas se afectó con la aplicación de EMS a las semillas (Tabla 2). No se observaron diferencias significativas en la altura de las plantas provenientes de las semillas tratadas con 20, 30 y 40 mM de EMS. Sin embargo, con 50 y 60 mM fue significativamente inferior comparada con las plantas procedentes de semillas tratadas con 20 mM (Tabla 2).
El área foliar de las plantas provenientes de semillas tratadas con EMS también se afectó. En la medida que se incrementaron las concentraciones de EMS se observó una disminución significativa del área foliar, que llegó a su valor inferior en las plantas derivadas de semillas tratadas con 40 y 50 mM de EMS (Tabla 2).

De forma general, se apreció que la aplicación de EMS afectó el crecimiento y desarrollo de las plantas de frijol. Las diferentes respuestas observadas pudieron estar relacionadas con el efecto del EMS en el retardo de las fases fenológicas del cultivo. Entre los cambios fenotípicos observados en las plantas derivadas de semillas tratadas con EMS se destacaron el acortamiento de los entrenudos, raquitismo y enanismo. Los resultados presentados en este trabajo de la influencia del EMS en la altura de las plantas coinciden con los obtenidos previamente por Porch et al. (2009).
En todos los tratamientos se observaron variaciones morfológicas (Tabla 3). Las más frecuentes fueron engrosamiento del tallo con ápice caulinar atrofiado, tallo enano, tallo raquítico, hojas pequeñas, hojas con epidermis rugosa, hojas de color verde intenso, albinismo y clorosis. Es de destacar que la mayor frecuencia de variaciones morfológicas, se presentaron en las plantas provenientes de semillas tratadas con 30 mM de EMS, seguida de los tratamientos donde se aplicaron 20 y 40 mM del agente mutagénico (Tabla 3).
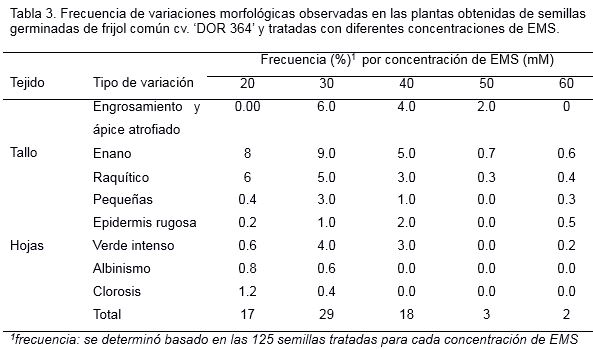
La detección de cambios morfológicos es un aspecto importante a tener en cuenta para la determinación de la concentración óptima de un agente mutagénico. Aunque estos cambios son solo observables a nivel de fenotipo, a través de ello se puede estimar la frecuencia de mutaciones (Porch et al., 2009). En esta investigación la mayor frecuencia de cambios morfológicos se presentó en el rango de concentraciones de 20–40 mM de EMS. Las manifestaciones de variaciones morfológicas disminuyeron con el incremento de las concentraciones de este agente mutagénico a 50 y 60 mM, esto debió estar influenciado por la baja supervivencia de las plantas pertenecientes a dichos tratamientos (Tabla 3).
Los cambios causados por el EMS en la morfología de las plantas de frijol, detectados en esta investigación han ocurrido con frecuencia en otras especies. Por ejemplo, tallos enanos en Catharanthus roseus (L.) G. Don (Mangaiyarkarasi et al., 2014). En otros cultivares de frijol irradiados con rayos Gamma se ha observado presencia de hojas albinas y cloróticas (Alvarado-Martínez et al., 2014) y en T. aestivum se redujeron las dimensiones de las hojas (Naresh y Vaishali, 2016).
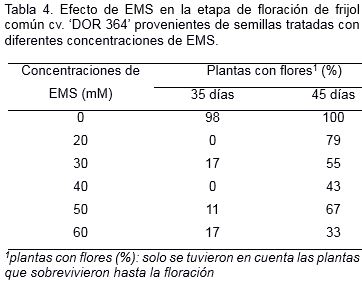
En la etapa de floración, se observó retardo y disminución del número de flores en las plantas de frijol obtenidas de semillas tratadas con diferentes concentraciones de EMS (Tabla 4). A los 35 días de cultivo, cuando la mayoría de las plantas provenientes de semillas sin tratar habían florecido, las plantas originadas de semillas tratadas con 20 y 40 mM de EMS no presentaban flores. Mientras, las plantas procedentes de semillas expuestas a 30, 50 y 60 mM de EMS, apenas iniciaron la floración (Tabla 4).
A medida que aumentó la concentración del EMS, fue mayor la mortalidad y menor el porcentaje de supervivencia (Figura 1). Las concentraciones de 20 y 30 mM de EMS fueron letales en 48–59% de las plantas resultantes de semillas tratadas sin diferencias significativas entre ellas.
Esta variable disminuyó con la aplicación de EMS a concentraciones igual o mayor que 40 mM (Figura 1). Aunque no se presentaron diferencias significativas en la supervivencia de las plantas procedentes de semillas tratadas con concentraciones de EMS a partir de 40 mM, es de destacar que con 50 y 60 mM del agente mutagénico solo llegaron a la cosecha siete y cinco plantas, respectivamente.
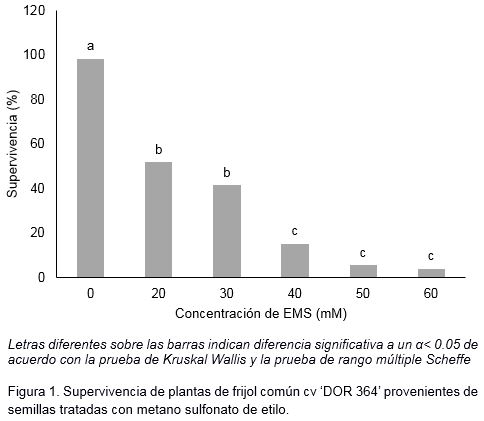
Esta respuesta debe estar relacionada con el demostrado efecto letal del EMS (Konzak et al., 1965), que causó la muerte en más del 90% de las plántulas derivadas de semilla tratadas con las concentraciones mayores de este agente mutagénico. Resultados similares a los obtenidos en esta investigación fueron informados por Porch et al. (2009). Estos autores indicaron que el aumento de las concentraciones de EMS provocó una disminución en el porcentaje de supervivencia en el cultivar de frijol ‘BAT 93’.
Al analizar el efecto del EMS sobre los componentes del rendimiento, no se detectaron diferencias significativas entre los tratamientos para el número de legumbres por planta (Tabla 5). Sin embargo, el número de semillas por legumbre y el número de semillas por planta disminuyeron significativamente. Las legumbres de las plantas provenientes de semillas tratadas con EMS presentaron menor cantidad de semillas que el control, de ello se deriva que el número de semillas por planta fue dos veces mayor en las plantas procedentes de semillas sin tratar. Para las dos variables, número de semillas por legumbre y número de semillas por planta, no se observaron diferencias significativas en la respuesta de plantas resultantes de semillas tratadas con las distintas concentraciones de EMS.
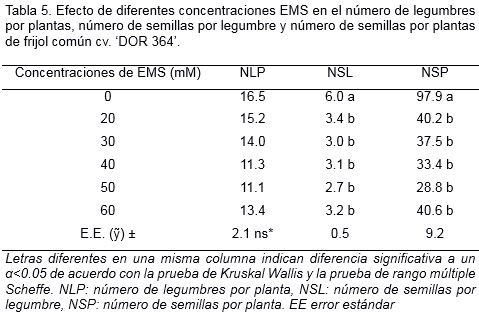
La masa fresca de las semillas por legumbre y la masa fresca de las semillas por planta se afectaron a causa del tratamiento con EMS. En la masa fresca de las semillas no se detectaron diferencias significativas entre las concentraciones de EMS estudiadas (Tabla 6).
La masa fresca 100 semillas es una variable ampliamente utilizada para diferenciar entre tratamientos teniendo en cuenta el rendimiento. En esta variable, no se observaron diferencias significativas entre el control y los tratamientos donde se aplicaron 20, 30 y 60 mM de EMS (Tabla 6). Una reducción significativa en la masa fresca 100 semillas ocurrió cuando las concentraciones de EMS se incrementaron a 40 y 50 mM sin diferencias entre ellas (Tabla 6).
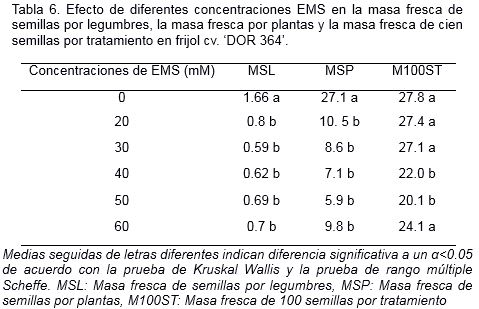
En esta investigación varios componentes del rendimiento fueron analizados, la mayoría de ellos solo permitieron diferenciar la respuesta entre el control y las plantas provenientes de semillas tratadas con EMS. De forma general, se observó una reducción del rendimiento a causa de la aplicación del agente mutagénico la cual estuvo en correspondencia con la afectación que presentaron las plantas originadas de semillas tratadas con EMS, en el desarrollo vegetativo. La masa fresca de 100 semillas fue la variable que permitió detectar diferencias entre las concentraciones de EMS estudiadas.
Sin embargo, en ambos casos existió una respuesta no esperada de las plantas procedentes de semillas tratadas con 60 mM de EMS. Es de destacar, que en este tratamiento sobrevivieron pocas plantas y por azar quedaron distribuidas a razón de una planta por bolsa, por lo que el incremento en componentes del rendimiento, pudo estar influenciado por una mayor disponibilidad de nutrientes, por lo que en estos casos las plantas no tuvieron afectación por la competencia.
En línea con los resultados de esta investigación, la afectación de los componentes del rendimiento en plantas de frijol provenientes de semillas tratadas con EMS, se describió previamente para el cultivar ‘BAT 93’ por Porch et al. (2009). Posteriormente, se informó que la aplicación de EMS en trigo disminuyó los componentes del rendimiento (Naresh y Vaishali, 2016). En otras investigaciones, la aplicación de radiaciones Gamma provocó afectación en el número de legumbres por planta y las dimensiones de estas en cuatro genotipos de frijol: ‘Rojo de Seda’, ‘Vaina Blanca’, ‘Chaparrastique’ y ‘Ferromás’ (Alvarado-Martínez et al., 2014). Sin embargo, estos autores indicaron que el número de semillas por legumbre de las plantas irradiadas, en dos de los cultivares estudiados fue superior al de las plantas control.
El metano sulfonato de etilo afectó la germinación, crecimiento y desarrollo de las plantas de frijol. El porcentaje de plantas germinadas y el área foliar jugaron un papel importante en la determinación de la concentración óptima del agente mutagénico. Se caracterizó la morfología y la fenología de las plantas provenientes de las semillas tratadas con metano sulfonato de etilo y se demostró la influencia del EMS en el retardo de las etapas fenológicas del cultivo del frijol. El metano sulfonato de etilo influyó sobre los componentes del rendimiento y la supervivencia total de las plantas provenientes de semillas tratadas.
CONCLUSIONES
Basados en la germinación, desarrollo y crecimiento de las plantas, la supervivencia total, los componentes del rendimiento y la frecuencia de variaciones fenotípicas, de las variables evaluadas, 30 mM de EMS es la concentración óptima para establecer una población de plantas en el cultivar de frijol ‘DOR 364’ de posibles mutantes. A esta concentración se observó el mayor número de variaciones fenotípicas y una supervivencia de 41.6%.
REFERENCIAS
Alvarado-Martínez OA, Guevara Campos LA, Ramírez L, Yacoletty C (2014) Evaluación de materiales criollos y mejorados de frijol (Phaseolus vulgaris), irradiados con rayos gamma en la búsqueda de tolerancia a la sequía, San Andrés, municipio de Ciudad Arce, La Libertad. Disertación tesis doctoral, Universidad de El Salvador, San Salvador, El Salvador
Bitocchi E, Nanni L, Bellucci E, Rossi M, Giardini A, Zeuli PS, Papa R (2012) Mesoamerican origin of the common bean (Phaseolus vulgaris L.) is revealed by sequence data. Proceedings of the National Academy of Sciences 109 (14): E788-E796; doi: 10.1073/pnas.1108973109
Broughton WJ, G Hernandez, M Blair, S Beebe, P Gepts, J Vanderleyden (2003) Bean (Phaseolus spp.)-model food legumes. Plant Soil 252: 55–128; doi: 10.1023/A:1024146710611
CNIA-INTA (1995) Variedad mejorada de frijol rojo DOR 364 Informe anual. Programa de frijol. Instituto Nicaragüense de Tecnología Agropecuaria, Managua
Corzo López M, Rivero González D, Zamora Gutiérrez L, Martínez Zubiaur Y, Martínez Coca B (2015) Detección e identificación de nuevos aislados de Xanthomonas axonopodis pv. phaseoli en cultivares de frijol común (Phaseolus vulgaris L.) en la provincia Mayabeque, Cuba. Revista de Protección Vegetal 30: 97-103
FAO (2005) Importancia del frijol. Disponible en: http://www.fao.stat.org Consultado 07/12/2015
FAO (2014) Agricultura mundial: hacia los años 2015/2030, informe resumido. Disponible en: http://www.fao.org/docrep/004/y3557s/y3557s00.htm Consultado 12/01/2016
Fernández FP, López M (1986) Etapas de desarrollo de la planta de frijol común (Phaseolus vulgaris L.). CIAT, Cali; ISBN: ISBN 84-89206-54-6
González M (2011) Towards a Tilling platform for functional genomies in piel de Sapo melons. BMC Research notes 4 (1): 289; doi: 10.1186/1756-0500-4-289
González M (2014) Desarrollo de una plataforma de Tilling en melón (Cucumis melo L.). Tesis doctoral. Universidad Autónoma de Barcelona, Barcelona, España
Greene EA, CA Codomo, NE Taylor, JG Henikoff, BJ Till, SH Reynolds, LC Enns, C Burtner, JE Johnson, AR Odden, L Comai, S Henikoff (2003) Spectrum of chemically induced mutations from a large-scale reverse-genetic screen in Arabidopsis. Genetics 164 (2): 731–740
Konzak CF, Nilan RA, Wagner J, Foster RJ (1965) Efficient chemical mutagenesis in the use of induced mutations in plant breeding. Radiation Botany (suppl.) 5: 49-70
Lazarov R (1965) Coefficients for determining the leaf area in certain agricultural crops. Rast Nauki. Sofia 2: 27-37
Ma Y, Bliss FA (1978) Seed proteins of common bean. Crop Sci 18 (3): 431-437; doi: 10.2135/cropsci1978.0011183X001800030018x
Mangaiyarkarasi R, Girija M, Gnanamurthy S (2014) Mutagenic effectiveness and efficiency of gamma rays and ethyl methane sulphonate in Catharanthus roseus. Int J Curr Microbiol App Sci 3 (5): 881-889 doi: 10.22192/2016.03.11.007
Naresh Pratap S, Vaishali (2016) Characterization of wheat (Triticum aestivum) for stay green trait. Journal of Applied and Natural Science 8 (1):107-111
Pankhurst CE, MW Blair, WJ Broughton (2004) TILLING the beans. Phaseomics III, Geneva, 13–25/6/2004, University of Geneva, Geneva
Porch TG, Blair, MW, Lariguet P, Galeano C, Pankhurst CE, Broughton WJ (2009) Generation of a Mutant Population for TILLING Common Bean Genotype BAT 93. J Amer Soc Hort Sci 134 (3): 348–355
Shu QY, Forster BP, Nakagawa H (2011) Plant Mutation Breeding and Biotechnology, FAO/IAEA, Roma; ISBN: 978-92-5-105000-0
Till BJ, Cooper J, Tai TH, Colowit P, Greene EA, Henikoff S, Comai L (2007) Discovery of chemically induced mutations in rice by TILLING. BMC plant biology 7: 19; doi: 10.1186/1471-2229-7-19
Wu JL, Wu C, Lei C, Baraoidan M, Bordeos A, Madamba MRS, Bruskiewich R (2005) Chemical-and irradiation-induced mutants of indica rice IR64 for forward and reverse genetics. Plant molecular biology 59 (1): 85-97; doi: 10.1007/s11103-004-5112-0
Recibido: 09-05-2016
Aceptado: 14-07-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
