Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 19 - 24, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Establecimiento in vitro de Zephyranthes spp.
In vitro establishment of Zephyranthes spp.
Diego Müller1, Pablo García Giménez1, AndrésTravacio2, Mirian Bueno1
1Cátedra de Biología, Facultad de Ciencias Agrarias, Universidad Nacional de Rosario. CC14. Zavalla. Santa Fe. Argentina. CP S2125ZAA e-mail: diego.muller@unr.edu.ar
2Regional Agro Insumos SA, Corrientes 729 Piso 8, Oficina 807. Rosario. Santa Fe. Argentina. CP 2000
RESUMEN
Las plantas del género Zephyranthes son bulbosas, herbáceas y perennes, con gran valor ornamental, debido a que sus flores presentan gran variedad de tamaños y colores. El objetivo del presente trabajo fue establecer in vitro de Zephyranthes spp. a partir de semillas y bulbos como explantes iniciales. Las semillas se sumergieron durante 10 min en hipoclorito de sodio al 1.5%. En los bulbos se extrajeron las catáfilas exteriores y se cortaron en forma longitudinal en tantas secciones (SB) como fue posible. Se evaluaron tres métodos de desinfección: I. 1 min en etanol 90% y 20 min en hipoclorito de sodio al 1.5 %. II. 1 min en etanol 90% y tres tiempos de exposición, 10, 15 y 20 min en el fungicida Mancozeb (4 g l-1). Cada siete días se cuantificó el número de explantes contaminados con microorganismos y se calculó el porcentaje de contaminación microbiana después de 20 días de cultivo. En las semillas se cuantificó el número de semillas germinadas y se calculó el porcentaje de germinación fisiológica (protrusión de la raíz primaria) y formación de órganos. En los bulbos también se evaluó el desarrollo de brotes hasta los 20 días de cultivo. En las semillas la contaminación microbiana fue del 2% y la germinación del 95%. Se observó desarrollo de órganos tales como bulbos, raíces y hojas. Aunque se desarrollaron brotes, los métodos de desinfección de los bulbos no fueron efectivos por 100% de contaminación.
Palabras clave: desinfección, geófita, micropropagación, ornamental
ABSTRACT
The genus Zephyranthes plants bulbous, herbaceous and perennial, with great ornamental value, because their flowers have a great variety of sizes and colors. The objective of the present work was to in vitro establish of Zephyranthes spp. from seeds and bulbs as initial explants. The seeds were immersed for 10 min in 1.5% sodium hypochlorite. In the bulbs, the outer catheles were removed and cut longitudinally in as many sections (SB) as possible. Three methods of disinfection were evaluated: I. 1 min in ethanol 90% and 20 min in 1.5% sodium hypochlorite. II. 1 min in 90% ethanol and three exposure times, 10, 15 and 20 min in the fungicide Mancozeb (4 g l-1). Every seven days the number of explants contaminated with microorganisms was quantified and the percentage of microbial contamination was calculated after 20 days of culture. In the seeds, the number of germinated seeds was quantified and the percentage of physiological germination (protrusion of the primary root) and organ formation were calculated. Bulbs were also evaluated for shoot development up to 20 days of culture. In the seeds microbial contamination was 2% and germination 95%. Organs such as bulbs, roots and leaves were observed. Although shoot were developed, the methods of disinfecting the bulbs were not effective for 100% contamination.
Keywords: disinfection, geophyte, micropropagation, ornamental
INTRODUCCIÓN
La familia Amaryllidaceae J. St.-Hil, de distribución predominantemente pantropical, está representada por especies bulbosas bianuales o perennes (Dahlgren et al., 1985). Existen aproximadamente 860 especies distribuidas en 59 géneros (Meerow y Snijman, 1998). Se encuentran principalmente en el hemisferio sur, especialmente en África (19 géneros) y Sudamérica (28 géneros) (Meerow y Snijman, 1998). Ambas zonas se consideran centro de diversificación. El género Zephyranthes Herb. está incluido en la tribu Hippeastreae (Pax & Hoffmann) Hutch. (1931) (Meerow y Snijman, 2001) y comprende 90 especies, de las cuales 12 se distribuyen en Argentina. Se caracterizan por ser plantas bulbosas, herbáceas y perennes, con gran valor ornamental, debido a que sus flores presentan gran variedad de tamaños y colores.
La mayoría de las especies de Zephyranthes se propagan vegetativamente por medio de división de bulbos. Aunque este método es efectivo, puede llegar a ser muy lento ya que en algunas especies toma dos años o más hasta que la planta florece, como describe Mujib et al. (2014) para Zephyranthes rosea Lindl.
Mediante cultivo de tejidos también se han obtenido resultados en la propagación de especies de Zephyranthes. Los distintos tipos de explantes y los reguladores de crecimiento juegan un rol importante en la micropropagación, una de las aplicaciones más generalizadas. Las catáfilas con una sección del disco basal (catáfilas dobles) son ampliamente usadas (Zhang et al., 2013; Paredes et al., 2014). La organogénesis también se ha informado a partir de explantes como pequeñas secciones de catáfilas (Han et al., 2004), ápices (Shivakumar y Krishnamurthy, 2004) y cormos (Kamo et al., 2014). Los explantes de la sección inferior del bulbo y segmentos completos regeneraron vástagos en Zephyranthes grandiflora Lindl. (Gangopadhyay et al., 2010). La acción de los reguladores de crecimiento, particularmente bencilaminopurina (BAP) y ácido naftalenacético (ANA), en la inducción de vástagos fue informada en la micropropagación de otras especies bulbosas como Polianthes tuberosa L. (Dehdezi et al., 2014) y Fritillaria persica L. (Kizil y Khawar, 2014). Entre varios factores, las concentraciones de reguladores de crecimiento y sacarosa, afectan directamente el éxito en la bulbificación. Este hecho implica la transferencia de los explantes a medios de cultivos con diferentes combinaciones y concentraciones de reguladores a medida que se produce la regeneración de los órganos (Arulanandam et al., 2015; Malik y Bach, 2016).
La prevención de la contaminación microbiana en los estadios iniciales es el mayor reto en el cultivo de tejidos de bulbos y requiere de la aplicación de varios agentes desinfectantes (Smith et al., 1999). Diversos productos químicos se utilizan para desinfectar superficialmente los explantes. Con mayor frecuencia se emplea etanol (70% v/v) e hipoclorito de sodio (1-3%) y con menor frecuencia hipoclorito de calcio (6-12%) y bicloruro de mercurio (0.1-1.25%). Las concentraciones del desinfectante y el tiempo de exposición deben ser ajustados para cada especie y tipo de explante utilizado (Roca y Mroginsky, 1991).
Si bien es factible la regeneración de plantas a partir de técnicas de cultivo in vitro, el potencial regenerativo depende del genotipo, del explante empleado y de las condiciones de cultivo (Appezzato et al., 1999; Passos y Bernachi, 2005).
Debido a que el género estudiado es una geófita, el bulbo representa una fuente importante de explantes para su cultivo in vitro, además de las semillas u otras partes de la planta. Ya que su desinfección es un paso crucial para lograr el éxito en el establecimiento in vitro y, considerando que los bulbos están expuestos a una elevada carga microbiana por ser órganos de almacenamiento subterráneos, el objetivo del presente estudio fue establecer in vitro Zephyranthes spp. a partir de semillas y secciones de bulbos como explantes iniciales.
MATERIALES Y MÉTODOS
Material vegetal
Se seleccionaron plantas de Zephyranthes spp. proveedoras de explantes de un lote experimental de la localidad de Funes, Santa Fe, Argentina (32° 54’ 57’’ S, 60° 48’ 29’’ O). El material vegetal se multiplicó en forma vegetativa en invernadero en la Facultad de Ciencias Agrarias, Universidad Nacional de Rosario. Para los ensayos se utilizaron como explantes semillas y bulbos.
Medio de cultivo
El medio de cultivo consistió en 4.4 g l-1 de la base salina propuesta por Murashige y Skoog (1962) (MS) con vitaminas de Gamborg et al. (1976) y 30 g l-1 de sacarosa. El pH se ajustó a 5.8 con hidróxido de sodio (NaOH) y ácido clorhídrico (HCl) y luego se solidificó con 8 g l-1 de agar-agar. Posteriormente, se esterilizó en autoclave por 20 minutos a 121 °C y 1 atm de presión.
Establecimiento in vitro a partir de semillas
Las semillas se sumergieron durante 10 min en hipoclorito de sodio al 1.5%, luego se lavaron tres veces con agua destilada estéril. Posteriormente, se colocó una semilla por frasco de vidrio de 4 cm alto x 2 cm diámetro con 1 ml de medio de cultivo. Se emplearon 100 semillas.
A los 20 días de cultivo, las semillas germinadas, se transfirieron a tubos de 12 cm alto x 3 cm de diámetro con 4 ml de igual medio de cultivo.
Establecimiento in vitro a partir de bulbos
Los bulbos se lavaron con agua corriente, se extrajeron las catáfilas exteriores y, dependiendo del tamaño del bulbo, se cortaron en forma longitudinal en tantas secciones (SB) como fue posible. Siempre se mantuvo una porción del disco basal.
Se evaluaron tres métodos de desinfección: I. 1 min en etanol 90% y 20 min en hipoclorito de sodio al 1.5 %. II. 1 min en etanol 90% y tres tiempos de exposición, 10, 15 y 20 min en el fungicida Mancozeb (4 g l-1). Se enjuagaron tres veces con agua estéril. Se realizaron tres réplicas de 10 repeticiones por tratamiento, obtenidas a partir de 25 bulbos.
Condiciones de crecimiento
Los explantes se colocaron en cuarto de crecimiento a una intensidad lumínica de 60 µmol m-2 s-1, fotoperiodo de 16 horas diarias a 24 ± 2 °C.
Evaluaciones
Para ambos tipos de explante, cada siete días se cuantificó el número de explantes contaminados con microorganismos y se calculó el porcentaje de contaminación microbiana después de 20 días de cultivo. Esto se realizó por observación directa bajo lupa binocular y microscopio óptico (400x). Además, en las semillas se cuantificó el número de semillas germinadas y se calculó el porcentaje de germinación fisiológica (protrusión de la raíz primaria) y formación de órganos. Se consideró que la radícula había protruido de la semilla cuando alcanzaba una longitud aproximada de 3 mm (López, 1995). En los bulbos también se evaluó el desarrollo de brotes hasta los 20 días de cultivo.
RESULTADOS Y DISCUSIÓN
Los métodos de desinfección empleados en las semillas fueron efectivos y permitieron el establecimiento in vitro de Zephyranthes spp. La incidencia de contaminantes microbianos en el total de semillas utilizado fue de 2%. La contaminación estuvo ocasionada por hongos de los géneros Aspergillus y Penicilium. Este resultado coincide con lo informado por Fernández et al. (2008) para la especie Zephyranthes filifolia Herb. ex Kraenzl.
Transcurrida una semana, se observó en el 95% de las semillas la protrusión de la radícula (Fig. 1 A). El porcentaje de germinación obtenido supera a los referidos por Rodrigo et al. (2006) en Rhodophiala bifida (Herb.) Traub (Amaryllidaceae) y se aproximan a los informados en esta misma especie por Echeverría y Alonso (2010) y Maritano et al. (2011).
Dentro de los 15 días posteriores a la germinación fisiológica se observó la producción de hojas desde el meristemo apical y un ligero ensanchamiento de la base del brote conjuntamente con la formación de raíces (Fig. 1 B). Tal como lo describe Mujica et al. (2008) en ajo (Allium sativum L.) y Him y Paez (1998) en jengibre (Zingiber officinale R.), esta respuesta pudo estar dada por la acumulación de fotoasimilados y nutrientes en las hojas, lo cual favorece el crecimiento y llenado del bulbo y contribuye a su engrosamiento.
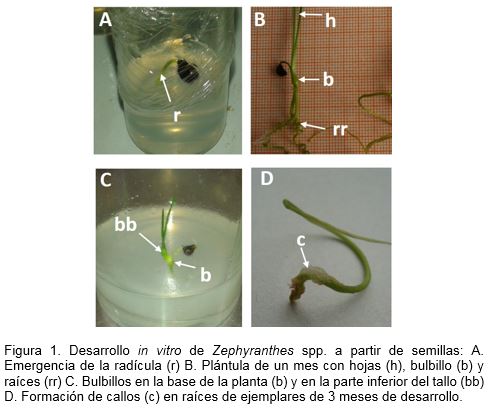
La transferencia de las semillas germinadas a medio de cultivo fresco a los 20 días, permitió el desarrollo de bulbillos en la base de las plantas y en la sección inferior del tallo (Fig. 1 C). Fuentevilla (2004), en cultivo in vitro de Leucocoryne purpurea (Alliaceae), arribó a resultados similares excepto que realizó la transferencia de las plántulas a un medio de cultivo de bulbificación, el cual contiene la misma base salina (MS) pero el doble de concentración de sacarosa (60 g l-1). Los carbohidratos son la principal fuente energética y estructural en los vegetales. Considerando que los órganos de almacenamiento, tales como cormos, rizomas o bulbos, permiten a las plantas resistir periodos desfavorables a través de la acumulación de agua y otros nutrientes, se puede asumir que el suministro de carbohidratos al medio de cultivo induce la formación del bulbo y su posterior desarrollo. En las raíces de algunas pocas plantas se observó la proliferación de tejido calloso (Fig. 1 D).
Las plantas obtenidas por este método pueden ser utilizadas como plantas madre para la posterior producción de explantes libres de contaminantes microbianos.
La desinfección de los bulbos con los distintos agentes desinfectantes no permitió eliminar la carga microbiana inicial presente en los explantes. Debido a esto, aunque se observó desarrollo de brotes, su establecimiento in vitro no fue exitoso.
A los 20 días de cultivo de las SB se observó el desarrollo de brotes en el 1% del total de los explantes (Fig. 2 A), lo cual representa una prueba del potencial organogénico. El 10% se mantuvo viable, pero sin desarrollo de brotes (Fig. 2 B).
El total de los explantes presentaron contaminación por microorganismos. Ningún método de desinfección fue efectivo para controlar la contaminación por hongos del suelo (Fig. 2 C y D). En concordancia con estos resultados, Paredes et al. (2014) obtuvieron porcentajes elevados de contaminación microbiana en el cultivo in vitro de Traubia modesta (Amarillydaceae).

Teniendo en cuenta lo anterior, resulta necesario continuar los estudios para establecer un protocolo de desinfección eficaz para eliminar la contaminación fúngica en bulbos de Zephyranthes spp. De esta manera se podría emplear este tipo de material vegetal como explante inicial para el cultivo in vitro de la especie trabajada. En próximos trabajos pudiera incrementarse la concentración de hipoclorito de sodio según lo indicado por Navarro (2014) o utilizar bajas concentraciones de peróxido de hidrógeno para la desinfección según lo propuesto por Castro y Londoño (2008).
CONCLUSIONES
Zephyranthes spp. se estableció a partir de semillas y se observó el desarrollo de órganos tales como bulbos, raíces y hojas. Sin embargo, aunque se formaron órganos a partir de las secciones de bulbos, la contaminación microbiana afectó al 100% de los explantes.
REFERENCIAS
Appezzato Da Gloria B, Vieira M, Dornelas M (1999) Anatomical studies of in vitro organogenesis induced leaf-derived explant of passion fruit. Pesquisa Agropecuaria Brasilera 34 (11): 2007-2013
Arulanandam John Peter L, Ghanthikumar S, Arunkumar T (2015) In vitro propagation of Rain Lily (Zyphyranthes citrine L.). Botanical Report 4(4): 5-7
Castro D, Londoño S (2008) Producción in vitro de microbulbos de lirio (Lilium sp.). Temas Agrarios 13(1): 5-13
Dahlgren R, Clifford H, Yeo P (1985) The Families of the Monocotyledons. Springer-Verlag Berlin Heidelberg, Berlin; doi: 10.1007/978-3-642-61663-1
Dehdezi A A, Sadat Mousavi E, Azadi P (2014) Evaluation of different growth regulators on proliferation of Polianthes tuberosa. Bulletin of Environment, Pharmacology and Life Sciences 3 (10): 172-174
Echeverría M L, Alonso S I (2010) Germinación y crecimiento inicial de Habranthus gracilifolius y Rhodophiala bifida, amarilidáceas nativas con potencial ornamental. Revista de la Facultad de Ciencias Agrarias 42(1): 23-37
Fernández A, Curvetto N, Marinangeli P (2008) Establecimiento in vitro de Zephyranthes filifolia. En: INTA (ed) 4° Congreso Argentino de Floricultura y plantas ornamentales, Corrientes, 4-7/11/2008, pp. 00-00, INTA, Argentina
Fuentevilla Saa C C (2004) Propagación in vitro de algunas especies de Leucocoryne. Tesis de ingeniero agrónomo. Universidad Católica de Valparaíso, Quillota, Chile
Gangopadhyay M, Chakraborty D, Dewanjee S, Bhattacharya S (2010) Clonal propagation of Zephyranthes grandiflora using bulbs as explants. Biologia Plantarum 54 (4): 793-797; doi: 10.1007/s10535-010-0145-5
Han B, Suh E, Choi S, Yae B, Yu H, Goo D (2004) Stimulation of in vitro bulblet growth by the addition of liquid medium in Lilium oriental hybrid Casablanca. Journal of Plant Biotechnology 6 (4): 241-246
Him D, Paez de Cáceres J (1998) Origen histológico de los órganos regenerados in vitro de jengibre (Zingiber officinale R.) Proceedings of the Interamerican Society for Tropical Horticulture 42: 110-118
Kamo K, Rajasekaran K, Cary J (2014) Growth characteristics of micropropagated, regenerated and transgenic Gladiolus plants. Journal of Applied Horticulture 16(3): 193-198
Kizil S, Khawar KM (2014) The effects of plant growth regulators and incubation temperatures on germination and bulb formation of Fritillaria persica L. propagation of ornamental plants 14(3): 133-138
López H A (1995) Manual de prácticas de laboratorio de producción y tecnología de semillas. Fitotecnia, UACH, Chapingo México
Malik M, Bach A (2016). Morphogenetic pathways from Narcissus L. ‘Carlton’ in vitro cultures of Pc stage flower bud explants according to cytokinin and auxin ratios. Acta Scientiarum Polonorum Hortorum Cultus 15(1): 101-111
Maritano P, Gonzalez Rocca L, Irigoyen E, Marinangeli P, Escandón A (2011) Avances para la micropropagación de una geófita nativa con potencial ornamental: Rhodophiala bifida. En: REDBIO Argentina (ed) VIII Simposio Nacional de Biotecnología REDBIO, Buenos Aires, 13-15/11/2011, pp. 00-00, REDBIO Argentina, Buenos Aires
Meerow A, Snijman D (1998) Amaryllidaceae. En: Kubitzki K (ed) Flowering Plants · Monocotyledons, pp. 83-110. Springer -Verlag, Berlin; doi: 10.1007/978-3-662-03533-7_11
Meerow A, Snijman D (2001) Phylogeny of Amaryllidaceae tribe Amaryllidaceae based on nrDNA ITS sequences and morphology. American Journal of Botany 88 (12): 2321-2330
Mujib A, Banerjee S, Maqsood M, Ghosh P D (2014) Organogenesis and plant regeneration in Zephyranthes rosea Lindl.: Histological and chromosomal study. Plant Biosystems-An International Journal Dealing with all Aspects of Plant Biology 148(3): 492-498; doi: 10.1080/11263504.2013.788097
Mujica H, Sanabria M, Mogollon N, Perezo Y (2008) Formación in vitro de bulbo de ajo morado (Allium sativum L.). Revista de la Facultad de Agronomía LUZ 25 (2): 197-210
Murashige T, Skoog F (1962) A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum 15: 473-497
Navarro P (2014) Cultivo in vitro de tejidos vegetales de plantas del género Zephyranthes y evaluación de su producción de alcaloides. Trabajo de grado para optar al pregrado de Química Farmacéutica, Universidad ICESI Facultad de Ciencias Naturales Químicas Farmacéuticas y Universidad de Cali, Cali, Colombia
Paredes K, Delaveau C, Carrasco P, Baeza C, Mora F, Uribe M (2014) In vitro bulbing for the propagation of Traubia modesta (Amaryllidaceae), a threatened plant endemic to Chile. Ciencia e Investigación Agraria 41(2): 207-214
Passos I, Bernacchi L (2005) Cultura de tecidos aplicada a manutenção de germoplasma in vitro e ao melhoramento genético de maracujá (Passiflora spp.) En: Faleiro F, Junqueira N, Braga M (eds) Maracujá: germoplasma e molhoramento genético, pp. 361-383. Embrapa Cerrados, Planaltina DF; ISBN: 85-7075-029-3
Roca W, Mroginsky L (1991) Cultivo de tejidos en agricultura, fundamentos y aplicaciones. Centro Internacional de la Agricultura Tropical (CIAT), Cali; ISBN: 9589183158
Rodrigo J M, Rosselló F J, Marinangeli P A, Curvetto N R (2006) Germinación in vitro de Rhodophiala bifida. En: INTA (ed) Actas del III Congreso Argentino de Floricultura y IIX Jornadas Nacionales de Floricultura, Buenos Aires, 07-10/11/2006, pp. 428-430. INTA, Buenos Aires
Shivakumar G, Krishnamurthy K (2004) In vitro organogenetic responses of Gloriosa superba Russ. Journal of Plant Physiology 51 (5): 713-721; doi: 10.1023/B:RUPP.0000040761.45363.75
Smith R H, Burrows J, Kurten K (1999) Challenges associated with micropropagation of Zephyranthes and Hippeastrum sp. (Amaryllidaceae). In Vitro Cellular & Developmental Biology Plant 35(4): 281-282; doi: 10.1007/s11627-999-0032-y
Zhang W, Song L, da Silva J A T, Sun H (2013) Effects of temperature, plant growth regulators and substrates and changes in carbohydrate content during bulblet formation by twin scale propagation in Hippeastrum vittatum ‘Red lion’. Scientia Horticulturae 160: 230-237; doi: 10.1016/j.scienta.2013.06.001
Recibido: 16-11-2016
Aceptado: 25-01-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
