Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 33 - 39, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Maduración y germinación de embriones somáticos de Sorghum bicolor (L.) Moench cultivar ‘CIAP 132R-05’
Maturation and germination of somatic embryos of Sorghum bicolor (L.) Moench cultivar 'CIAP 132R-05'
Silvio de J Martínez1,2, Rafael Gómez-Kosky3, Raúl Barbón Rodríguez 2, Raúl Collado2, Marta Pérez 2, Novisel Veitia2, Mayelin Rodríguez2
1Centro de Investigaciones Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: silviod@uclv.edu.cu
2Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: silvio@ibp.co.cu
3Estación Territorial de Investigaciones de la Caña de Azúcar (ETICA) centro Villa Clara. Instituto de Investigaciones de la Caña de Azúcar (INICA). Autopista Nacional km 246. Ranchuelo. Villa Clara. Cuba. CP 53100.
RESUMEN
En sorgo [Sorghum bicolor (L.) Moench], los protocolos de regeneración de plantas vía embriogénesis somática desarrollados no incluyen la fase de maduración. El presente trabajo se realizó con el objetivo de lograr la maduración y germinación de embriones somáticos de sorgo en el cultivar ‘CIAP 132R-05’. Se estudiaron cuatro concentraciones de sacarosa (30, 50, 70 y 90 g l-1), dos de ácido abscísico (0.95 y 1.90 µM) y un control sin este regulador del crecimiento. Fueron evaluados el inicio de la germinación (días) y el número de embriones somáticos con germinación completa en tres periodos (1 - 7, 8 -14 y 15 - 21 días de cultivo). Además, se determinó el efecto de 6-BAP (8.9, 17.8 y 26.6 µM) sobre la germinación de los embriones somáticos. Se determinó el tiempo de inicio de la germinación (días) y después de 21 días el número de embriones somáticos con germinación completa y plantas con malformaciones. La adición de 70 g l-1 sacarosa en el medio de cultivo de maduración sin ácido abscísico, incrementó la germinación de los embriones somáticos hasta 37.2 plantas por grupo de embriones (0.5 g de masa fresca). El mayor número de embriones somáticos germinados se obtuvo con 17.78 µM de 6-BAP en el medio de cultivo de germinación. Se demostró la necesidad de una fase de maduración en la embriogénesis somática de sorgo para elevar el porcentaje de germinación.
Palabras clave: embriogénesis somática, sacarosa, sorgo, 6-BAP
ABSTRACT
In sorghum [Sorghum bicolor (L.) Moench], developed protocols for plant regeneration via somatic embryogenesis do not include maturation stage. The present work was carried out with the aim of achieving the maturation and germination of sorghum somatic embryos in cultivar 'CIAP 132R-05'. It were studied four concentrations of sucrose (30, 50, 70 and 90 g l-1), two of abscisic acid (0.95 and 1.90 μM) and a control without this growth regulator. Germination initiation (days) and number of somatic embryos with complete germination were evaluated in three periods (1 - 7, 8 - 14 and 15 - 21 days of culture). In addition, the effect of 6-BAP (8.9, 17.8 and 26.6 μM) on somatic embryo germination was determined. The germination start time (days) and after 21 days the number of somatic embryos with complete germination and plants with malformations were determined. The addition of 70 g l-1 sucrose in the culture medium without abscisic acid increased the germination of the somatic embryos to 37.2 plants per embryo group (0.5 g of fresh mass). The highest number of somatic embryos germinated was obtained with 17.78 μM 6-BAP in the germination culture medium. It was demonstrated the need of a maturation stage in the sorghum somatic embryogenesis to increase the germination percentage.
Keywords: somatic embryogenesis, sorghum, sucrose, 6-BAP
INTRODUCCIÓN
El sorgo es un cultivo de adaptación en zonas tropicales y subtropicales del mundo. Se utiliza como cereal para consumo humano, animal, en la producción de forrajes, fibras, así como para la elaboración de bebidas alcohólicas (Ignacimuthu y Premkuumar, 2014). Esta especie es una poácea oriunda de las regiones tropicales y subtropicales de África (Pola et al., 2009). Su cultivo se ha generalizado, y ocupa el sexto lugar mundial entre los cereales más cultivados, después del trigo (Triticum aestivum L.), maíz (Zea mays L.), arroz (Oryza sativa L.) y la cebada (Hordeum vulgare L.) (Zhao et al., 2010).
La planta de sorgo se adapta a una amplia gama de ambientes y produce granos bajo condiciones desfavorables para la mayoría de los otros cereales. Debido a su resistencia a la sequía, se considera como el cultivo más apto para las regiones áridas con bajas precipitaciones (Pérez et al., 2010).
La producción de sorgo constituye una alternativa para la alimentación animal y humana en Cuba. En la campaña 2015-2016 se sembraron 14 036 ha-1 de las cuales, 1 267.50 ha-1 correspondieron al cultivar 'CIAP 132R-05' con una producción de 2 535 t que representó el 24.49% de la producción total (IIG, 2016). Es un cultivar de ciclo semiprecoz, que permite la rotación con el cultivo del tabaco (Nicotiana tabacum L.) Posee una capacidad media de rebrote y su porte bajo facilita la cosecha manual (porte bajo), además posee altos rendimientos agrícolas en condiciones de secano (2.5 t ha-1) (MINAG, 2005).
Para aplicar la transformación genética como método de mejora genética, es requisito indispensable contar con una metodología eficiente de regeneración de plantas. Mediante embriogénesis somática se han regenerado plantas de sorgo (Zhao et al., 2010; Fernández, 2012; Kumal et al., 2014; Lateefat et al., 2014). Sin embargo, poseen baja eficiencia de formación de callos con estructuras embriogénicas y regeneración de plantas por ser genotipo dependiente, así como la alta excreción de compuestos fenólicos.
La fase de maduración es el período en el cual ocurre la expansión de la célula y la acumulación de sustancias de reserva y se adquiere tolerancia a la deshidratación. Los embriones somáticos experimentan una serie de cambios morfológicos y bioquímicos, entre los que se destacan el equilibrio hormonal, el almacenamiento de sustancias de reserva y la adquisición de la tolerancia a la desecación. La correcta acumulación de reservas conlleva a un incremento en la masa seca de los embriones somáticos, indicativos de una alta calidad en el vigor y germinación (Merkle et al., 1995). Sólo los embriones maduros con una morfología normal que hayan acumulado suficientes materiales de reserva al final de la maduración se desarrollan en plantas normales (von Arnold et al., 2002). Para provocar estos cambios morfológicos y bioquímicos es necesario incrementar la osmolaridad en el medio de cultivo de maduración, lo cual se consigue con una disminución en el potencial hídrico mediante el empleo de agentes osmóticos.
En las metodologías publicadas para la regeneración de plantas vía embriogénesis somática en sorgo, no se informa de la existencia de la fase de maduración. Solo se realizan las fases de formación y germinación de embriones somáticos (Lateefat et al., 2014; Amali et al., 2015).
Dada la problemática anteriormente expuesta y considerando la importancia del cultivo del sorgo para Cuba, se planteó como objetivo lograr la maduración y germinación de embriones somáticos de sorgo en el cultivar ‘CIAP 132R-05’.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon embriones somáticos de sorgo cv. ‘CIAP 132R-05’ obtenidos según el protocolo propuesto por Martínez et al. (2015). Estos se encontraban en medio de cultivo con las sales Murashige y Skoog (1962) (MS) al 100% de su concentración, vitaminas MS, 4.52 µM de ácido 2,4- diclorofenoxiacético (2,4-D), 1.11 µM de 6-bencilaminopurina (6-BAP), 500 mg l-1 de L-prolina y 6 g l-1 agar-E (BIOCEN, Cuba), con 30 días de cultivo.
Maduración y germinación de embriones somáticos
Efecto de la sacarosa y el ABA
El objetivo fue determinar el efecto de la combinación de la sacarosa y el ácido abscísico (ABA) en la maduración de embriones somáticos. Para ello se empleó el medio de cultivo compuesto por las sales y vitaminas MS al 100% con 100 mg l-1 de mio-inositol, 8 g l-1 de agar-E. Se estudiaron cuatro concentraciones de sacarosa (30, 50, 70 y 90 g l-1), dos de ABA (0.95 y 1.90 µM) y un control sin este regulador del crecimiento basado en los estudios realizados por Freire et al. (2006) en caña de azúcar (Saccharum spp.).
Se utilizaron frascos de vidrio de 250 ml de volumen total con 30 ml de medio de cultivo cada uno. Se colocaron cuatro grupos de embriones somáticos (0.5 g de masa fresca cada uno) en etapas avanzadas de desarrollo escutelar y coleptilar.
Para evaluar la maduración después de 21 días de cultivo, los grupos de embriones somáticos se transfirieron al medio de cultivo de germinación compuesto por las sales y vitaminas MS al 100%, sacarosa 30 g l-1, agar-E 6 g l-1 y 6-BAP 17.8 µM basado en estudios previos (datos no mostrados). El estado de maduración de los embriones somáticos, se determinó teniendo en cuenta el inicio de su germinación. Se evaluaron las siguientes variables: inicio de la germinación (días de cultivo) y número de embriones somáticos con germinación completa en tres periodos (1 - 7, 8 -14 y 15 – 21 días de cultivo) y el número de plantas con malformaciones.
Efecto del 6-BAP en la germinación de los embriones somáticos
En este experimento se empleó el medio de cultivo para la fase de maduración con mejores resultados en el experimento anterior, con el objetivo de determinar el efecto de diferentes concentraciones de 6-BAP sobre la germinación de los embriones somáticos.
Se evaluaron tres concentraciones de 6-BAP (8.9, 17.8 y 26.6 µM) en el medio de cultivo compuesto por las sales y vitaminas MS al 100%, agar-E 6 g l-1 y un control sin reguladores de crecimiento. Se utilizaron grupos de embriones somáticos con diferentes etapas de desarrollo que habían permanecido por 21 días en el medio de cultivo de maduración. Se colocaron cuatro grupos de embriones somáticos por frasco de cultivo (0.5 g de masa fresca).
Las variables evaluadas fueron el inicio de la germinación (días de cultivo) y a los 21 días el número de embriones somáticos con germinación completa por grupo de embriones (0.5 g de masa fresca) y número de plantas con malformaciones.
Condiciones de cultivo
La maduración de los embriones somáticos se desarrolló en condiciones de oscuridad constante. Para la germinación se colocaron los frascos de cultivo en una cámara de crecimiento con luz solar, 27±2ºC y un período luminoso de aproximadamente 13/11h de luz/oscuridad con un rango de densidad flujo de fotones fotosintéticos (DFFF) entre 48.0 y 62.5 µmol m-2 s-1, medido con un Luxómetro Extech 401025 (Extech Instruments, EUA).
Análisis estadístico
El diseño experimental empleado fue completamente aleatorizado. Para los análisis estadísticos se utilizó el paquete de programas SPSS para Windows versión 21 del 2012. Para el análisis de la normalidad de las variables se utilizó la prueba de Shapiro Wilk, para la comparación entre las medias se aplicó la alternativa no paramétrica del Análisis de Varianzas, la prueba H de Kruskal Wallis y para la comparación entre parejas de grupos se utilizó la prueba de U de Mann Whitney. En los experimentos se utilizaron como repetición diez frascos de cultivo con cuatro explantes cada uno. Los experimentos fueron repetidos dos veces. En todos los casos las diferencias se establecieron para p≤0.05.
RESULTADOS Y DISCUSIÓN
Maduración y germinación de embriones somáticos
Efecto de la sacarosa y el ABA
A los siete días de cultivo los embriones somáticos colocados en medio de cultivo de maduración con 70 g l-1 de sacarosa y sin ABA (tratamiento 7) alcanzaron el mayor número de embriones somáticos germinados, lo cual fue en incremento hasta los 21 días de cultivo con diferencias significativas con el resto de los tratamientos (Figura 1).
En los embriones somáticos germinados se observó la presencia bien definida de un ápice caulinar y otro radicular. También el desarrollo apical en los embriones somáticos que procedían del tratamiento que contenía 70 g l-1 de sacarosa (tratamientos 7, 8 y 9). A los 15 días de cultivo la totalidad de los embriones somáticos habían desarrollado hojas bien definidas en esta concentración de sacarosa.
En las concentraciones de sacarosa por debajo y por encima de 70 g l-1, fue menor el porcentaje de embriones somáticos con desarrollo caulinar durante la germinación, independientemente de su combinación o no con el ABA. Después de 21 días en el medio de cultivo de germinación no se observaron malformaciones en las plantas obtenidas de los embriones somáticos.

La maduración de los embriones somáticos fue favorecida por la concentración alta de sacarosa (70 g l-1) en el medio de cultivo. Este estímulo está dado por dos efectos, el primero de ellos es que bloquea la germinación precoz de los embriones y el segundo porque resulta ser un excelente proveedor de carbohidratos que son utilizados para el crecimiento del embrión, la respiración y la acumulación de carbohidratos de reserva, según Merkle et al. (1995). Es común la aplicación de altas concentraciones de carbohidratos en los medios de cultivo de maduración, que además de proporcionar una fuente de carbono, actúan como agente osmótico a dichas concentraciones. La sacarosa en el medio de cultivo actúa como fuente de carbono, energía e influye directamente en la acumulación de sustancias de reserva en las vacuolas, las cuales son utilizadas posteriormente durante el proceso de germinación (Iraqi y Tremblay, 2001).
Por otra parte, la adición de ABA durante la fase de maduración del embrión, promueve la acumulación de sustancias de reserva, esto, seguido de un apropiado tiempo de secado, puede lograr un mejor crecimiento y desarrollo de los embriones somáticos y también previene la germinación precoz (Kärkönen, 2001). Sin embargo, es conocido que el ABA también tiene un efecto en la dormancia de los embriones somáticos. Las altas concentraciones de sacarosa en el medio de cultivo provocan la producción y acumulación de ABA endógeno en las células (Schmidt et al., 2005), lo cual pudo ser la causa de los resultados del presente trabajo.
El ABA también es utilizado para lograr la sincronía del proceso de embriogénesis somática y en muchas ocasiones para reducir el proceso de embriogénesis secundaria. Además, inhibe la germinación precoz que ocurre cuando se inicia el proceso de germinación (emisión de raíz, elongación de hipocótilo o síntesis de clorofila) sin que esté fisiológicamente maduro, por lo que normalmente no sobrevive (Rai et al., 2011). Sin embargo, los resultados del presente trabajo indican que la adición de ABA al medio de cultivo de maduración afectó la germinación de los embriones somáticos de sorgo cv. ‘CIAP 132R-05’. En línea con estos resultados González (2014) informó en linaloe [Bursera linanoe (La Llave) Rzed., Calderón & Medina] que el ABA en el medio de cultivo de maduración afectó la regeneración de plantas, indujo la formación de raíces, pero no desarrolló el ápice caulinar.
En la literatura científica no se describe hasta el momento una fase específica de maduración de los embriones somáticos en sorgo. Los autores que han desarrollado la embriogénesis somática en esta especie vegetal, solo hacen mención a la regeneración de plantas (Zarif et al., 2013; Lateefat et al., 2014; Liu et al., 2015).
Existe referencia del desarrollo de la fase de maduración en otras especies vegetales. En una planta monocotiledónea como la caña de azúcar, Freire et al. (2006) estudiaron el efecto de la sacarosa sobre la maduración de embriones somáticos y una concentración de 30 g l-1, solo logró un 30.2% de embriones somáticos germinados. Sin embargo, al elevar la concentración de sacarosa hasta 50 g l-1 en el medio de cultivo de maduración se incrementó el porcentaje de germinación de los embriones somáticos hasta 53.8%. En este estudio con sorgo, al adicionar 30 g l-1 de sacarosa al medio de cultivo solo se lograron 2.2 embriones somáticos germinados en 0.5 g de masa fresca y el aumento en la concentración de sacarosa a 70 g l -1 elevó en 16 veces el número de embriones germinados.
Efecto del 6-BAP en la germinación de los embriones somáticos
Entre los dos y siete días de cultivo, se observó el inicio de la germinación de los embriones somáticos, con la aparición de un brote apical y otro radicular. Este proceso se inició primero en el tratamiento que contenía 17.8 µM de 6-BAP. En todos los tratamientos donde se adicionó 6-BAP se observó la germinación completa de embriones somáticos a los 21 días de cultivo.
Estos resultados pudieran estar relacionados con los niveles endógenos de citoquininas en los embriones somáticos de sorgo, sintetizados a nivel celular durante su desarrollo. No se observaron malformaciones en las plantas de los embriones somáticos germinados. En el control (sin 6-BAP) no germinaron los embriones somáticos, lo cual demuestra la importancia de esta citoquinina en esta fase de la embriogénesis somática. Es conocido que las citoquininas presentan dos tipos de actividades hormonales, la primera en la regulación de la división celular y la segunda actividad en la señalización a larga distancia para regular la formación del brote. Además, intervienen fisiológicamente en los procesos dependientes del nitrógeno (Merkle et al., 1995)
El mayor número de embriones somáticos germinados (37.6 plantas por grupo de embriones somáticos) se obtuvieron con la concentración 17.8 µM de 6-BAP, en el medio de cultivo de germinación, con diferencias significativas con respecto al resto de los tratamientos. Es de destacar que ni el aumento, ni la disminución de la concentración de 6-BAP incrementaron el número total de embriones germinados tomando en cuenta los resultados del experimento anterior. En todos los tratamientos la mayoría de los embriones somáticos germinaron entre los 8 y 15 días de cultivo (Figura 2). Las concentraciones de 6-BAP en el medio de cultivo han variado en los diferentes protocolos de regeneración de plantas de sorgo vía embriogénesis somática. Los valores están en el rango de 8.88 hasta 13.32 µM de 6-BAP dependiendo del genotipo, con número de plantas entre los 2.25 hasta 24.0 (Zhao et al., 2010; Raghuwanshi y Birch, 2010; Zarif et al., 2013; Lateefat et al., 2014). Al respecto Amali et al. (2014) refieren en el cultivar 'M35-1', una alta regeneración de plantas con 21.4 plantas por callo con estructuras embriogénicas, mientras Lateefat et al. (2014) en el mutante de sorgo rojo 'Karandafi' lograron 18.0 plantas por callo.
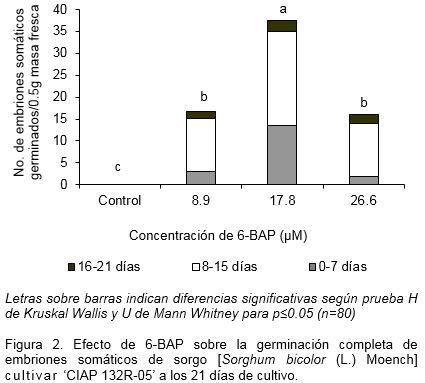
La regeneración de plantas de los diferentes protocolos referidos en la literatura científica fueron inferiores a las del presente trabajo, lo cual podría ser debido a que estos no incluyen una fase de maduración, sino que directamente los callos con embriones somáticos se colocan en medio de cultivo de germinación. Los protocolos publicados de regeneración de plantas vía embriogénesis somática establecidas para esta especie, describen la transferencia del callo a un medio de cultivo de regeneración de plantas con 30 g de sacarosa, donde ocurren las fases de formación, maduración y germinación de los embriones somáticos (Zhao et al., 2010; Lateefat et al., 2014; Amali et al., 2014).
CONCLUSIONES
Se logró la maduración y germinación de los embriones somáticos de sorgo cultivar 'CIAP 132R-05'. La inclusión de la fase de maduración en la embriogénesis somática de sorgo incrementó la germinación de los embriones somáticos.
REFERENCIAS
Amali P, Kingsley SJ, Ignacimuthu S (2014) Enhanced plant regeneration involving somatic embryogenesis from shoot tip explants of Sorghum bicolor (L. Moench). Asian Journal of Plant Science and Research 4 (3):26-34
Fernández R (2012) Sistema de regeneración in vitro de híbridos venezolanos de sorgo granífero [Sorghum bicolor (L.) Moench]. Revista Científica UDO Agrícola 2(2):253-266
Freire M, Gómez R, Herrera I, Reyes M (2006) Formación de callos y establecimiento de suspensiones celulares embriogénicas en caña de azúcar a partir de segmentos de hojas de plantas in vitro. Biotecnología Vegetal 6(1):51-57
González M (2014) Maduración y germinación de embriones somáticos de Lináloe in y ex vitro.Tesis presentada para el requisito de optar por el título de Maestra en Ciencias. Colegio de Postgraduados, Montecillo, México
Instituto de Investigaciones de Granos (IIG) (2016) Informe anual sobre las producción de granos. Ministerio de la Agricultura, La Habana
Ignacimuthu S, Premkumar A (2014) Development of transgenic Sorghum bicolor (L.) eMoench resistant to the Chilo partellus (Swinhoe) through Agrobacterium-mediated transformation. Mol Biol Gnet Eng 2(1): 1-8; doi: 10.7243/2053-5767-2-1
Iraqi D, Tremblay FM (2001) The role of sucrose during maturation of black spruce (Picea mariana (Mill.) BSP) and white spruce (Picea glauca (Moench) Voss) somatic embryos. Physiol Plant 111(3):381-388
Kärkönen A (2001) Plant tissue cultures as models for tree physiology: somatic embryogenesis of Tilia cordata and lignin biosynthesis in Picea abies suspension cultures as case studies. Espoo, Helsinky; ISBN: 952-10-0271-9
Kumal S, Mahmoud M, Abbas B, Hussein E (2014) Evaluation of somatic embryogenesis and regeneration in tissue culture of ten sorghum (Soghum bicolor L.) genotipes. African Journal Biotechnology 13(36):3673-3681; doi: 10.5897/AJB2014.13924
Lateefat BH, Inuwa SU, Katung MD, Bugaje SM (2014) Optimum Protocol for Shoot Formation in karandafi Red Sorghum (Sorghum bicolor (L.) Moench) through Somatic Embryogenesis Using Mature Embryo. American Journal of Plant Sciences 5 (5):671-675; doi: 10.4236/ajps.2014.55081
Merkle SA, Parrott WA, Flinn BS (1995) Morphogenic aspects of somatic embryogenesis (Chapter 5). En: TA Thorpe (ed) In vitro Embryogenesis in Plant, pp. 155-204. Kluwer Academic Publishers, Dordrecht; doi: 10.1007/978-94-011-0485-2
Liu G, Gilding E, Godwin (2015) A robust tissue culture system for sorghum [Sorghum bicolor (L.) Moench]. South African Journal of Botany 98:157-160; doi: 10.1016/j.sajb.2015.03.179
Martínez SM, Collado RL, Barbón RR, Rodríguez M, Pérez M, Tejeda M, Rojas L, Daniels D, Roque B, Torres D, Maroto LO, Vitlloch AL, Gómez-Kosky R (2015) Novel explant for somatic embryogenesis in Sorghum bicolor (L.) Mohen. Biotecnología vegetal 15(3):163-175
MINAG (2005) Registro de Variedades Comerciales. Dirección de Semillas, Ministerio de la Agricultura, La Habana
Murashige T, Skoog R (1962) A revised medium for rapid growth and bio-assay with tobacco tissue culture. Physiologia Plantarum 15: 473-497
Pérez A, Saucedo O, Iglesias J, Wencomo H, Reyes F, Oquendo G, Milán I (2010) Caracterización y potencialidades del grano de sorgo (Sorghum bicolor (L.)Moench.) Pastos y Forrajes 33 (1):1-17
Pola S, Sarada MN, Ramana T (2009) Mature embryos as source material for efficient regeneration response in sorghum (Sorghum bicolor L. Moench). Sjemenartvo 26: 93-104
Raghuwanshi A, Birch RG (2010) Genetic transformation of sweet sorghum. Plant Cell Reports 29 (9): 997-1005; doi: 10.1007/s00299-010-0885-x
Rai MK, Shekhawat NS, Harish S, Gupta AK, Phulwaria M, Ram K, Jaiwal U (2011) The role of abscisic acid in plnt tissue culture: a review of recent progress. Plant Cell Tiss Organ Cult 106(2):179-190; doi: 10.1007/s11240-011-9923-9
Rooney WL, Blumenthal J, Bean B, Mollet JE (2007) Designing sorghum as a dedicated bioenergy feedstock. Biofuels, Bioprod and Bioref 11 (1):147-157; doi: 10.1002/bbb.15
Schmidt MA, Tucker DM, Cahoon EB, Parrott WA (2005) Towards normalization of soybean somatic embryo maturation. Plant Cell Rep 24:383-391; doi: 10.1007/s00299-005-050-z
von Arnold S, Sabala I, Bozhkov P, Dyachok J, Filonova L (2002) Developmental pathways of somatic embryogenesis. Plant Cell Tiss Organ Cult 69 (3):233-249; doi: 10.1023/A:1015673200621
Zarif M, Sadia B, Kainth RA y Ahmad I (2013) Genotypes, explants and growth hormones influence the morphogenesis in Pakistani sorghum (Sorghum bicolor): preliminary field evaluation of sorghum somaclones. Int J Agric Biol 15(6):1157–1162
Zhao L, Liu S, Song S (2010) Optimization of callus induction and plant regeneration from germinating seeds of sweet sorghum (Sorghum bicolor L. Moench). African Journal of Biotechnology 9 (16):2367-2374
Recibido: 15-11-2016
Aceptado: 24-01-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
