Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 51 - 56, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del uso combinado de citoquininas en la formación de yemas adventicias en banano cv. ‘Gros Michel’ (Musa AAA)
Effect of the cytokinins combination on adventitious buds formation in banana cv. 'Gros Michel' (Musa AAA)
Idalmis Bermúdez-Caraballoso1, Mayelín Rodríguez Urquiza1, Alejandro Jiménez Padrón2
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: idalmis@ibp.co.cu
2Facultad de Ciencias Agropecuarias, Departamento de Licenciatura en Biología, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
RESUMEN
Las citoquininas se emplean para la formación de yemas adventicias pero altas concentraciones pueden tener efectos negativos en la regeneración de plantas. El objetivo de la presente investigación fue determinar el efecto de diferentes combinaciones de citoquininas en la formación de yemas adventicias de banano ‘Gros Michel (Musa AAA). Se estudiaron diferentes concentraciones de 6- Bencilaminopurina (2.0, 4.0 y 6.0 mg l-1) y de Tidiazuron (0.6, 0.8, 1.0 mg l-1) para lograr la formación de dichas estructuras. Como controles se emplearon 22.5 mg l-1 de 6-BAP y 2.0 mg l-1 de TDZ, ampliamente empleados para estos fines en este cultivo. El tratamiento con 2.0 mg l-1 de 6-BAP + 1.0 mg l-1 de TDZ fue el que logró mayor porcentaje de formación de yemas adventicias, con el 80% de los explantes, con resultados muy superiores a los alcanzados por los controles y demás combinaciones estudiadas. Con este tratamiento se logró como promedio 2.72 de yemas adventicias por explante con 1.24 de brotes por explante a los 60 días de cultivo. Por lo antes planteado se seleccionó esta combinación de citoquininas para la formación de yemas adventicias, ya que se logró disminuir los niveles de 6-BAP y de TDZ que tienen efectos negativos en la posterior regeneración de las plantas.
Palabras clave: bananos, 6- Bencilaminopurina, Tidiazuron
ABSTRACT
Cytokinins are used for adventitious buds formation but high concentrations may have negative effects on plant regeneration. The aim of the present investigation was to determine the effect of different combinations of cytokinins on the induction of adventitious buds of cultivar ‘Gros Michel’ (Musa AAA). Different concentrations of 6-Benzylaminopurine (2.0, 4.0 and 6.0 mg l-1) and Thidiazuron (0.6, 0.8, 1.0 mg l-1) were studied to achieve the formation of these structures. As controls, 22.5 mg l-1 6-BAP and 2.0 mg l-1 TDZ, widely used for these purposes in this culture, were used. The treatment with 2.0 mg l-1 6-BAP + 1.0 mg l-1 TDZ was the one that achieved the highest percentage of adventitious buds formation, with 80% of the explants, with results much higher than those achieved by the controls and other combinations studied. With this treatment, an average of 2.72 adventitious buds per explant was obtained with the least number of shoots per explant (1.24) at 60 days of culture. For this reason, this combination of cytokinins was selected for the formation of adventitious buds in banana cv. 'Gros Michel', as it was possible to decrease the levels of 6-BAP and TDZ that have negative effects on the subsequent plants regeneration.
Keywords: bananas, 6- Benzylaminopurine, Thidiazuron
INTRODUCCIÓN
Los plátanos y bananos (Musa spp.) proporcionan a millones de personas en todas las zonas tropicales y subtropicales alimentos de primera necesidad y una de las frutas que más se exportan (Ngomuo et al., 2014). Debido a los bajos rendimientos y a la susceptibilidad a las enfermedades, principalmente a la Sigatoka negra (Mycosphaerella fijiensis Morelet) y al Mal de Panamá (Fusarium oxysporum f. sp. cubense), se hace necesaria la búsqueda de nuevos cultivares para su introducción a la producción. El mejoramiento genético en el género Musa mediante métodos tradicionales se ha visto obstaculizado por varios factores, entre ellos la baja fertilidad, la esterilidad, los niveles de ploidía y la falta de variabilidad genética que muestran sus especies (Huang et al., 2010), además del tiempo que se necesita para obtener cultivares mejorados por esta vía.
El empleo del cultivo de tejidos para los programas de mejoramiento genético constituye una herramienta de gran potencial, pero se hace necesario disponer de un sistema eficiente y repetible de regeneración de plantas (Roux, 2004). El uso de yemas adventicias para estos fines en Musa spp. ha sido informado por varios autores (Nahamya, 2000; García et al., 2006; Sadik et al., 2007) ya que la variabilidad puede incrementarse.
De los reguladores del crecimiento, 6-Bencilaminopurina (6-BAP) tiene un marcado efecto en la formación y multiplicación de yemas axilares y adventicias en los cultivos in vitro (Abeyaratne y Lathiff, 2002; Buah et al., 2010).
Sin embargo, el tidiazuron (TDZ) al ser más activo a bajas concentraciones que 6-BAP y ser menos susceptible a las enzimas degradantes presentes en las plantas, permitió el desarrollo de yemas múltiples en el cultivar ‘Grande naine’ (AAA) (García et al., 2006). Se ha informado que el TDZ, puede ser muy activo en la regulación de la morfogénesis en muchas especies de plantas (Sunagawa et al., 2007).
Los resultados referidos en la literatura especializada sobre plátanos y bananos, indican que la inducción del proceso embriogénico continúa perfeccionándose también con el uso de otros reguladores del crecimiento como el TDZ, a diferencia de los medios de cultivo en los que se emplean altas concentraciones de 6-BAP (Suprasanna et al., 2002, INIBAP, 2003). Sin embargo, según Sadik et al. (2007) el uso de estas altas concentraciones de 6-BAP y TDZ, tiene entre sus desventajas la variación somaclonal y el decrecimiento de la respuesta embriogénica del explante. En este sentido, hay numerosos informes que muestran las deficiencias del uso de altos niveles de citoquininas que producen anormalidad y se afecta la estabilidad genética de las plantas (Martin et al., 2006; Shirani et al., 2009; Najmeh et al., 2011). Por todo lo antes expuesto se hace necesario determinar el efecto de diferentes combinaciones de citoquininas en la formación de yemas adventicias en banano cultivar ‘Gros Michel’ (Musa AAA).
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron ápices de plantas crecidas en campo del cultivar ‘Gros Michel’, obtenidos de hijos tipo espada con una altura aproximada de 50 a 100 cm de altura que fueron establecidos in vitro de acuerdo con la metodología propuesta por Orellana (1995).
Se utilizaron tubos de ensayo con 10 ml de medio de cultivo líquido compuesto por sales y vitaminas MS (Murashige y Skoog, 1962) al 100% y ácido indol acético (AIA) (0.23 mg l-1), 6-BAP (4 mg l-1), sacarosa (30 g l-1), mio-inositol (100 mg l-1) y pH 5.7. Como soporte se colocó papel de filtro en forma de m. El pH se ajustó, con el uso del HCl o NaOH, a 5.8 previo a la esterilización de los medios de cultivo. Esta se realizó en autoclave vertical a 121 ºC y una presión de 1.2 kg cm-2, durante 20 minutos.
Efecto de diferentes combinaciones de 6-BAP y TDZ
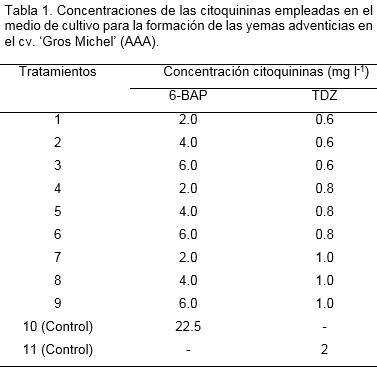
Con el objetivo de determinar la influencia de 6-BAP y TDZ en la formación de yemas adventicias, se colocaron brotes seccionados de 0.4 mm2 provenientes de la fase de establecimiento in vitro. Se empleó el medio de cultivo de multiplicación de brotes, constituido por las sales y vitaminas MS al 100%, sacarosa (30 g l-1), ácido ascórbico (10 mg l-1), AIA (0.2 mg l-1), pH 5.7 y Gelrite (MERCK) (2.0 g l-1) con diferentes concentraciones de las citoquininas estudiadas (Tabla 1). Como controles se emplearon los medios de cultivo P4 (Tratamientos 10) compuesto por Sales y vitaminas MS, sacarosa (30 g l-1), mio-inositol (100 mg l-1), ácido ascórbico (10 mg l-1), AIA (0.17 mg l-1), 6-BAP (22.5 mg l-1), pH 5.8 y se utilizó Phytagel® (SIGMA) 2.2 g l-1 como agente gelificante, según Schoofs et al. (1998). En el tratamiento 11, se empleó el medio de cultivo compuesto por Sales y vitaminas MS, sacarosa (30 g l-1), mio-inositol (100 mg l-1), ácido ascórbico (10 mg l-1), AIA (0.17 mg l-1), TDZ (2 mg l-1), pH 5.8 y se utilizó Phytagel® (SIGMA) 2.2 g l-1 como agente gelificante, según Nahamya (2000).
En este trabajo se nombraron yemas adventicias a las estructuras globosas, de color blanquecino, de 1.0 a 3.0 mm de longitud, que se desarrollaban en la superficie del explante.
Los subcultivos se realizaron cada 30 días de cultivo. Se cuantificó el número de explantes por frasco de cultivo que formaron yemas adventicias y se calculó el porcentaje. Además, se cuantificó el número de yemas adventicias y de brotes por explante. Se colocaron cinco explantes por frasco y se utilizaron cinco frascos por tratamiento. El segundo subcultivo se realizó solamente en los medios de cultivo que contenían las citoquininas que estimularon el desarrollo de las yemas adventicias. Las condiciones de cultivo del material vegetal fueron a 27±2ºC en cámaras de cultivo de luz solar con una densidad de flujo de fotones fotosintéticos que osciló entre 48.0-62.5 µ mol m-2s-1.
Análisis estadístico
El diseño experimental empleado fue completamente aleatorizado. El procesamiento estadístico de los datos experimentales se realizó con la ayuda del Paquete estadístico Statistic Packaged for Social Science (SPSS) versión 18.0 para Windows (Microsoft ®). Se utilizó la prueba H de Kruskal Wallis y la U de Mann Whitney, al no cumplirse los supuestos de normalidad y homogeneidad de varianza para los datos. Se empleó un nivel de significación de p≤0.05.
RESULTADOS Y DISCUSIÓN
Al analizar el porcentaje de explantes que formaron yemas adventicias se pudo apreciar que en todas las combinaciones de las citoquininas estudiadas (6-BAP y TDZ) se observó formación de dichas estructuras a los 60 días de cultivo (segundo subcultivo). En el tratamiento siete donde se empleó 2.0 mg l-1 de 6-BAP + 1.0 mg l-1 de TDZ, se obtuvo el mayor porcentaje, con el 80% de los explantes con formación de yemas adventicias. Estos resultados fueron superiores a los alcanzados en los controles y demás combinaciones estudiadas (Fig. 1).

Nahamya (2000) logró una alta proliferación de yemas adventicias con formación de domos meristemáticos en varios cultivares de bananos (Musa AAA) del este de África al emplear el TDZ a una concentración de 2.0 mg l-1 y 30 mg l-1 de 6-BAP, respectivamente. Así mismo, Arinaitwe et al. (2000) refirieron un incremento en la proliferación de yemas adventicias cuando se incrementó la concentración de TDZ de 0.02 mg l-1 a 3.35 mg l-1. Estos autores atribuyeron la alta actividad citoquinínica del TDZ, a su capacidad de acumular en el cultivo de tejidos altos niveles endógenos de dicho regulador del crecimiento. Sin embargo, en el presente trabajo fue posible disminuir las concentraciones de 6-BAP y TDZ sin afectarse la formación de yemas adventicias, incluso con resultados superiores al combinar ambas citoquininas.
Los mejores resultados con respecto al número de yemas adventicias por explante se alcanzaron en el tratamiento con 2.0 mg l-1 de 6-BAP + 1.0 mg l-1 de TDZ, con diferencias significativas con los controles donde se emplearon 22.5 mg l-1 de 6-BAP y 2.0 mg l-1 de TDZ. Con este tratamiento se obtuvieron como promedio 2.72 yemas adventicias por explante con 1.24 de brotes por explante a los 60 días de cultivo (Tabla 2 y Fig. 2). Por ello, se seleccionó este como el mejor tratamiento para la formación de yemas adventicias en banano cv. ‘Gros Michel’.
Al respecto, Gubbuk y Pekmzci (2004) y Makara et al. (2010) plantearon que concentraciones altas de citoquininas en el medio de cultivo aumentan la proliferación de yemas múltiples, pero se afecta la posterior elongación de los brotes.


Resultados similares a los alcanzados en la presente investigación fueron referidos por Sadik et al. (2007) quienes demostraron que al combinar TDZ y 6-BAP en menor concentración, lograron obtener las yemas adventicias en los cultivares ‘Musakala’ (Musa AAA), ‘Kibuzi’ (Musa AAA), ‘Mbwazirume’ (Musa AAA), ‘Lwadungu’ (Musa AAA). El efecto combinado de las dos citoquininas en el medio de cultivo parece haber influido en la asimilación de estos reguladores del crecimiento por los tejidos vegetales, que probablemente causó un efecto aditivo, lo cual estimuló la multiplicación de las yemas adventicias.
CONCLUSIONES
Se logró la formación de yemas adventicias en el cultivar de banano ‘Gros Michel’ (Musa AAA) al emplear de manera combinada 6-BAP y TDZ a menores concentraciones que las que tradicionalmente se utilizan.
REFERENCIAS
Abeyaratne W, Lathiff M (2002) In vitro propagation of 'Rathambala' (Musa AAA) and the occurrence of phenotypic variations in the pseudostem. Annals of the Sri Lanka Department of Agriculture (LKA) 4: 191-197
Arinaitwe G, Rubaihayo PR, Magambo MJS (2000) Proliferation rate effect of citokinins on banana (Musa spp.) cultivars. Sci Horticul 86(1):13-21
Buah J, Danso E, Taah K, Abole E, Bediako E, Asiedu J, Baidoo R (2010) The effects of different concentration cytokinins on the in vitro multiplication of plantain (Musa spp.). Biotechnology 9(3): 343-347; doi: 10.3923/biotech.2010.343.347
García LR, Pérez JP, Bermúdez-Caraballoso I, Orellana P, Veitía N, García L, Padrón Y, Romero C (2006) Nuevo protocolo para la rápida inducción de yemas adventicias y la regeneración de plantas en banano cv. ‘Grande naine’ (Musa AAA). Biotecnología Vegetal 6(1): 15-21
Gubbuk H, Pekmezci M (2004) In vitro propagation of some new banana types (Musa spp). Turkish Journal of Agricultural and Forestry 28 (5): 355-361
Huang X, Lu XY, Zhao JT, Chen JK, Dai XM, Xiao W, Chen YP, Chen YF, Huang XL (2010) MaSERK1 gene expression associated with somatic embryogenic competence and disease resistance response in banana (Musa spp.). Plant Mol Biol 28 (2):309-316; doi: 10.1007/s111050090150
INIBAP (2003) Networking Banana and Plantain: INIBAB Annual Report 2002.Biversity international, Montpellier
Makara AM, Rubaihayo PR, Magambo MJS (2010) Carry-over effect of Thidiazuron on banana in vitro proliferation at different culture cycles and light incubation conditions. African Journal of Biotechnology 9(21):3079-3085
Martin K, Pachathundikandi S, Zhang C, Slater A, Madassery J (2006) RAPD analysis of a variant of banana (Musa sp.) cv. ‘Grande naine’ and its propagation via shoot tip culture. In Vitro Cell Dev Biol Plant 42(2): 188-192; doi: 10.1079/IVP2005736
Murashige T, Skoog R (1962) A revised medium for rapid growth and bio-assay with tobacco tissue culture. Physiologia Plantarum 15:473-497
Nahamya P (2000) Development of embryogenic cell suspensions for East African highland bananas. Tesis para optar por el Grado Académico de Master en Ciencias, Makerere University Kampala, Kampala, Uganda
Najmeh J, Yasmin OR, Norzulaani K (2011) Effect of benzylaminopurine (BAP) pulsing on in vitro shoot multiplication of Musa acuminata (banana) cv. ‘Berangan’. African Journal of Biotechnology 10 (13): 2446-2450; doi: 10.5897/AJB1001149
Ngomuo M, Mneney E, Ndakidemi PA (2014) The in vitro propagation techniques for producing banana using shoot tip cultures. American Journal of Plant Sciences 5: 1614-1622; doi: 10.4236/ajps2014.511175
Orellana P (1995) Tecnología para la micropropagación in vitro de clones de Musa spp. Tesis para aspirar por el grado científico de Doctor en Ciencias Agrícolas, UCLV, Santa Clara, Cuba
Roux NS (2004) Mutation induction in Musa-Review. En: Jain SM, Swennen R (eds) Banana improvement: cellular, molecular biology, and induced mutations, pp. 23-32. Science, Enfield; ISBN: 1-57808-340-0
Sadik K, Rubaihayo P, Magambo M, Pillay M (2007) Generation of cell suspensions of East African highland bananas through scalps. African Journal of Biotechnology 6(11): 1352-1357
Shirani S, Mahdavi F, Maziah M (2009) Morphological abnormality among regenerated shoots of banana and plantain (Musa spp.) after in vitro multiplication with TDZ and BAP from excised shoot tips. African Journal of Biotechnology 8(21): 5755-5761
Sunagawa S, Sakae A, Makiko U, Yuko M, Akihiro N (2007) Effect of urea-type cytokinins on the adventitious shoots regeneration from cotyledonary node explant in the common ice plant, Mesembryanthemum crystallinum. Plant Production Science 10 (1): 47-56; doi: 10.1626/pps.10.47
Suprasanna P, Sági L, Swennen R (2002) Positive selectable marker genes for routine plant transformation. In Vitro Cellular and Dev Biology Plant 38(2): 25-128; doi: 10.1079/IVP2001272
Schoofs H, Panis B, Swennen R (1998) Competence of scalps for somatic embryogenesis in Musa. Acta Hortic 490 (1): 475-483
Recibido: 12-10-2016
Aceptado: 07-12-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
