Artículo original
Biotecnología Vegetal Vol. 17, No. 1: 57 - 65, enero - marzo, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Respuesta de diferentes líneas y cultivares de arroz sometidos a bajas temperaturas en condiciones controladas
Response of different lines and cultivars of rice subjected to low temperatures under controlled conditions
Sandra H Díaz Solís1, Fernando Pérez de Vida2, Juan Rosas Caissiols3, Rogelio Morejón Rivera1
1Departamento de Mejoramiento Genético de Arroz, Unidad Científico Tecnológica de Base Los Palacios. Carretera La Francia km 1½. Los Palacios. Pinar del Río. Cuba. CP 24440.
e-mail: shdiaz@inca.edu.cu
2Departamento de Mejoramiento Genético de Arroz, INIA Treinta y tres - Estación Experimental del Este. Ruta 8 km 281 CC42. Treinta y Tres. Treinta y Tres. Uruguay. CP 33000.
3Laboratorio de Biotecnología, INIA Treinta y tres - Estación Experimental del Este. Ruta 8 km 281 CC42. Treinta y Tres. Treinta y Tres. Uruguay. CP 33000.
RESUMEN
El arroz (Oryza sativa L.) es el cultivo alimentario más importante del mundo y fuente primaria de alimentos para más de un tercio de la población mundial. Las bajas temperaturas están entre los principales estreses abióticos que afectan los rendimientos de este cereal. Este trabajo tuvo como objetivo determinar la respuesta de diferentes líneas y cultivares de arroz en estado de plántula, al estrés por bajas temperaturas en condiciones controladas. Se estudiaron 172 líneas y cultivares que fueron sometidos a 5 0C durante 24 horas, cuando las plántulas tenían de tres a cuatro hojas. Las evaluaciones se realizaron mediante medición de la fluorescencia clorofílica y escala visual. Se obtuvo un amplio rango de respuestas, lo cual indicó una gran diversidad alélica para la sensibilidad a las bajas temperaturas en el germoplasma estudiado. Un grupo de 30 cultivares respondió de manera más favorable al frío y los más destacados resultaron tener valores Fv/Fm entre 0.80 y 0.89. Se encontró una relación significativa entre la evaluación visual y la fluorescencia clorofílica. El coeficiente de correlación reveló una relación moderadamente fuerte entre ambas variables. Los materiales vegetales tolerantes se identificaron de modo más consistente. En cambio, la dispersión entre métodos se incrementó hacia los de mayor susceptibilidad.
Palabras clave: evaluación visual, fluorescencia clorofílica, Oryza sativa, tolerancia a frío
ABSTRACT
Rice (Oryza sativa L.) is the most important food crop in the world and primary source of food for more than a third of the population. The low temperatures are among the main abiotic stresses that affect the yield of this cereal. The objective of this work was to determinate the response of different lines and cultivars of rice in seedling state to low temperature stress under controlled conditions. 172 lines and cultivars were studied. It were subjected to 5 0C for 24 hours, when the plants were about three to four leaves. The evaluations were conducted by measured of chlorophyll fluorescence and visually. A wide range of response was obtained, which indicated a high allelic diversity for the low temperatures sensitivity in the studied germplasm. A group of 30 cultivars responded more favorably to the cold and the most prominent cultivars showed Fv/Fm values between 0.80 and 0.89. A significant relationship between visual evaluation and chlorophyll fluorescence was found. The correlation coefficient revealed a moderately strong relationship between both variables. Tolerant plant materials were more consistently identified. However, the dispersion between methods increased to more susceptible cultivars.
Keywords: cold tolerance, chlorophyll fluorescence, Oryza sativa, visual evaluation
INTRODUCCIÓN
El arroz (Oryza sativa L.) es el alimento básico de la mitad de la población humana. A diferencia de otros cereales como el trigo (Triticum aestivum L.) y la cebada (Hordeum vulgare L.), las plantas de arroz son sensibles al estrés por bajas temperaturas, lo cual a menudo se traduce en disminución de la productividad, especialmente en las regiones donde se cultiva la subespecie índica por tener mayor sensibilidad. Este factor abiótico puede tener impactos negativos sobre las plantas de arroz durante la germinación, el crecimiento vegetativo, así como en etapas reproductivas con reducción de hasta un 25% de la producción final (Clayton y Neves, 2011; Lima et al., 2012; Pereira da Cruz et al., 2013).
En general, los síntomas visibles provocados por temperaturas adversas durante el estado vegetativo del cultivo son baja germinación, clorosis de las hojas, retraso o detención del desarrollo, reducción de la capacidad de formar macollas y hasta muerte de plantas (Kim y Tai, 2011; Yang y Zhang, 2012; Zhang et al., 2014).
Los estudios de la tolerancia a bajas temperaturas en los programas de mejoramiento genético generalmente se basan en evaluaciones visuales en condiciones de campo. Estas llevan más tiempo y resultan azarosas porque depende de que se manifiesten las condiciones ambientales apropiadas. Según Andaya y Mackill (2003) este tipo de evaluación está sujeta a la interacción genotipo/ambiente y a variaciones diarias a lo largo de la temporada de cultivo y a través de los años, esto torna el proceso lento, ineficiente y sujeto a la ocurrencia de condiciones ambientales aptas para el tamizado. En particular, la intensidad del tratamiento de bajas temperaturas empleado, la duración de la exposición y la evaluación de la recuperación son importantes para una estimación efectiva de la tolerancia a bajas temperaturas (Lou et al., 2007), lo que puede predecirse y ajustarse solamente si se trabaja en condiciones controladas.
Por tanto, la selección de materiales vegetales tolerantes a las bajas temperaturas, en condiciones de laboratorio, en la fase de germinación y durante el establecimiento de las plántulas resulta ventajosa pues generalmente se corresponde con la respuesta en la etapa reproductiva cuando se evalúa en condiciones de campo (Castillo y Alvarado, 2002; Ye et al., 2009).
El estudio de la respuesta de cultivares a bajas temperaturas, en la fase vegetativa del desarrollo, permite hacer progresos desde el punto de vista genético para fortalecer los procesos de establecimiento y rápido crecimiento del cultivo (Deambrosi et al., 1997), pues la tolerancia en esta fase podría contribuir significativamente al permitir siembras más tempranas y/o enfrentar períodos con bajas temperaturas.
En este sentido, se han desarrollado numerosas metodologías para la determinación de la tolerancia a bajas temperaturas en estado de plántula, y la utilización de escalas de evaluación visual representa una gran ventaja práctica en evaluaciones que involucran un gran número de materiales vegetales (Pachecoy, 2011). Asimismo, en investigaciones sobre el tema se ha usado el análisis de la fluorescencia clorofílica. Estos han demostrado alteraciones estructurales y funcionales en el aparato fotosintético de plantas sometidas a tratamientos de bajas temperaturas (Kim et al., 2009; Lee et al., 2009a; Lee et al., 2009b; Bonnecarrere et al., 2011; Saad et al., 2012).
En los últimos años, debido al incremento de la inestabilidad climática, se ha venido trabajando aceleradamente en la obtención de materiales vegetales con tolerancia a estrés abiótico y como resultado del trabajo de mejora genética se han obtenido un grupo de cultivares y líneas de arroz para las condiciones de bajas temperaturas que sería interesante evaluarlos combinando algunas de las metodologías informadas. Teniendo en cuenta la problemática enunciada, esta investigación tuvo como objetivo determinar la respuesta de diferentes líneas y cultivares de arroz, en estado de plántula, al estrés por bajas temperaturas bajo condiciones controladas.
MATERIALES Y MÉTODOS
El trabajo se desarrolló en el Laboratorio de Biotecnología de la Estación Experimental del Este perteneciente al Instituto Nacional de Investigación Agropecuaria (INIA Treinta y Tres) de Uruguay.
Material vegetal
Se emplearon semillas de 172 materiales vegetales de arroz de los tipos índicas y japónicas que incluyeron líneas experimentales avanzadas del Programa de Mejoramiento Genético de Arroz de INIA Treinta y Tres (164), cultivares cubanos (6), y los cultivares controles ‘INIA Tacuarí’ (tolerante) e ‘INIA Olimar’ (susceptible) (Tabla 1).

Evaluación de la respuesta al estrés por bajas temperaturas
Para la evaluación de la tolerancia a bajas temperaturas se utilizó la metodología desarrollada por Cruz (2004) en el Fondo Latinoamericano de Arroz de Riego (FLAR).
De cada material vegetal se evaluaron 10 plántulas. Estas fueron obtenidas a partir de semillas, que se sembraron en almacigueras de 46 x 70 cm, con 294 alvéolos de 2.5 x 2.5 x 7.0 cm. Por cada alvéolo se sembró una semilla, con una distancia de siembra de aproximadamente 3 cm entre cada una.
Se empleó suelo de tipo planosol subeútrico proveniente de la Unidad Experimental Villa Sara. Una vez germinadas las semillas, las plántulas se mantuvieron en invernáculo, donde recibieron riegos diarios, en un régimen de temperaturas que varió entre 18 °C (mínima nocturna) y 28 °C (máxima diurna) y la humedad ambiente se mantuvo entre 65 y 80%, a excepción de las horas de tratamiento con bajas temperaturas.
Cuando las plántulas alcanzaron de tres a cuatro hojas fueron sometidas a 5 0C durante 24 horas en cámara de crecimiento (KOIKA con doble compartimiento y control independiente de temperatura), alternando horas diurnas y nocturnas y disponiendo de luz solar.
Posteriormente, se determinó la fluorescencia clorofílica del tejido foliar (Pérez de Vida et al., 2009) con el uso de un fluorímetro (FMSI Hansatech Fluorometer, King´s Lynn Instrument Ltd., King´s Lynn, UK). Esta variable se midió a los 30 minutos posteriores al tratamiento y se verificó que las plantas no tuvieran otro factor de estrés (desecamiento, exceso de calor) ya que constituye una evidente fuente de variación indeseable en el experimento. El indicador utilizado fue el cociente de fluorescencia variable/fluorescencia máxima (Fv/Fm), donde Fv=Fm-F0, donde Fm: valor máximo de la fluorescencia y F0: valor mínimo de la fluorescencia.
Además, en el invernáculo a los siete días posteriores al tratamiento se determinó visualmente el grado de clorosis y necrosis en las hojas, y el retardo del crecimiento. Para ello se utilizó la escala visual de severidad de síntomas descrita en el Sistema de Evaluación Estándar para Arroz (IRRI, 1996), con grados del 1 (tolerante) al 9 (susceptible) (Tabla 2). Tanto la fluorescencia clorofílica como la evaluación visual se realizaron sobre tres repeticiones del experimento.

Análisis estadístico
Para el análisis de los datos se utilizó el Programa Estadístico MINITAB, versión 5.0 con el cual se realizó un análisis de regresión lineal para las variables fluorescencia clorofílica y evaluación visual (variable dependiente) con una evaluación del modelo.
RESULTADOS Y DISCUSIÓN
En la evaluación de los 172 materiales vegetales (líneas y cultivares) se obtuvo un amplio rango de respuesta, lo cual indicó una gran diversidad alélica para la tolerancia a bajas temperaturas en el germoplasma estudiado. En este caso, considerando ambas variables (evaluación visual y fluorescencia clorofílica), del material vegetal evaluado un grupo de 30 (Tabla 3) mostró la mejor respuesta o consistencia en su tolerancia. En ese grupo se encuentran líneas con valores superiores al control tolerante utilizado (‘INIA Tacuarí’). Se destacan las líneas experimentales L6329 y L6399 de adecuada respuesta también en fase reproductiva (Pérez de Vida y Díaz, 2010).

El método usado fue efectivo para determinar la tolerancia en aquellos materiales vegetales donde no se conocía la respuesta y se confirmó por el método empleado en aquellos que habían mostrado tolerancia en otros estudios similares.
Las pérdidas debido al estrés por bajas temperaturas dependen precisamente de la temperatura, del período de exposición y de la etapa de desarrollo en la cual se encuentre la planta. En este sentido, el banco de germoplasma del Centro Internacional de Agricultura Tropical-Fondo Latinoamericano de Arroz de Riego posee materiales de arroz tolerantes a bajas temperaturas en estado de plántula, algunos combinan esta tolerancia con la de germinación y muy pocos son tolerantes en los tres estados (Cruz, 2013). Ello sugiere la necesidad de continuar las evaluaciones de los cultivares con buena respuesta en este estudio en la etapa reproductiva por ser el estadio reproductivo el más susceptible frente a un estrés de baja temperatura y donde ocurren los mayores daños.
En otras investigaciones se observó que la diferencia en la respuesta a bajas temperaturas entre cultivares de tipo índica y de tipo japónica era muy marcada. En cambio, se manifestaron respuestas contrastantes dentro del grupo de líneas provenientes de cruzamientos japónica x índica; así mismo algunas líneas de respuesta más extrema que los controles, lo que atribuyen a la existencia de una amplia variabilidad para la tolerancia a frío en fase de plántula (Pachecoy, 2011). Los resultados de este trabajo de manera general coinciden con lo informado al resultar más tolerantes los cultivares de tipo japónica, mostrando algunos de ellos mejor respuesta que el control tolerante. Sin embargo en este caso no hay en esa población materiales vegetales provenientes de cruzamientos entre ambos grupos.
Diversos factores físicos o químicos de estrés ambiental como temperaturas bajas afectan la función del fotosistema II de manera directa o indirecta, lo cual modifica la emisión de la fluorescencia. Por ello, los cambios en la emisión de la fluorescencia, pueden utilizarse para revelar mecanismos de respuesta y la cuantificación de respuestas al estrés. En la mayoría de los casos, la relación Fv/Fm se utiliza para evaluar la sensibilidad o tolerancia a frío, ya que indica la máxima eficiencia fotoquímica de fotosistema II. En el presente estudio los materiales vegetales en los cuales se observó una mejor tolerancia al frío mostraron valores de Fv/Fm entre 0.80 y 0.89. En concordancia con lo anterior, Pérez de Vida et al. (2009) informaron que estos valores son similares a los esperados en plantas en ausencia de estrés.
En este sentido, los resultados coinciden con los obtenidos en un ensayo similar a este estudio donde se evaluó la tolerancia al frío de 109 líneas experimentales en estado de plántula (utilizando variables morfológicas y fisiológicas). Los autores encontraron que el 86.5% de los materiales vegetales evaluados fueron tolerantes al frío, 10.8% intermedios y 2.7% susceptibles. Además, constataron que el tratamiento de frío resultó en mortalidad para el control susceptible y muy poco daño en el control tolerante. Las líneas analizados mostraron valores de Fv/Fm entre 0.40 y 0.86, y el 87.3% de ellos valores mayores que 0.80 (Donoso et al., 2015).
Entre los cultivares con menor tolerancia se encontró ‘INIA Olimar’ (control susceptible) y los cultivares ‘FL-04540’, ‘FL-005090’ y ‘FL-005307’. De forma general, el mayor porcentaje de los cultivares de origen FLAR (70.21%), alcanzaron valores iguales o mayores a siete en la evaluación visual. Asimismo, solo tres de ellos lograron valores de fluorescencia superiores a 0.80 (‘FL-04489-12M-1P-6M’, ‘FL-04534-5M-8P-4M-3P-M’ y ‘FL-4518-7M-33P-5M-2P-M’), lo que sugiere cierto grado de tolerancia según esta técnica. Se conoce que manteniendo la hoja (o planta entera) en la oscuridad se da un nivel mínimo (F0). Al recibir luz saturante (FA), F alcanza un valor máximo (Fm). La altura relativa de este pico es indicador de la integridad del sistema fotosintético. En hojas sanas es mayor y baja sustancialmente según el grado de daño por estreses abióticos como las bajas temperaturas. En hojas mantenidas en oscuridad, esta emisión es la primera reacción detectada en fracción de segundos posterior a la irradiación con luz saturante (FA) y es alternativa a la canalización de la energía de saturación de electrones como energía fotoquímica o disipación de calor. Estos procesos ocurren a continuación lo cual se refleja en el descenso inmediato de la emisión de fluorescencia (Pérez de Vida et al., 2009).
Por otra parte, el cultivar ‘C-289’ (Koshihikari/INIA Tacuarí) mostró valores de fluorescencia superiores a 0.80; mientras que en la evaluación visual, una semana después del tratamiento, alcanzó 6.5 en la escala del 1 al 9. El cultivar tolerante chileno ‘Quilla’, presentó un valor de fluorescencia Fv/Fm inferior a 0.80.
Las diferencias en ordenamiento de los cultivares entre métodos estaría indicando que ambos proveen información diferente y complementaria. Con la evaluación visual se obtiene una estimación de la capacidad de recuperación de las plantas a eventos de estrés. Por otra parte, se ha constatado que algunos cultivares más susceptibles tienden a mantener su sistema fotosintético con relativa integridad (valores Fv/Fm entre 0.6 y 0.8) post tratamiento de frío. Sin embargo, expresan un efecto residual o adicional posterior a esa determinación de modo que expresan síntomas de clorosis y detenimiento en crecimiento, resultantes en altos valores de escala visual (Pérez de Vida et al., 2009).
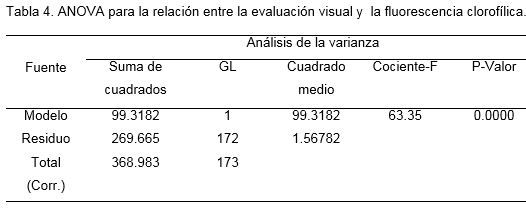
La figura 1 muestra los resultados del ajuste al modelo lineal para describir la relación entre la evaluación visual y la fluorescencia.
La ecuación del modelo ajustado fue: evaluación visual = 11.95 - 8.171*Fluorescencia. Dado que el p-valor en la tabla del ANOVA (Tabla 4) fue inferior a 0.01, existió relación significativa entre evaluación visual y la fluorescencia clorofílica para un nivel de confianza del 99%. El R2 indicó que el modelo explicó un 24.5% de la variabilidad en la evaluación visual y el coeficiente de correlación reveló una relación moderadamente fuerte entre las variables, donde valores superiores de fluorescencia se asocian a valores bajos en la escala visual.
La comparación de la evaluación visual realizada en el presente trabajo, con otras variables fisiológicas asociadas a la respuesta del arroz a las bajas temperaturas, ha sido realizada también por Kim y Tai (2011), quienes igualmente lograron identificar cultivares que superaron al control tolerante.

Los materiales vegetales tolerantes se identificaron de modo más consistentes (Figura 1). En cambio, la dispersión entre métodos se incrementó hacia cultivares de mayor susceptibilidad. En general, la evaluación mediante fluorescencia clorofílica resultó menos variable (CV=11.79%) respecto a la evaluación visual (CV=25.14%). Resultados similares se obtuvieron en trabajos de este tipo realizados por Pérez de Vida el al. (2009).
En la figura 2 se representa la respuesta de los cultivares utilizados como controles. En el cultivar ‘INIA Tacuarí’ (control tolerante), los valores estuvieron más concentrados, mientras que en el cultivar ‘INIA Olimar’ (control susceptible) resultaron más dispersos. Este resultado pudo deberse a variaciones en la evaluación de la fluorescencia clorofílica en este cultivar susceptible.

Se considera que ambos métodos de valoración de la tolerancia aportan información sobre procesos diferentes afectados por las bajas temperaturas en esta fase del estado vegetativo (plántula). Según Pérez de Vida el al. (2009), la evaluación visual a los siete días del tratamiento con bajas temperaturas constituye una estimación de efectos residuales y de una relativa capacidad de recuperación frente al estrés. Asimismo, estos autores plantean que esta respuesta diferencial puede deberse a varias causas que conducen a la fotoinhibición causada por frío como por ejemplo: daño oxidativo por transferencia excesiva de energía al oxígeno, energía que no se canaliza como energía fotoquímica por baja demanda (esta baja demanda se debe a la no activación de enzimas relacionadas a la asimilación de CO2), menor capacidad de reparación del PSII (disminución de la síntesis de D1; destrucción de enzimas del fotosistema; inhibición de la formación de zeaxantina y anteraxantina (pigmentos fotosintéticos), compuestos encargados de la disipación del exceso de energía como calor. En general se reconoce al material vegetal índica como menos tolerante (Pereira da Cruz et al., 2013), y se ha identificado que presentan contenidos inferiores de la proteína D1 del fotosistema II.
CONCLUSIONES
A partir de la evaluación visual y de la fluorescencia clorofílica, se lograron identificar materiales vegetales de arroz tolerantes a bajas temperaturas en condiciones controladas. Los resultados demostraron que la aplicación de estos métodos constituye una ventaja ya que permiten la selección temprana de tolerancia al factor abiótico estudiado.
AGRADECIMIENTOS
Al Programa de Biotecnología para América Latina y el Caribe de la Universidad de las Naciones Unidas (UNU-BIOLAC) por apoyar la pasantía que permitió la realización de este estudio. A los técnicos y especialistas del Programa de Mejora Genética de Arroz de la Estación Experimental del Este, perteneciente al Instituto Nacional de Investigación Agropecuaria (INIA Treinta y Tres) de Uruguay, que me acogieron con cariño y contribuyeron al éxito del presente trabajo.
REFERENCIAS
Andaya VC, Mackill, DJ (2003) Mapping of QTL associated with cold tolerance during the vegetative stage in rice. Journal of Experimental Botany (54): 2579–2585
Bonnecarrere V, Borsanib P, Iazb D, Capdeviellea F, Blanco P, Monza J (2011) Response to photoxidative stress induced by cold in japonica rice is genotype dependent. Plant Sci (180): 726–732
Castillo D, Alvarado JR (2002) Caracterización de germoplasma de arroz para tolerancia a frío en la etapa de germinación. Agricultura Técnica 62 (4): 596-605
Clayton S, Neves PC (2011) Country snapshot: Brazil. Rice Today (10): 16–17
Cruz M (2013) Tolerancia al frío en arroz: evaluación de germoplasma en condiciones controladas, validación en campo y producción de poblaciones mejoradas. Tesis para obtener el título de Doctor en Ciencias Agrarias con Énfasis en Fitomejoramiento, Universidad Nacional de Colombia, Palmira, Colombia
Cruz M (2004) Metodologías para evaluación de la tolerancia al frío en las etapas de germinación y floración del arroz (Oryza sativa L.) y estudio genético del estrés producido por el frío en la etapa de germinación. Tesis de Maestría. Universidad del Valle Facultad de Ciencias, Cali, Colombia
Deambrosi E, Méndez R, Roel A (1997) Estrategia en la producción de arroz para un mejor aprovechamiento de las principales variables climáticas, Serie Técnica 89. INIA Treinta y Tres, Uruguay
Donoso G, Cabas P, Paredes M, Becerra V, Balzarini M (2015) Cold tolerance evaluation of temperate rice (Oryza sativa L. ssp. japonica) genotypes at seedling stage. Gayana Bot 72 (1): 01-13; doi: 10.4067/S0717-66432015000100001
International Rice Research Institute (IRRI) (1996) Standard Evaluation System for Rice. The International Network for Genetic Evaluation of Rice (INGER) The International Rice Testing Program (IRTP), Philippines
Kim SJ, Lee SC, Hong SK, An K, An G, Kim SR (2009) Ectopic expression of a cold-responsive OsAsr1 cDNA gives enhanced cold tolerance in transgenic rice plants. Mol. Cells 27 (4):449–458; doi: 10.1007/s10059-009-0055-6
Kim SI, Tai TH (2011) Evaluation of seedling cold tolerance in rice cultivars: a comparison of visual ratings and quantitative indicators of physiological changes. Euphytica 178(3):437-447; doi: 10.1007/s10681-010-0343-4
Lee, DG, Ahsan N, Lee SH, Lee JJ, Bahk JD, Kang KY (2009a) Chilling stress-induced proteomic changes in rice roots. J Plant Physiol 166 (1): 1–11; doi: 10.1016/j.jplph.2008.02.001
Lee SC, Kwon SY, Kim SR (2009b) Ectopic expression of a cold-responsive Cu/Zn superoxide dismutase gene, SodCc1, in transgenic rice (Oryza sativa L.). J Plant Biol 52(2): 154–160; doi: 10.1007/s12374-009-9017-y
Lima MG, Lopes NF, Zimmer PD, Meneghello GE, Mendes CR, Amarante L (2012) Enzyme expression in indica and japonica rice cultivars under saline stress. Acta Sci Biol Sci 34(4): 473–481; doi: 10.4025/ actascibiolsci.v34i4.8535
Lou Q, Chen L, Sun Z, Xing Y, Li J, Xu X, Mei H, Luo A (2007) Major QTL associated with cold tolerance at seedling stage in rice (Oryza sativa L.). Euphytica 158(1): 87–94; doi: 10.1007/s10681-007-9431-5
Pachecoy MI (2011) Tolerancia a frío en estadios tempranos del desarrollo en arroz: caracterización fenotípica de germoplasma de origen diverso y variación alélica en genes candidatos. Trabajo de Tesis para optar al Título de MAGISTER SCIENTIAE en Producción Vegetal. Facultad De Ciencias Agraria Universidad Nacional de Mar del Plata. Balcarce, Argentina
Pereira da Cruz R, Sperotto RA, Cargnelutti D, Adamski JM, Terra TF, Fett JP (2013) Avoiding damage and achieving cold tolerance in rice plants. Food and Energy Security 2 (2): 96–119; doi: 10.1002/fes3.25
Pérez de Vida F, Díaz S (2010) Respuesta a bajas temperaturas en estadios reproductivos de cultivares de arroz. En: INIA (ed) Resultados Experimentales 2009-2010, Ecofisiología del cultivo del arroz, pp. 24-27. INIA Treinta y Tres Estación Experimental del Este, Uruguay
Pérez de Vida F, Bonnecarrère V, Rosas JE, López A, Ramírez D, Barrios A (2009) Respuesta a bajas temperaturas en estadios vegetativos de cultivares elite y avanzados del Programa de mejoramiento Genético de INIA. En: INIA (ed) Resultados Experimentales 2008-2009, Mejoramiento Genético, pp. 8-12. INIA Treinta y Tres Estación Experimental del Este, Uruguay
Saad BR, Fabre D, Mieulet D, Meynard D, Dingkuhn M, Al-Doss A (2012) Expression of the Aeluropus littoralis AlSAP gene in rice confers broad tolerance to abiotic stresses through maintenance of photosynthesis. Plant Cell Environ 35(3): 626–643; doi: 10.1111/j.1365-3040.2011.02441.x
Yang A, Dai X, Zhang WH (2012) A R2R3-type MYB gene, OsMYB2, is involved in salt, cold, and dehydration tolerance in rice. J Exp Bot 63 (7): 2541–2556; doi: 10.1093/jxb/err431
Ye H, Du H, Tang N, Li X Xiong L (2009) Identification and expression profiling analysis of TIFY family genes involved in stress and phytohormone responses in rice. Plant Mol Biol 71(3): 291–305; doi: 10.1007/s11103-009-9524-8
Zhang Qi, Qiuhong C, Shaoling W, Yahui H, Zhilong W (2014) Rice and cold stress: methods for its evaluation and summary of cold tolerance-related quantitative trait loci. Rice 7(1): 24; doi: 10.1186/s12284-014-0024-3
Recibido: 07-10-2016
Aceptado: 11-11-2016
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
