Artículo original
Biotecnología Vegetal Vol. 17, No. 2: 105 - 112, abril - junio, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto del CO2 en la germinación de embriones somáticos de Coffea arabica L. cv. ‘Caturra rojo’ y Clematis tangutica K.
Influence of the CO2 on the germination of somatic embryos of Coffea arabica L. cv. 'Caturra rojo' and Clematis tangutica K.
Raúl Barbon1, Walter Preil2, Alina Capote1, Elio Jiménez1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
e-mail: raulb@ibp.co.cu
2Private address. Birkenhöhe 28. Ammersbek. Germany. 22949.
RESUMEN
El ambiente in vitro es un factor que en los últimos años se ha comenzado a investigar, debido a que los gases como el oxígeno, dióxido de carbono y el etileno juegan un papel importante en la morfogénesis de los embriones somáticos y su desarrollo en plantas. El objetivo de este trabajo fue determinar el efecto del CO2 en la germinación de embriones somáticos cafeto (Coffea arabica L. cv. ‘Caturra rojo’) y clematis (Clematis tangutica K.). Se emplearon tres mezclas de gases compuesta por concentraciones de CO2 (2.5, 5.0 y 10.0%) combinada con 21% O2 y dos controles (intercambio pasivo y ventilación forzada). Se obtuvo un efecto positivo del CO2 sobre la germinación de los embriones somáticos en etapa de torpedo en cafeto y clematis, porque en los tratamientos con intercambio pasivo, donde hubo acumulación de CO2, la germinación de los embriones somáticos fue superior a los tratamientos con ventilación forzada. Con 2.5% y 5.0% de CO2 se estimula el proceso de germinación, mientras que con 10.0% de CO2 se produce una inhibición de la germinación con la aparición de malformaciones e hiperhidricidad.
Palabras clave: atmósfera gaseosa, dióxido de carbono, embriogénesis somática, embriogénesis secundaria, hiperhidricidad
ABSTRACT
The in vitro environment is a factor that in recent years has begun to investigate, because gases such as oxygen, carbon dioxide and ethylene play an important role in the morphogenesis of somatic embryos and their development in plants. The objective of this work was to determine the effect of the CO2 on the germination of coffee somatic embryos (Coffea arabica L. cv. 'Caturra rojo') and clematis (Clematis tangutica K.). Three gas mixtures composed of CO2 concentrations (2.5, 5.0 and 10.0%) combined with 21% O2 and two controls (passive exchange and forced ventilation) were used. A positive effect of CO2 on the germination of somatic embryos in the torpedo stage in coffee and clematis was obtained, because in the treatments with passive exchange, where there was CO2 accumulation, germination of the somatic embryos was superior to the treatments with Forced ventilation. With 2.5% and 5.0% CO2, the germination process is stimulated while with 10.0% CO2 there is an inhibition of germination with the appearance of malformations and hyperhydricity.
Keywords: gaseous atmosphere, carbon dioxide, somatic embryogenesis, secondary embryogenesis, hyperhydricity
INTRODUCCIÓN
La regeneración de plantas vía embriogénesis somática a partir de suspensiones celulares es considerada como el método más eficiente para la producción masiva de plantas, dado por la naturaleza misma del proceso embriogénico. Este consiste en la formación de un embrión viable a partir de células aisladas con lo cual se logran altos coeficientes de multiplicación y permite manejar grandes cantidades de propágulos en volúmenes reducidos de medio de cultivo (Etienne et al., 2016).
El ambiente gaseoso en los frascos de cultivo en los diferentes sistemas de micropropagación se caracterizan por una humedad relativa alta y variaciones en la concentración de O2, CO2, acumulación de etileno y otras sustancias tóxicas (Zavattieri et al., 2010; Kaur, 2015). El ambiente in vitro es un factor que en los últimos años se ha comenzado a investigar, dado que los componentes como el CO2 y el etileno juegan un papel importante en la morfogénesis de los embriones somáticos (Meskaoui et al., 2006; Vilchez et al., 2016).
Algunas investigaciones se han realizado sobre el efecto de diferentes componentes del ambiente in vitro como son oxígeno y dióxido de carbono en el desarrollo morfogenético de los embriones somáticos (Hohe et al., 1999; de Feria et al., 2003; Huang et al., 2006; Barbón et al., 2008) y otros gases como el etileno (Meskaoui et al., 2006). Sin embargo, una fase crucial dentro de la embriogénesis somática es la de germinación, donde un embrión somático en etapa avanzada de desarrollo convierte en una planta. Aún es poco conocida la influencia del ambiente in vitro, en específico de la concentración de CO2, sobre la germinación de los embriones somáticos y su desarrollo en plantas. Es por ello que el objetivo de este trabajo fue determinar el efecto del CO2 en la germinación de embriones somáticos de dos especies de plantas.
MATERIALES Y MÉTODOS
Material vegetal
Esta investigación se realizó con embriones somáticos de Coffea arabica L. cv. ‘Caturra rojo’ y Clematis tangutica K. en etapa de torpedo. Los embriones somáticos fueron obtenidos a partir de la metodología propuesta por Barbón et al. (2003).
Influencia de la concentración de CO2 del ambiente in vitro sobre la germinación de embriones somáticos
Para evaluar la influencia de la concentración de CO2 en el ambiente in vitro sobre la germinación de los embriones somáticos, se emplearon tres mezclas de gases con CO2 (2.5, 5.0 y 10.0%) combinadas con 21% de oxígeno y dos controles (intercambio pasivo y ventilación forzada). Los frascos de cultivo fueron modificados para mantener las concentraciones de dióxido de carbono y oxígeno constantes en el tiempo (Figura 1).

A partir de una suspensión celular embriogénica con 56 días de cultivo en fase de formación y diferenciación de embriones somáticos fueron seleccionados embriones somáticos en etapa de torpedo. De cada especie en estudio, se colocaron 15 embriones somáticos por frasco de cultivo. Se empleó un total de seis frascos por cultivo por tratamiento y el experimento fue repetido dos veces (n=180 por tratamiento). Los medios de cultivo utilizados fueron los empleados para germinación de embriones somáticos. Para Clematis se utilizó un medio de cultivo en estado semisólido compuesto por las sales Gamborg et al. (1968), 0.1 mg l-1 de ácido naftalenacético (ANA), 0.2 mg l-1 de 6-Bencilaminopurina (6-BAP) y 1% de sacarosa. Para cafeto se empleó un medio de cultivo compuesto por las sales de Murashige y Skoog (1962), 0.23 mg l-1 6-BAP y 1% de sacarosa. El pH de los medios de cultivo fue ajustado a 5.7 con NaOH (0.5 N) y HCl (0.5 N) antes de la esterilización en autoclave, a 121oC y 1.2 kg cm-2, durante 20 minutos.
En esta experiencia se evaluaron las siguientes variables cada 15 días durante los 60 días de cultivo:
Número de embriones somático germinados por frasco de cultivo.
Número de embriones somáticos con embriogénesis somática secundaria asociada.
Número de embriones somáticos viables por frasco, se consideró aquellos embriones somáticos germinados y los que no germinaron pero tenían vitalidad celular, la cual fue determinada mediante el método de tinción con Diacetato de Fluoresceína (FDA) (Widholm, 1972).
Embriones somáticos con malformaciones, se refiere la cuantificación de los embriones somáticos que no poseen el aspecto morfológico típico durante la transición de la etapa torpedo a embrión germinado.
Embriones somáticos con hiperhidricidad.
Análisis estadísticos
Los datos experimentales se procesaron estadísticamente mediante un análisis de homogeneidad de varianza mediante la prueba de Bartlett y las medias fueron comparadas empleando la prueba de rangos múltiples de Bonferroni. Para la variable número de embriones malformados se modificaron los datos mediante la transformación arcosen x1/2. El programa estadístico empleado fue SAS GLM (SAS Institute Inc., Cary, NC, USA).
RESULTADOS Y DISCUSIÓN
En cafeto el mayor porcentaje de germinación de los embriones somáticos se obtuvo en los tratamientos con 2.5 y 5.0% de CO2, con respecto a los otros tratamientos (Tabla 1). Debe destacarse que estos mostraban a los 15 días de cultivo un 12.0% (10.83 ES) y 9.0% (10.16 ES) de los embriones somáticos con un desarrollo de las hojas cotiledonales y del hipocótilo. En el tratamiento con intercambio pasivo los resultados fueron superiores al tratamiento con ventilación forzada.

En todos los tratamientos el número de embriones viables fueron altos, excepto en el tratamiento con 10.0% de CO2 (Tabla 2). Durante la fase de germinación, los embriones somáticos presentaron embriones somáticos secundarios asociados. El mayor porcentaje se obtuvo en la variante con 5.0% de CO2 en la mezcla gaseosa mientras que con ventilación forzada la embriogénesis somática secundaria se observó en forma de grupos, al parecer debido a la multiplicación repetitiva de los proembriones formados asociados al embrión somático en desarrollo. La embriogénesis secundaria es una de las causas de la asincronía durante la embriogénesis somática, embriones somáticos de novo pueden formarse a partir del eje principal del embrión somático o en la zona donde previamente se encontraba el suspensor durante las etapas iniciales de histodiferenciación (Gavich et al., 1992) y esto pudiera ser debido a que existe una inducción de la división de las células embriogénicas que podrían haber quedado latentes en la protodermis del embrión o del suspensor (Vondráková et al., 2015).

El desarrollo de malformaciones en los embriones somáticos se manifestó principalmente en el tratamiento con 10.0% de CO2 en la mezcla gaseosa (Tabla 3). Estos embriones somáticos presentaban un crecimiento anormal, formación de callo en la superficie del embrión y en algunos casos se observaron algunas afectaciones morfológicas como son la deformación de las primeras hojas cotiledonales o fusión de estas. Muy relacionada con las malformaciones estuvo la hiperhidricidad de los embriones somáticos bajo el efecto de la ventilación forzada, donde el 30.6% (4.6 ES) presentaban síntomas de hiperhidricidad (Figura 2 A). Sin embargo, esto no fue observado en las variantes donde se empleó CO2.
En los diferentes tratamientos con CO2 y control, las primeras señales de la germinación de los embriones somáticos lo constituyen la elongación del hipocótilo, desarrollo del color verde de los cotiledones y la elongación de la radícula. Estas son características propias de embriones somáticos maduros (Von Aderkas et al., 2015). Sólo los embriones somáticos con una morfología normal que hayan acumulado suficientes materiales de almacenamiento al final de la maduración se desarrollan en plantas (von Arnold y Clapham, 2008).

Todas las plantas in vitro obtenidas a partir de los embriones somáticos germinados bajo el efecto de las diferentes concentraciones de CO2 alcanzaron un desarrollo normal, incluso con la variante con 10.0% (Figura 2 B).

De acuerdo con los resultados obtenidos, es posible que con modificaciones del ambiente físico en los vasos de cultivo se alcance una optimización de la maduración de los embriones somáticos. Ochatt y Revilla (2016) han hecho mayor énfasis en la importancia de tratamientos para la postmaduración de los embriones somáticos, pues en algunas especies cuando estos se han transferido directamente de las condiciones de maduración a germinación, los resultados no han sido favorables.
El mayor número de embriones somáticos germinados de Clematis tangutica se obtuvo con la variante con 5.0% de CO2 en la mezcla gaseosa (Tabla 4). En el control con intercambio pasivo hubo una mayor estimulación de la germinación con respecto a la variante con ventilación forzada. Kvaalen y von Arnold (1991) describen la germinación y maduración de embriones somáticos de Picea abies (L.) Karst a bajas concentraciones de oxígeno (5.0% O2) y altas de dióxido de carbono (6.0% CO2). Sin embargo, no todas las especies responden positivamente a concentraciones superiores de 5.0% de CO2. Estudios realizados por Bewley et al. (2013) encontraron que concentraciones de CO2 superiores a 4.0% CO2 pueden impedir la germinación de algunas especies como Capsella bursa-pastoris (L.) Medic.
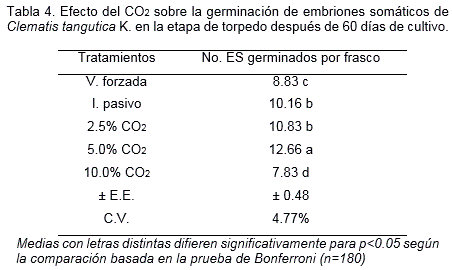
Los valores de número de embriones viables, al igual que en cafeto, fueron altos (Tabla 5) y se apreció la formación de embriones somáticos secundarios. El mayor porcentaje de embriogénesis secundaria se observó en los tratamientos con 2.5% y 5.0% de CO2 con 21.06% (3.16 ES) y 28.86% (4.33 ES), respectivamente.

En el tratamiento con 10.0% de CO2 en la mezcla gaseosa el 16.66% de los embriones poseían malformaciones (Tabla 6), mientras que entre los otros tratamientos no se presentaron diferencias significativas. En estos se observó un bajo porcentaje de malformaciones de los embriones en germinación (Figura 3 A). Sin embargo, en el tratamiento con ventilación forzada el 6.66% (1.0 ES) de los embriones somáticos presentaron malformaciones y además hubo un 18.86% (2.83 ES) de embriones somáticos con hiperhidricidad (Figura 3 B). Resultados similares fueron obtenidos en cafeto en este mismo tratamiento.
Los embriones somáticos en etapa de torpedo que lograron la germinación completa bajo las diferentes concentraciones gaseosas alcanzaron un desarrollo normal, sin observarse variaciones morfológicas (Figura 3 C).


De acuerdo con los resultados, el CO2 influyó en la maduración y germinación de los embriones somáticos. Esto se puede evidenciar al comparar el control con intercambio pasivo, en el cual hay acumulación de CO2, con respecto al control con ventilación forzada. Según Maximova et al. (2014) una consecuencia de la insuficiente maduración de los embriones somáticos, el desarrollo de embriones malformados y la formación de hojas cotiledonales muy carnosas o con pecíolo enroscado, se debe a la poca atención y control del ambiente gaseoso in vitro.
Es posible que altas concentraciones de CO2 (10.0%) promovieran un incremento de los niveles endógenos de etileno, lo cual estimuló las oxidasas del ácido indolacético (AIA) y provocó que los niveles de esta hormona disminuyeran, mientras que los niveles de citoquininas se mantuvieron altos. Estos cambios conducen a un desbalance hormonal que trae como consecuencia una incorrecta diferenciación celular y por lo tanto la malformación y la hiperhidratación de los embriones somáticos (Nowak et al., 2015).
Es conocido el etileno produce una rápido y completa inhibición del movimiento lateral del ácido indolacético endógeno (Rêgo et al., 2012). Este podría causar reacondicionamientos en las concentraciones inducidas de AIA en el tejido lo cual conduce a un decremento de AIA en los sitios de regeneración y cambios en los niveles citoquininas-auxina que son desfavorables para la regeneración (Khan et al., 2015).
Al realizarse un análisis de los resultados sobre la influencia del CO2 en la germinación de embriones somáticos de cafeto y Clematis se puede plantear que el CO2; componente del ambiente in vitro, tiene un efecto sobre la germinación de los embriones somáticos. Un control del ambiente in vitro podría contribuir no solo mejorar la eficiencia de la embriogénesis somática sino también a mejorar la calidad de planta in vitro para una mejor supervivencia ex vitro. Se ha determinado que componentes de la atmósfera gaseosa como el CO2 tienen efecto no solo en la formación y de los embriones somáticos (Barbón et al., 2008; Barbón et al., 2016) sino también en los cambios morfogenéticos que ocurren durante culminación de la germinación con el desarrollo y crecimiento de la planta.
CONCLUSIONES
El CO2 en concentraciones de 2.5% y 5.0% en el ambiente in vitro de los frascos estimula el proceso de germinación de embriones de cafeto y clematis en etapa de torpedo, sin embargo, 10.0% de CO2 inhibe la germinación con la aparición de malformaciones e hiperhidricidad.
AGRADECIMIENTOS
Al Sistema de Intercambio Académico Alemán (DAAD) y al Prof. Dr. Walter Preil que contribuyeron a la realización de esta investigación.
REFERENCIAS
Barbón R, Jiménez E, Capote A (2003) Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv. Robusta. Biotecnología Vegetal 3(3): 131-135
Barbón R, Jiménez E, Preil W (2008) Influence of in vitro environment on somatic embryogenesis of Coffea arabica L. cv. Caturra rojo: the effects of carbon dioxide on embryogenic cell suspensions. Plant Cell, Tissue and Organ Culture 95(2): 155-161; doi:10.1007/s11240-008-9427-4
Barbón R, Preil W, Capote A, Jiménez E (2016) Efecto del CO2 sobre el desarrollo de embriones somáticos de Coffea arabica L. cv. ‘Caturra rojo’ y Clematis tangutica K. Biotecnología Vegetal 16 (3): 153 - 160
Bewley JD, Bradford KJ, Hilhorst HWM, Nonogaki H (2013) Germination. En: Bewley JD, Bradford KJ, Hilhorst HWM, Nonogaki H (eds). Physiology of development, germination and dormancy, pp. 133–181. Springer, New York; doi:10.1007/978-1-4614-4693-4_4
de Feria M, Jiménez E, Barbón R, Capote A, Chávez M, Quiala E (2003) Effect of dissolved oxygen concentration on differentiation of somatic embryos of Coffea arabica cv. Catimor 9722. Plant Cell, Tissue and Organ Culture 72(1) 1-6; doi:10.1023/A: 1021202305692
Etienne H, Bertrand B, Dechamp E, Maurel P, Georget F, Guyot R, Breitler JC (2016) Are genetics and epigenetic instabilities of plant embryogenic cells a fatality? The experience of coffee somatic embryogenesis. Human Genetics and Embryology 6(136): 5; doi:10.4172/2161-0436.1000136
Gamborg OL, Miller RA, Ojima K (1968) Plant cell cultures. 1. Nutrients requirements of suspension cultures of soybean root cells. Exp Cell Res 50(1): 151-158; doi:10.1016/0014-4827(68)90403-5
Gavich H, Vardi A, Fluhr R (1992) Suppression of somatic embryogenesis in citrus cell cultures by extracellular proteins. Planta 186 (4): 511-517; doi:10.1007/BF00198030
Hohe A, Winkelmann T, Schwenkel HG (1999) CO2 accumulation in bioreactors suspension cultures of Cyclamen persicum Mill. and its effect on cell growth and regeneration of somatic embryos. Plant Cell Reports 18(10): 863-867; doi:10.1007/s002990050675
Huang SY, Chan HS, Wang TT (2006) Induction of somatic embryos of celery by control of gaseous compositions and other physical conditions. Plant Growth Regulation 49(2): 219–227; doi:10.1007/s10725-006-9113-7
Khan N, Ahmed M, Hafiz I, Abbasi N, Ejaz S, Anjum M (2015) Optimizing the concentrations of plant growth regulators for in vitro shoot cultures, callus induction and shoot regeneration from calluses of grapes. OENO One 49(1): 37-45; doi:10.20870/oeno-one.2015.49.1.95
Kaur RP (2015) Photoautotrophic micropropagation an emerging new vista in micropropagation-A review. Agricultural Reviews 36(3): 198-207; doi:10.5958/0976-0741.2015.00023.9
Kvaalen H, von Arnold S (1991) Effects of various partial pressures of oxygen and carbon dioxide on different stages of somatic embryogenesis in Picea abies. Plant Cell an Organ Culture 27(1): 49-57; doi:10.1007/BF00048206
Maximova SN, Florez S, Shen X, Niemenak N, Zhang Y, Curtis W, Guiltinan MJ (2014) Genome-wide analysis reveals divergent patterns of gene expression during zygotic and somatic embryo maturation of Theobroma cacao L., the chocolate tree. BMC plant biology 14(1): 185; doi:10.1186/1471-2229-14-185
Meskaoui AE, Desjardins Y, Tremblay FM (2006) The effects of in vitro gaseous environment on the maturation of somatic embryo of black spruce (Picea mariana [Mill.] BSP) and white spruce (Picea glauca [Moench] Voss). Moroccan Journal of Biology 1(2-3): 12-20
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum 15: 473-497; doi:10.1111/j.1399-3054.1962.tb08052
Nowak K, Wójcikowska B, Gaj MD (2015) ERF022 impacts the induction of somatic embryogenesis in Arabidopsis through the ethylene-related pathway. Planta 241(4): 967-985
Ochatt SJ, Revilla MA (2016) From stress to embryos: some of the problems for induction and maturation of somatic embryos. En: Germana M, Lambardi M (eds). In Vitro embryogenesis in higher plants. Methods in Molecular Biology, pp. 523-536. Humana Press, New York, NY; doi:10.1007/978-1-4939-3061-6_31
Parrott W, Dryden G, Vogt S, Hildebrand D, Cillins G, Williams E (1988) Optimization of somatic embryogenesis and embryo germination in soybean. In Vitro Cellular and Development Biology Plant 24(8): 817; doi:10.1007/BF02623653
Rêgo MM, Rêgo ER, Farias Filho LP (2012) Induced anther callogenesis of Capsicum annuum L. Acta Hortic 929:411–416
Vilchez J, Romero CS, Alfaro FP, Valero NA, Ferrer LM, Padrón AC, de Sierralta SL (2016) Germinación de embriones somáticos de Psidium guajava L. en envases de cultivo con ventilación forzada. Revista de la Facultad de Agronomía 33(2): 181-192
Von Aderkas P, Teyssier C, Charpentier JP, Gutmann M, Pâques L, Le Metté C, Lelu-Walter MA (2015) Effect of light conditions on anatomical and biochemical aspects of somatic and zygotic embryos of hybrid larch (Larix x Marschlinsii). Annals of botany 115(4): 605-615; doi:doi.org/10.1093/aob/mcu254
von Arnold S, Clapham D (2008) Spruce embryogenesis. En: Suárez, Bozhkov (eds). Methods in molecular biology 427, pp. 31-47. Humana Press, Totowa; doi:10.1007/978-1-59745-273-1_3
Vondráková Z, Eliášová K, Vágner M, Martincová O, Cvikrová M (2015) Exogenous putrescine affects endogenous polyamine levels and the development of Picea abies somatic embryos. Plant growth regulation 75(2): 405-414; doi:10.1007/s10725-014-0001-2
Widholm JM (1972) The use of fluorescein diacetate and phenosafranine for determining viability of cultured plant cells. Stain Technol 47(4): 189-194
Zavattieri MA, Frederico AM, Lima M, Sabino R, Arnholdt-Schmitt B (2010) Induction of somatic embryogenesis as an example of stress-related plant reactions. Electronic Journal of Biotechnology 13(1): 1-9; doi:10.2225/vol13-issue1-fulltext-4
Recibido: 16-12-2016
Aceptado: 22-02-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
