Artículo original
Biotecnología Vegetal Vol. 17, No. 2: 113 - 123, abril - junio, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Caracterización histológica del enraizamiento in vitro de brotes de caña de azúcar en medio de cultivo líquido
Histological characterization of sugarcane shoots in vitro rooting in liquid culture medium
Lelurlys Nápoles Borrero1, Mariela Cid Ruíz1, Maritza Escalona Morgado1, Pedro Marrero Sánchez2, Nelly Vásquez Morera3, Oscar Concepción Laffitte1
1Laboratorio de Cultivo de Células y Tejidos, Centro de Bioplantas, Universidad de Ciego de Ávila. Carretera a Morón, km 9. Ciego de Ávila. Ciego de Ávila. Cuba. CP 69450. e-mail: oconcepcion@bioplantas.cu
2Departamento de Botánica, Facultad de Ciencias Agropecuarias, Universidad de Ciego de Ávila. Carretera a Morón, km 9. Ciego de Ávila. Ciego de Ávila. Cuba. CP 69450.
3Laboratorio de Histología. CATIE 7170. Cartago. Turrialba. Costa Rica. CP 30501.
RESUMEN
En la propagación de caña de azúcar (Saccharum spp.) en inmersión temporal se producen brotes individuales o grupos de brotes que requieren de su enraizamiento in vitro antes de ser transferidos a condiciones naturales. El presente trabajo tuvo como objetivo caracterizar el enraizamiento in vitro de brotes de caña de azúcar en medio de cultivo líquido mediante un análisis histológico. Los brotes de caña de azúcar cv. ‘Ragnar’ se enraizaron mediante dos métodos: medio de cultivo líquido estático (MCLE) y Biorreactor de Inmersión Temporal (BIT). Como explantes iniciales se emplearon brotes individuales o grupos de brotes unidos entre sí formando una ‘macolla’. Posteriormente los brotes se aclimatizaron. Para caracterizar histológicamente el enraizamiento se tomaron muestras por cada forma de cultivo y tipo de explante a los 0, 3, 6 y 9 días de cultivo. Se demostró que es efectivo el enraizamiento in vitro de grupo de brotes directamente en BIT. Con esto se evita manipulación adicional de los explantes y se alcanzan resultados satisfactorios de supervivencia (90%) en la aclimatización. Además, se comprobó que la formación de raíces en los tallos, independiente del método de cultivo utilizado (MCLE o BIT), tanto en los brotes individuales como en los grupos de brotes, ocurre a partir del crecimiento continuado de células del parénquima perivascular durante los primeros 3 días de cultivo. Los brotes más internos de los grupos de brotes también presentan un elevado potencial rizogénico, con primordios de raíces caracterizados por una alta distinción del ápice radical y la presencia de caliptra, influenciado por la obstrucción mecánica que ejercen las vainas de las hojas del brote en sí mismo y de los brotes adyacentes.
Palabras clave: aclimatización, caliptra, histología, inmersión temporal, raíces in vitro
ABSTRACT
In the sugarcane (Saccharum spp.) propagation in temporary immersion there are individual shoots or groups of shoots that require their in vitro rooting before being transferred to natural conditions. The objective of the present work was to characterize the in vitro rooting of sugarcane shoots in liquid culture medium by histological analysis. Sugarcane shoots cv. 'Ragnar' were rooted by two methods: static liquid culture medium (MCLE) and Temporal Immersion Bioreactor (BIT). As initial explants, individual shoots or groups of shoots were used together to form a ‘macolla’. The shoots were then acclimatized. To characterize rooting histologically, samples were taken for each culture form and explant type at 0, 3, 6 and 9 days of culture. It was demonstrated that in vitro rooting of shoots group directly in BIT is effective. This prevents further manipulation of the explants and satisfactory survival results (90%) are achieved in acclimatization. In addition, it was verified that root formation in stems, regardless of the method of cultivation used (MCLE or BIT), both in individual shoots and in groups of shoots, occurs from the continuous growth of perivascular parenchyma cells during first 3 days of culture. The most internal shoot of group of shoots also present a high rhizogenic potential, with root primordia characterized by a high root apex distinction and the presence of calyptra, influenced by the mechanical obstruction exerted by leaf pods of the shoot itself and adjacent shoots.
Keywords: acclimatization, calyptra, histology, in vitro roots, temporary immersion
INTRODUCCIÓN
La caña de azúcar (Saccharum spp.) se cultiva en áreas tropicales y subtropicales y posee una gran importancia económica. Los productos que más se obtienen de ella son: alimento, fibras, bagazo, combustible y electricidad (Murthy, 2010).
Los trabajos de propagación in vitro de caña de azúcar se han realizado desde hace más de 50 años (Nickell, 1964) y se aplican hasta la actualidad para la introducción de nuevos cultivares, para el saneamiento de plantaciones de semilla original, en apoyo al mejoramiento genético y para estudios fisiológicos. En la mayoría de los métodos de propagación in vitro utilizados en esta especie se producen brotes individuales o grupos de brotes, los cuales requieren de una fase adicional para su crecimiento y la formación de raíces antes de salir a las condiciones naturales (Cheema y Hussain, 2004; Ali et al., 2008; Behera y Sahoo, 2009; Yadav et al., 2014; Medeiros et al., 2015). La formación de raíces in vitro es una práctica generalizada y en ocasiones es el único método para enraizar una planta. La principal dificultad está en inducir un sistema radical que sea completamente efectivo cuando la planta se transfiere al suelo (George, 1993). En caña de azúcar es limitado el uso y escasa la información sobre el enraizamiento ex vitro, lo cual tendría gran valor para laboratorios comerciales pues elimina una fase del cultivo y por tanto reduce los costos (Pandey et al., 2011).
En Cuba, la propagación in vitro de caña de azúcar a través de técnicas de inmersión temporal se inició por Lorenzo et al. (1998) y se desarrolló por otros autores que concluyeron que permite una mayor tasa de multiplicación y un aumento en la calidad morfológica de los brotes (Lorenzo et al., 2001 a; Lorenzo et al., 2001 b; Posada et al., 2003). También se han realizado estudios del efecto de las condiciones ambientales sobre los aspectos morfoanatómicos, fisiológicos y bioquímicos de las plántulas producidas por inmersión temporal durante la aclimatización, desde el momento de salida de las condiciones in vitro, hasta la permanencia final en esta fase (Rodríguez et al., 2003; Rodríguez et al., 2008). Sin embargo, a pesar de estos avances, en todos estos estudios para el enraizamiento in vitro se ha requerido de un proceso de separación o individualización de los brotes antes de realizar el cambio al medio de cultivo de enraizamiento. Adicionalmente, poco se ha informado de cómo ocurre a nivel histológico el proceso morfogenético del enraizamiento in vitro de los brotes de caña de azúcar en medio de cultivo líquido.
Teniendo en cuenta esta situación, el objetivo del presente trabajo fue caracterizar el enraizamiento in vitro de brotes de caña de azúcar (Saccharum spp.) en medio de cultivo líquido mediante un análisis histológico.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron como material vegetal brotes de caña de azúcar (Saccharum spp.) cv. ‘Ragnar’, que se encontraban cultivados en Biorreactores de Inmersión Temporal (BIT) de 250 ml de capacidad con medio de cultivo de elongación, según protocolo desarrollado por Lorenzo et al. (2001 b).
Enraizamiento in vitro
A los 15 días de cultivo de los brotes en BIT, se transfirieron a medio de cultivo de enraizamiento constituido por sales MS (Murashige y Skoog, 1962) con adición de ácido naftalenácetico (ANA) 2.03 mg l-1, mio-inositol 100 mg l-1, tiamina 1.0 mg l-1 y sacarosa 40 g l-1.
El enraizamiento in vitro se realizó mediante dos métodos de cultivo: el primero en medio de cultivo líquido estático (MCLE) según Jiménez (1995) y el segundo en BIT basado en los resultados de Lorenzo et al. (1998).
En MCLE, se utilizaron frascos de cultivo de 250 ml de capacidad que contenían 50 ml de medio de cultivo de enraizamiento en estado líquido. Sobre soporte de papel de filtro se colocaron dos tipos de explantes: brotes individuales (10 brotes colocados de manera individual por frasco de cultivo) y un grupo de brotes (un grupo o ‘macolla’ de 10 brotes unidos entre sí, por frasco de cultivo).
En el BIT se utilizaron frascos de cultivo de igual capacidad que contenían 100 ml de medio de cultivo de enraizamiento, pero en esta ocasión se colocaron 20 brotes de manera individual por frasco de cultivo y dos grupos de brotes por frasco de cultivo, de 10 brotes cada uno. De esta forma se conformaron cuatro tratamientos experimentales, que se replicaron seis veces cada uno.
El pH de todos los medios de cultivo se ajustó a 5.8 y estos se esterilizaron en autoclave a una presión de 1.2 kg cm-2 y 121°C, durante 20 min. En todos los casos, los frascos de cultivo con los explantes se colocaron en condiciones similares de luz artificial a 27±1 °C, intensidad lumínica de 12.5-37.5 µmol m-2 s-1 y un fotoperíodo de 16 h luz, proporcionado por lámparas de luz fluorescente.
A los 14 días de cultivo, se cuantificó el número de nuevos brotes emitidos por explante inicial, el número de raíces por brote en cada tratamiento y el número de brotes enraizados visiblemente para calcular el porcentaje de enraizamiento para cada tratamiento. En el caso de los grupos de brotes, estos fueron separados para poder evaluar los brotes más internos.
Aclimatización ex vitro
Manteniendo la clasificación experimental de inicio, se realizó la aclimatización de las plantas enraizadas in vitro con el empleo de bandejas de poliuretano de 190 cavidades (25 cm3/cavidad) a las que se adicionó una mezcla de sustrato compuesto por cachaza, ceniza y arena (1:1:1). Se plantaron 40 plantas por tratamiento, con tres repeticiones cada uno. Para el riego se utilizó un sistema automatizado por microaspersión durante el día, que garantizó una humedad relativa que se redujo gradualmente en el tiempo. A los 28 días de cultivo se cuantificó el número de plantas vivas y se calculó el porcentaje de supervivencia para cada tratamiento.
Análisis histológico del enraizamiento in vitro
El análisis histológico se realizó en el momento inicial antes de inducir el enraizamiento y a los tres, seis y nueve días posteriores al enraizamiento in vitro. Para esto se realizó una poda a los brotes con un corte de aproximadamente 1.0 cm de altura a partir de la base. Se tomaron diez muestras por cada método de cultivo (MCLE y BIT), cinco de brotes individuales y cinco de grupo de brotes, en cada uno de los tiempos de muestreo.
Para conservar la estructura de los tejidos, todas las muestras se fijaron durante 48 horas en FAA (formaldehído-ácido acético-alcohol etílico, 5:5:90). Luego se lavaron en agua corriente durante 24 horas para eliminar el exceso de fijador. Una vez concluido el lavado, el tejido fue deshidratado en concentraciones seriadas de alcohol etílico (50, 75, 85 y 95%) sucesivamente cada dos horas. Posteriormente, las muestras se colocaron tres veces en alcohol etílico (100%), durante dos horas en los primeros dos pases y durante toda la noche en el último. Después del proceso de deshidratación las muestras se incluyeron en bloques de parafina a 57°C y se realizaron cortes seriados con un grosor de 6-15 µm, en un micrótomo de deslizamiento vertical. Los cortes fueron teñidos con la técnica de doble tinción Safranina-Fast Green (Johansen, 1940). Para la observación de las muestras se utilizó un microscopio Axioskop OPTON y las imágenes se tomaron con una cámara digital Canon Power Shot G5, adaptada al microscopio.
Análisis estadístico
Tanto para el experimento en el laboratorio como para su continuidad en la aclimatización se utilizó un diseño completamente aleatorizado. El procesamiento estadístico de los datos se realizó mediante el Statistical Package for Social Sciences (SPSS) versión 15.0.1 sobre Windows (Copyright© SPSS Inc., 1989-2006). Los datos expresados en porcentaje se transformaron según la ecuación: X'=2·arcsen (√(x/100), mientras que los datos de las variables discretas, número de brotes y número de raíces, se transformaron según la ecuación: X'=√ (x). Se utilizaron las pruebas estadísticas de Kolmogorov-Smirnov y la prueba de Levene para comprobar supuestos de distribución normal y homogeneidad de varianzas, respectivamente. Al cumplirse estos supuestos, se aplicaron las pruebas paramétricas de análisis de varianza (ANOVA) y Tukey con un valor de p=0.05.
RESULTADOS Y DISCUSIÓN
Después de 15 días de enraizamiento in vitro de los brotes de caña de azúcar en los diferentes tratamientos se observó la emisión de nuevos brotes, un aspecto que caracteriza el crecimiento en forma de ‘macolla’ de los brotes de caña de azúcar (van Dillewijn, 1952). El número de nuevos brotes emitidos fue significativamente superior en los explantes que se colocaron a enraizar de manera individual que en aquellos que se colocaron en grupos (Tabla 1).
Por otra parte, la formación de raíces ocurrió en el 100% de los brotes en todos los tratamientos. Al igual que en los brotes, el número de raíces por explante fue superior en los brotes individuales (Tabla 1). Los grupos de brotes enraizados en el BIT mostraron el menor número de raíces por brote, valor significativamente inferior al del resto de los tratamientos.

Después de 28 días de cultivo en la fase de aclimatización, la supervivencia de las plántulas alcanzó valores entre 75-90% en los diferentes tratamientos establecidos sin diferencias significativas entre estos (Tabla 1). Este resultado en la práctica confirma la funcionalidad y capacidad del sistema radical desarrollado en los brotes sin individualizar (tratamiento grupo de brotes) cultivados en BIT, lo cual permitirá utilizar este tipo de explante para disminuir la manipulación a que son sometidos los brotes durante su transferencia a la fase de enraizamiento in vitro (Lorenzo et al., 2001 b; Rodríguez et al., 2003; Rodríguez et al., 2008; Mordocco et al., 2009; Yadav et al., 2014; Medeiros et al., 2015).
La calidad que presentan los brotes en el cultivo in vitro, es un factor importante para su posterior supervivencia. A pesar de que los grupos de brotes que enraizaron en el BIT presentaron menor número de raíces por brote manifestaron un favorable porcentaje de supervivencia en la aclimatización. Varios autores han referido que durante la primera parte de la fase de aclimatización, lo más importante es alcanzar altos porcentajes de supervivencia. Para ello, el control de la humedad relativa, la luz y la temperatura a que se transfieren las plántulas en los primeros días de la aclimatización son de mucha importancia. El manejo que se realice a estos factores y junto con la calidad que presentan los brotes, son fundamentales para un normal y continuo crecimiento (Rodríguez et al., 2008; Aragón et al., 2014).
Estos resultados son indicativos de que es factible inducir la formación de raíces en los brotes en forma de grupos o ‘macollas’ en el BIT. Estudios posteriores sobre algunos indicadores fisiológicos y del metabolismo del carbono pudieran ser interesantes para profundizar en este aspecto. Sin embargo, el análisis histológico del proceso de enraizamiento en los diferentes tratamientos confirmó la calidad de este tipo de explante propagado en BIT.
En los cortes histológicos realizados a la sección transversal del tallo de brotes de caña de azúcar en el momento inicial sin la aplicación de la auxina para la inducción del enraizamiento se observó la presencia de varias envolturas de hojas alrededor del tallo, característica propia de las hojas de las gramíneas (Esau, 1959) y en especial de la caña de azúcar (van Dillewijn, 1952) (Figura 1).
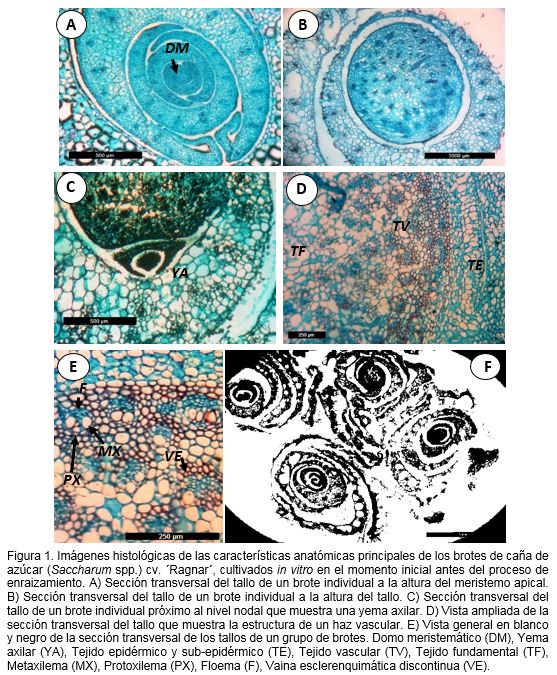
Las envolturas de las hojas jóvenes y primordios de hojas se observaron a la altura del meristemo apical del tallo, lo que indicó la filotaxia normal dística opuesta de las hojas de la caña de azúcar, que protegen al domo meristemático (DM) (Figura 1 A). Además, en la sección transversal a la altura media del tallo se apreció la presencia dispersa de haces vasculares en su interior dentro del parénquima fundamental lo cual corroboró el estado inmaduro del tallo en condiciones in vitro (Figura 1 B). De igual forma, a una altura próxima al nudo del tallo, se observó la presencia de yemas axilares (Figura 1 C). Esta imagen permite apreciar una mayor concentración de haces vasculares a este nivel del tallo y una mayor madurez de la estructura anatómica de las vainas de las hojas adyacentes. La figura 1 D por su parte revela con mayor claridad la afirmación anterior y permite observar un incremento no solo en la cantidad de haces vasculares, sino también en su organización y acumulación hacia la periferia de tejidos esclerenquimáticos. De manera general, se pudo apreciar el desarrollo del tejido epidérmico y sub-epidérmico (TE), el tejido vascular (TV) y el tejido fundamental (TF). Los haces dentro del tejido vascular se caracterizaban por estar rodeados de esclerénquima y localizados cerca de la epidermis dando lugar a un cilindro continuo de esclerénquima. En una vista ampliada de esta región (Figura 1 E) se observó el desarrollo de un haz vascular, donde la vaina esclerenquimática (VE) se presenta de forma discontinua. Esto puede estar asociado a la inmadurez de los tejidos que es característica frecuente en el material vegetal cultivado in vitro en comparación con el cultivado en condiciones ex vitro (Majada et al., 2000; Barboza et al., 2006; Aragón et al., 2009). Sin embargo, también se apreció el metaxilema (MX), el protoxilema (MX) y el floema (F) que dan muestra del nivel de organización que alcanzan los tejidos de los brotes de caña de azúcar que garantizan el desarrollo de la raíz.
Estos resultados están en correspondencia con lo informado por varios investigadores que realizaron estudios para describir la bioquímica y fisiología del cultivo in vitro de plantas y han referido cambios metabólicos en comparación con plantas cultivadas en las condiciones ex vitro (Dubuc y Desjardins, 2007; Aragón et al., 2009). De manera general se refiere escasa fotosíntesis, poco desarrollo de las hojas, emisión de raíces falsas o poco funcionales y la presencia de indicadores de estrés, debido a las condiciones en que se desarrolla el cultivo in vitro (Kozai y Kubota, 2001; Rodríguez et al., 2003; Dubuc y Desjardins, 2007; Aragón et al., 2009; Aragón, 2015). Sin embargo, el análisis inicial de la estructura anatómica de los brotes de caña de azúcar en este estudio indicó características generales propias del tallo de las gramíneas, resultado que coincide con otros análisis anatómicos de caña de azúcar en condiciones de campo (Marrero et al., 2004).
Por otra parte, la sección transversal de los tallos de un grupo de cuatro brotes de caña de azúcar cultivados in vitro y sin inducción del enraizamiento al momento inicial, mostró la envoltura típica de las hojas en cada uno de los tallos de los brotes que conforman el grupo (Figura 1 E). Se apreciaron diferentes secciones transversales de los brotes ya que existe una diferencia de tamaño entre los brotes que conforman el grupo, aspecto que es típico del crecimiento en ‘macolla’ de las gramíneas. También se observó la cantidad de hojas y su grado de compactación hacia el interior del grupo.
Después de 3 días de cultivo en medio de cultivo de enraizamiento in vitro, los brotes de caña de azúcar, independientemente del método de cultivo (MCLE o BIT) y tanto para brotes individuales o en grupo, exhibieron la formación de primordios radicales en todas las muestras procesadas (Figura 2).

La sección transversal del tallo de un brote individual en crecimiento, a los tres días en medio de cultivo de enraizamiento bajo condiciones de MCLE (Figura 2 A) mostró el desarrollo de una yema axilar (YA) así como de un primordio radical (PR) con crecimiento oblicuo que fue seccionado transversalmente. De igual forma, la sección transversal de un brote que conformaba un grupo cultivado en MCLE durante 3 días en medio de cultivo de enraizamiento se observó un desarrollo similar y la presencia simultánea de yemas axilares (YA) y primordios radicales (PR) (Figura 2 B). Esto indicó que independientemente del tipo de explante utilizado (individual o en grupo) la formación de raíces ocurrió en las primeras 72 horas de inducido el proceso.
La observación de la sección transversal del tallo de un brote individual (Figura 2 C) indicó que las raíces se originaron de células parenquimáticas asociadas al tejido vascular. En este caso, hacia el extremo basal del primordio de raíz se observó una continuidad del crecimiento de las células del parénquima perivascular (PPV) y el primordio de la raíz (PR). En segmentos de tallo de caña de azúcar durante la macropropagación tradicional, la emergencia de las primeras raíces ocurre en las primeras 24 h (Smith et al., 2005), sin embargo poca es la información respecto a la emergencia de las raíces durante el enraizamiento in vitro. En uno de los ejemplos en otros cultivos tales como Castanea sativa Mill., Vieitez y Vieitez (1983) encontraron que en entre el segundo y tercer día de cultivo in vitro, las células de la región del floema comenzaron a dividirse y formaron grupos de células meristemáticas que denominaron ‘meristemoides’. Su individualización condujo a la formación de un primordio radical al octavo día.
Además, se observó la presencia de un primordio de raíz en desarrollo (Figura 2 D), surgido a partir del tallo de un brote que forma parte de un grupo bajo condiciones de MCLE. La naciente raíz, que en tan poco período de tiempo bajo la acción de la auxina, muestra la presencia de células meristemáticas que destacan la zona meristemática sub-apical (ZMSA) por su alta tinción, bien diferenciada de la zona de alargamiento (ZA) en la cual se revela la diferenciación de los cordones vasculares (CV) del xilema y floema de la raíz aspecto que es recurrente en la morfología de estos primordios radicales (Gonçalves-Martins et al., 2012). En esta imagen (Figura 2 D) se observa el avance del primordio radical atravesando las envolturas de las vainas de hojas, crecimiento que ocurre con mayor dificultad en los explantes en forma de grupos de brotes.
Por el contrario el crecimiento de un primordio de raíz en un brote individual bajo condiciones de MCLE muestra un mayor alargamiento y una menor diferenciación de los puntos de crecimiento (Figura 2 E). En este caso el crecimiento de la raíz conlleva menor resistencia mecánica.
La sección transversal de los tallos de un grupo de brotes bajo condiciones de cultivo en BIT, mostró un patrón anatómico del primordio de raíz similar al del grupo de brotes cultivados bajo condiciones de MCLE. Probablemente la propia obstrucción mecánica que ejercen las envolturas de hojas sobre la raíz sea la causa fundamental de este tipo de desarrollo (Figura 2 F). En el primordio de raíz del grupo de brotes cultivados en BIT se distinguió igualmente la zona de alargamiento de las células y la zona meristemática sub-apical, aspecto que resulta ligeramente superior a las raíces observadas en los brotes individuales. También se observó cómo la raíz recién formada creció en dirección al brote adyacente, teniendo que romper las hojas que envuelven el propio brote y las capas de hojas del brote adyacente que ofrece obstáculo a su crecimiento. Los resultados a los tres días de cultivo en presencia de la auxina evidenciaron cambios histológicos dirigidos a la formación de primordios de raíz.
Resultados similares a los observados en las muestras de 3 días se apreciaron en los cortes realizados a los 6 y 9 días después de inducido el enraizamiento, tanto para los brotes individuales como en los grupos de brotes cultivados bajo condiciones de MCLE o en BIT. Solo se debe destacar que el tamaño de las yemas laterales fue mayor bajo las condiciones de cultivo en BIT (Figura 2 G), donde se observó la presencia de meristemos caulinares activos con destacadas estructuras de primordios foliares en crecimiento (PF).
Un desarrollo similar a lo observado en los tallos del grupo de brotes bajo condiciones de MCLE, se observó en los grupos de brotes cultivados en BIT. Sin embargo, para este último, contrario a la observación morfológica externa (Tabla 1), la observación histológica de las muestras procesadas reveló una mayor intensidad en la formación de las raíces, lo que provoca una ligera deformación del tallo y mantiene la emisión simultánea de brotes laterales bien definidos y de nuevas raíces (Figura 2 G) con características anatómicas de una alta distinción del ápice radical (AR), e incluso la presencia de caliptra (C). Se observó que hubo un incremento en el número de células en división, las cuales se tiñen densamente y provocan alteraciones en la forma radial del cilindro vascular.
El crecimiento de las raíces estuvo fuertemente vinculado al ambiente donde se desarrollaron. Esau (1959) mencionó que las condiciones del medio ambiente influyen sobre la estructura de la caliptra, que experimenta una reducción de tamaño y pérdida estructural cuando plantas que normalmente crecen en suelo se trasladan a un medio acuático. Por su parte, Sarquis et al. (1992) señalaron que una presión mecánica de tan solo 100 kPa en el suelo, incrementó cuatro veces la producción de etileno, aumentó el grosor de las raíces siete veces y redujo en 75% la longitud de éstos órganos en plantas de maíz (Zea mays L.). En caña de azúcar, es amplio el reconocimiento a la plasticidad y cambios morfológicos de las raíces que provoca el ambiente, con implicaciones para el funcionamiento del sistema radical y la respuesta de las plantas al estrés (Smith et al., 2005). En este sentido, se justifican las diferencias anatómicas entre los primordios de raíz de brotes individuales y de brotes agrupados en ‘macollas’, independientemente de la forma de cultivo (MCLE o BIT). En los brotes individuales existe menor obstrucción mecánica y la raíz alcanza la zona externa con mayor facilidad. Esta permite su cuantificación, lo cual justifica los valores más altos de número de raíces por explante en los brotes individuales mostrados en la Tabla 1. También explica los resultados de supervivencia durante la aclimatización alcanzados por los brotes enraizados en grupo con el BIT a pesar de su menor número de raíces cuantificadas (Tabla 1).
La secuencia de cambios anatómicos observados durante el proceso de la rizogénesis en caña de azúcar, indicó que una división celular activa condujo a la formación de raíces iniciales que subsecuentemente originan los primordios. Posteriormente, éstos se diferenciaron en raíces con sistema vascular propio. Es de destacar que con el aumento del número de brotes que conforman el grupo o ‘macolla’ y el crecimiento de las raíces emitidas se incrementó la presión en el interior del grupo lo cual influyó directamente en la deformación de los tallos de los brotes más internos y en la anatomía de las raíces que crecen hacia el interior del grupo de brotes.
En el caso de los brotes de caña de azúcar, los elementos de resistencia mecánica por un lado y las condiciones ambientales del cultivo en el BIT por otro, contribuyeron de alguna forma a retardar el crecimiento de las raíces en los grupos de brotes. Estos primordios de raíces no pueden ser apreciados visualmente en el momento de la evaluación morfológica, pero sí fueron observados histológicamente, donde se pudo comprobar que, además, inducen la formación de estructuras como la caliptra que no se describe con frecuencia en condiciones de cultivo in vitro.
CONCLUSIONES
Esta investigación demostró que el enraizamiento in vitro de los brotes de caña de azúcar es efectivo y se puede realizar con el uso de explantes en forma de grupo de brotes directamente en el BIT, con lo cual se evita manipulación adicional de estos. Por otro lado se comprobó que la formación de raíces, independientemente del método de cultivo y el tipo de explante utilizado, ocurre durante los primeros 3 días de cultivo y tiene un patrón de origen celular a partir de la continuidad del crecimiento de las células del parénquima perivascular. Por último se demostró que los brotes más internos de los grupos de brotes también presentan un elevado potencial rizogénico, con raíces caracterizadas por una alta distinción del ápice radical e incluso la presencia de caliptra, influenciado por la obstrucción mecánica que ejercen las vainas de las hojas del brote en sí mismo y de los brotes adyacentes.
REFERENCIAS
Ali A, Naz S, Siddiqui FA, Iqbal J (2008) An efficient protocol for large scale production of sugarcane through micropropagation. Pak J Bot 40(1): 139-149
Aragón C, Carvalho L, González J, Escalona M, Amâncio S (2009) Sugarcane (Saccharum sp. Hybrid) propagated in headspace renovating systems shows autotrophic characteristics and develops improved anti-oxidative response. Tropical Plant Biol 2 (1):38-50; doi:10.1007/s12042-008-9026-x
Aragón C, Sánchez C, González-Olmedo J, Escalona M, Carvalho L, Amâncio S (2014) Comparison of plantain plantlets propagated in temporary immersion bioreactors and gelled medium during in vitro growth and acclimatization. Biol Plant 58 (1):29-38; doi:10.1007/s10535-013-0381-6
Aragón C (2015) Physiological characteristics as analyzed by hormone profile, metabolic pathways and expression of specific induced genes of C3, C4 and CAM tropical crops propagated by Temporary Immersion Bioreactors (TIB). Tese apresentada para obtenção do grau de Doutor em Engenharia Agronómica, Instituto Superior de Agronomía Universidad de Lisboa, Lisboa, Portugal
Barboza S, Ribeiro D, Teixeira J, Portes T, Souza L (2006) Anatomía foliar de plantas micropropagadas de abacaxi. Pesquisa Agropecuaria Brasileira 41(2):185-194
Behera KK, Sahoo S (2009) Rapid in vitro micropropagation of sugarcane (Saccharum officinarum L. cv-Nayana) through callus culture. Nature and Science 7(4): 1-10
Cheema KL, Hussain H (2004) Micropropagation of sugarcane through apical bud and axillary bud. International Journal of Agriculture & Biology 6(2): 257-259
Dubuc J, Desjardins Y (2007) Effect of autotrophic and mixotrophic tissue culture conditions on the expression of primary metabolism genes of tomato plantlets. Acta Hort 748: 165-172; doi:10.17660/ActaHortic.2007.748.20
Esau K (1959) Anatomía vegetal. Instituto del Libro, La Habana
George E (1993) Plant propagation by tissue culture. Butler and Tanner Ltd, Frome
Gonçalves-Martins R, Gonçalves-Martins MB, Silva JM, PereiraI MA, Appezzato-da-Glória B, De Camargo, Castro PR (2012) Thiamethoxam on the histological characteristics of sugarcane young roots. Ciência Rural 42(11): 1936-1940
Jiménez E (1995) Propagación in vitro de la caña de azúcar (Saccharum spp. hibrido). Tesis presentada en opción al Grado Científico de Doctor en Ciencias Agrícolas, Universidad Central Marta Abreu de Las Villas, Santa Clara, Cuba
Johansen DJ (1940) Plant microtechnique. Mc Graw-Hill, New-York
Kozai T, Kubota C (2001) Developing a photoautotrophic micropropagation system for woody plants. Journal of Plant Research 114(1116): 525-537
Lorenzo JC, González B, Escalona M, Teisson C, Espinosa P, Borroto C (1998) Sugarcane shoot formation in an improved temporary immersion system. Plant Cell, Tissue and Organ Culture 54(3): 197-200; doi:10.1023/A:1006168700556
Lorenzo JC, Blanco M, Gónzalez A, Cid M, Escalona M, Borroto C (2001 a) Sugarcane micropropagation and phenolic excretion. Plant Cell, Tissue and Organ Culture 65(1): 1-8; doi:10.1023/A:1010666115337
Lorenzo JC, Ojeda E, Espinosa A, Borroto C (2001 b) Field performance of temporary immersion bioreactor-derived sugarcane plants. In vitro Cell Dev Biol Plant 37(6): 803-806; doi:10.1007/s11627-001-0133-8
Majada J, Tadeo F, Fal M, Sanchez-Tames R (2000) Impact of culture vessel ventilation on the anatomy and morphology of micropropagated carnation. Plant Cell Tiss Org Cult 63(3): 207-214
Marrero P, Hipólito P, Pérez S, Borroto J, Blanco M (2004) Efecto de aplicaciones exógenas del ethrel – 480 sobre la anatomía del tallo, en cuatro variedades de caña de azúcar (Saccharum spp. híbrida). Caña de Azúcar 22(2): 5-18
Medeiros M, Cabral E, Mota Lima GV, Willadino L, Camara T (2015) In vitro propagation in Temporary Immersion System of sugarcane plants variety ‘RB 872552’ derived from somatic embryos. Biotecnología Vegetal 15(3): 187-191
Mordocco A, Brumbley J, Lakshmanan P (2009) Development of a temporary immersion system (RITA®) for mass production of sugarcane (Saccharum spp. interspecific hybrids). In Vitro Cell Dev Biol Plant 45(4): 450–457; doi:10.1007/s11627-008-9173-7
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol Plant 15(3): 473-479; doi:10.1111/j.1399-3054.1962.tb08052.x
Murthy SRS (2010) Economics of sugarcane production and processing. National Bank for Agriculture and Rural Development (NABARD), Mumbai
Nickell LG (1964) Tissue and cell culture of sugarcane: another research tool. Hawaii Plant Rec 57: 223-229
Pandey RN, Rastogi J, Sharma ML, Singh RK (2011) Technologies for cost reduction in sugarcane micropropagation. African Journal of Biotechnology 10(40): 7814-7819; doi:10.5897/AJB10.2342
Posada L, Gómez-Kosky R, Reyes M, Alvarez L (2003) Empleo de los Sistemas de Inmersión Temporal (RITA) en la propagación de plantas vía organogénesis en caña de azúcar y bananos. Biotecnología vegetal 3(1): 3-8
Rodríguez R, Cid M, Pina D, Gonzalez-Olmedo J, Desjardins Y (2003) Growth and photosynthetic activity during acclimatization of sugarcane plantlets cultivated in Temporary Immersion bioreactors. In vitro Cell Dev Biol Plant 39(6): 657-662
Rodríguez R, Aragón C, Escalona M, González-Olmedo J, Desjardins Y (2008) Carbon metabolism in leves of micropropagated sugarcane during acclimatization phase. In vitro Cell Dev Biol Plant 44(6):533-539; doi:10.1007/s11627-008-9142-1
Sarquis JI, Jordan WR, Morgan PW (1992) Effect of atmospheric pressure on maize root growth and ethylene production. Plant Physiol 100(4): 2106-2108
Smith DM, Inman-Bamber NG, Thorburn PJ (2005) Growth and function of the sugarcane root system. Field Crops Research 92(2): 169-183; doi:10.1016/j.fcr.2005.01.017
van Dillewijn C (1952) Botany of Sugarcane. Chronica Botanics Co, Waltham
Vieitez AM, Vieitez ML (1983) Secuencia de cambios anatómicos durante la rizogénesis in vitro del Castaño. Pyton 43(2): 185-191
Yadav S, Ahmad A, Rastogi J, Lal M (2014) Effect of propagule trimming on shoot multiplication rate in sugarcane micropropagation. J Sugarcane Research 4(1): 82-85
Recibido: 10-03-2017
Aceptado: 20-04-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
