Artículo original
Biotecnología Vegetal Vol. 17, No. 2: 125 - 133, abril - junio, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Mínima concentración de polietilenglicol 6000 para seleccionar in vitro plantas de Musa spp. tolerantes a estrés hídrico
Minimum polyethylene glycol 6000 concentration for selecting Musa spp. in vitro plants tolerant to water stress
Leonardo J Moreno-Bermúdez, Maritza Reyes, Rafael Gómez-Kosky, Borys Chong-Pérez
Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830.
e-mail: ljmoreno@ibp.co.cu
RESUMEN
Las sequías cada vez más intensas son un factor abiótico que ha afectado la producción de plátanos y bananos (Musa spp.), por ello se hace necesaria la obtención de cultivares tolerantes. La selección in vitro de plantas ofrece ventajas sobre la selección en campo pues ahora tiempo, recursos y permite trabajar con mayores volúmenes de individuos. Para este tipo de selección es necesario establecer una serie de condiciones. El objetivo del presente trabajo fue determinar la mínima concentración de polietilenglicol 6000 a la cual se afectan variables morfo-fisiológicas en plantas in vitro de los cultivares de Musa spp. ‘Grande naine’ (AAA) y ‘Pelipita’ (ABB). Las plantas fueron sometidas a cuatro concentraciones de polietilenglicol 6000 (3, 5, 7 y 9%; m/v) en medio de cultivo semisólido de multiplicación, y un tratamiento control sin la presencia de esta sustancia. Como indicadores de estrés se evaluaron las variables altura de la planta, área foliar, masa fresca, masa seca y contenido de malondialdehído. A los 30 días de cultivo se afectaron significativamente para el cultivar ‘Grande naine’ todas las variables a partir de 3% de polietilenglicol 6000, mientras que para el cultivar ‘Pelipita’ las afectaciones comenzaron a ser significativas a partir del 5% de esta sustancia. Los resultados indicaron que el cultivar ‘Pelipita’ toleró mejor el estrés que el ‘Grande naine’, y que usando estos dos cultivares como patrones de referencia, la mínima concentración de polietilenglicol 6000 para seleccionar in vitro plantas de Musa spp. tolerantes al déficit hídrico, puede ser 3%.
Palabras clave: Grande naine, PEG, Pelipita, selección in vitro, sequía
ABSTRACT
Increasingly intense droughts are an abiotic factor which has affected bananas and plantains (Musa spp.) production, therefore it is necessary to obtain tolerant genotypes. Plants in vitro selection offers advantages over field selection as it saves time, resources and permit to work with larger plant volumes. Before to establish an in vitro selection protocol for drought, it is necessary first, to establish some conditions. The aim of this work was to determine the minimum polyethylene glycol 6000 concentration which morpho-physiological variables are affected in in vitro Musa spp. plants, 'Grande naine' (AAA) and 'Pelipita' (ABB) cultivars. In vitro plants were subjected to four polyethylene glycol 6000 concentrations (3, 5, 7 and 9%; w/v) in semisolid multiplication culture medium. Also it was taken into account a control treatment without polyethylene glycol 6000. As stress indicators, plant height, leaf area, fresh weight, dry weight and malondialdehyde content were evaluated. After 30 days of culture, all variables were significantly affected in 'Grande naine' cultivar from 3% polyethylene glycol 6000, whereas in 'Pelipita' cultivar the affections began to be significative from 5%. These results indicated that 'Pelipita' cultivar tolerated the stress better than 'Grande naine'. From this, using these two cultivars as reference standards, the minimum polyethylene glycol 6000 concentration to select in vitro Musa spp. plants, tolerant to water deficit, may be 3%.
Keywords: drought, Grand naine, in vitro selection, PEG, Pelipita
INTRODUCCIÓN
Los bananos y plátanos (Musa spp.) están entre los primeros cultivos desarrollados en la historia de la agricultura humana (Padam et al., 2014). Estos constituyen el alimento básico para millones de personas alrededor de todo el mundo por poseer un alto valor nutricional ya que son fuente de carbohidratos, fibras, vitaminas, minerales y presentan bajos contenidos de grasas (Arvanitoyannis y Mavromatis, 2009; Po y Po, 2012).
Estos cultivos, al desarrollarse en las zonas tropicales y subtropicales del planeta son sensibles a la sequía. El estrés por un déficit en la humedad del suelo afecta negativamente el crecimiento y desarrollo de estas plantas y ocasiona una disminución en su productividad (Muthusamy et al., 2014).
Ante la presencia de sequías cada vez más severas y prolongadas a nivel global, se hace necesaria la obtención de nuevos cultivares tolerantes a este factor abiótico. En este sentido, algunas técnicas biotecnológicas como el cultivo y la selección in vitro podrían ser de gran utilidad en la identificación temprana de plantas de Musa spp., capaces de tolerar ambientes más secos. Para seleccionar cultivares tolerantes es necesario tener en cuenta algunos aspectos como las variables a medir para detectar la tolerancia, las condiciones bajo las cuales esta se puede expresar y los controles de referencia a utilizar.
En este sentido, como indicadores de estrés hídrico han sido empleadas por muchos autores variables morfo-fisiológicas relacionadas con el crecimiento vegetal y el daño celular ocasionado por estrés oxidativo. Algunas de estas son altura de la planta, área foliar, masa fresca, masa seca, contenido de agua, contenidos de clorofila, malondialdehído y peróxido de hidrógeno entre otras (Surendar et al., 2013; García et al., 2015).
Por otra parte, para seleccionar in vitro plantas tolerantes a déficit hídrico es necesario simular este tipo de estrés bajo estas condiciones. Como agentes inductores de estrés a nivel de laboratorio se usan sustancias denominadas “osmoestresantes” que al incorporarse a los medios de cultivo disminuyen su potencial osmótico, retienen las moléculas de agua y dificultan su absorción por parte de los tejidos vegetales. De esta manera se puede inducir en las plantas una sequía fisiológica. Algunos ejemplos de sustancias osmoestresantes son el manitol, sorbitol, sacarosa y polietilenglicol (PEG). De todas ellas, la última es una de las más empleadas (Rai et al., 2011).
En Musa spp., con el uso de agentes osmoestresantes y la determinación de algunas de las variables mencionadas, se han realizado estudios de selección in vitro de plantas tolerantes a estrés hídrico (Shekhawat et al., 2014; Rustagi et al., 2015; Negi et al., 2016). Sin embargo, las condiciones para la selección están determinadas por los cultivares empleados en cada caso. Cabe destacar que, aunque las musáceas de manera general son sensibles al déficit hídrico no todos los cultivares responden de la misma forma. Se plantea que aquellos que poseen en su genoma una mayor contribución de M. balbisiana (representado con la letra B) son más tolerantes al estrés hídrico, que aquellos que solo poseen la contribución de M. acuminata (representado con la letra A), considerados como altamente sensibles a la escasez de agua (Ravi et al., 2013).
A pesar de los estudios referidos sobre el tema en Musa spp., no se han encontrado trabajos donde se evalúen al mismo tiempo diferentes concentraciones de agentes osmoestresantes, a la vez que se utilizan cultivares con genotipos que abarquen un amplio rango de respuesta a la sequía. Investigaciones de este tipo pudieran ser de gran utilidad como base para futuros trabajos de selección in vitro a estrés hídrico en plátanos y bananos. Teniendo en cuenta lo anterior, el objetivo de este trabajo fue determinar la mínima concentración de PEG 6000 a la cual se afectan variables morfo-fisiológicas en plantas in vitro de los cultivares de Musa spp. ‘Grande naine’ (AAA) y ‘Pelipita’ (ABB).
Material vegetal
Se emplearon plantas in vitro de los cultivares de Musa spp. ‘Grande naine’ (AAA) y ‘Pelipita’ (ABB) en fase de multiplicación entre el tercer y sexto subcultivo, propagadas por organogénesis según el protocolo propuesto por Orellana (1994). A partir de las plantas se obtuvieron explantes de aproximadamente 0.5 cm de diámetro y 1.0 cm de altura que fueron colocados en el medio de cultivo empleado para el estudio.
Medio de cultivo
Se utilizó un medio de cultivo semisólido de multiplicación, compuesto por sales MS (Murashige y Skoog, 1962) 4.3 g l-1, tiamina 1.0 mg l-1, 6-bencilaminopurina 4.0 mg l-1, ácido indolacético 0.65 mg l-1, mio-inositol 100 mg l-1, ácido cítrico 50 mg l-1, sacarosa 30 g l-1 y gelrite 2.5 g l-1.
Para inducir el estrés hídrico in vitro se adicionó al medio de cultivo el PEG 6000. Fueron evaluadas cuatro concentraciones: 3, 5, 7 y 9% (m/v) y además se tuvo en cuenta un tratamiento control sin la presencia en el medio de cultivo de esta sustancia. El pH del medio de cultivo fue ajustado a 5.8 con NaOH 0.1 M y HCl 0.1 M, y se distribuyó en tubos de ensayo de vidrio de 150 mm de largo x 20 mm de diámetro (10 ml/tubo). Posteriormente se esterilizaron en autoclave a 121°C y 1.2 kg cm-2 de presión durante 15 min.
Condiciones de crecimiento
Los explantes una vez colocados en el medio de cultivo se mantuvieron en una cámara de crecimiento a 27±2°C, luz solar, con una intensidad de Flujo de Fotones Fotosintéticos entre 48-65 pmol m-2 s-1 y un fotoperíodo de aprox. 13 horas al día. Luego de 30 días bajo estas condiciones, se determinaron las variables altura de las plantas, área foliar, masa fresca, masa seca y contenido de malondialdehído.
Altura de las plantas y área foliar (AF)
La altura de las plantas (cm) fue medida con una regla graduada desde la base de la planta hasta el punto de inserción en el pseudotallo de la última hoja completamente emitida. Para calcular el AF (cm2) se empleó la ecuación propuesta por Obiefuna y Ndubizu (1979) para Musa spp. según la cual: Área foliar = 0.8 (largo x ancho).
Masa fresca (MF) y masa seca (MS)
La MF (g) se obtuvo tras pesar las plantas inmediatamente después de extraerlas de los tubos de cultivo, y para determinar la MS (g) las plantas se secaron en la estufa a 60°C y se pesaron varias veces en el tiempo hasta mantener peso constante.
Contenido de malondialdehído (MDA)
Para calcular el contenido de MDA se siguió el protocolo propuesto por Wang et al. (2009) como se describe a continuación: a 100 mg de tejido vegetal (plantas in vitro completas previamente trituradas en nitrógeno líquido y almacenadas a -80°C) se le añadieron 5 ml de ácido tiobarbitúrico (TBA) al 0.6% (v/v) en ácido tricloroacético (TCA) al 10% (m/v) y se dejó reposar durante 5 min. Luego se calentó la mezcla a 100°C por 15 min, se enfrió en hielo por 5 min y se centrifugó inmediatamente a 1 500 g durante 10 min a 4°C. La absorbancia del sobrenadante fue leída a 450, 532 y 600 nm en un espectrofotómetro GENESYS 6 (Thermo Electronic Corperation, Visionlite, Versión 2.1). Para la lectura se utilizó como blanco TCA al 10% y para calcular la concentración de MDA se empleó la siguiente ecuación: Equivalentes de MDA (nmol g MF-1) = 6.45 (DO532 - DO600) - 0.56 (DO450) x 1000.
Procesamiento estadístico
El experimento fue repetido tres veces, en cada una se emplearon 20 plantas de cada cultivar para cada tratamiento, para un total de 60 plantas respectivamente. Para el análisis estadístico de los datos experimentales se empleó el programa SPSS (Statistical Package for Social Sciences) ver. 21.0 para Windows. Para el procesamiento de los resultados se comprobó la normalidad y la homogeneidad de varianzas por las pruebas de Shapiro-Wilk y Levene, respectivamente. Debido a que los datos no cumplieron con estos supuestos se realizaron las pruebas no paramétricas de H de Kruskall-Wallis y U de Mann-Whitney para un intervalo de confianza del 95% (p<0.05).
RESULTADOS Y DISCUSIÓN
A los 30 días de cultivo se observó una reducción tanto en la altura como en el AF de las plantas de ambos cultivares crecidas en presencia de PEG 6000, cuando fueron comparadas con las plantas del tratamiento control (Figura 1). En el cultivar ‘Grande naine’ la reducción de ambas variables fue significativa a partir de 3% de PEG 6000 (Figura 2 A y B). A esta concentración la altura de las plantas se redujo en 18.6%; mientras que a 5 y 7% del agente osmoestresante la reducción fue de 41.7 y 48.0% respectivamente, sin diferencias significativas entre ellas y sí con 3% y el control. Para 9% de PEG 6000 no fue posible calcular la altura debido a que las plantas no emitieron las hojas completamente del pseudotallo, sino que se mantuvieron enrolladas como hoja "cigarro” dentro de él y solo emergió el extremo distal del órgano (Figura 1). Por otra parte, en este mismo cultivar la reducción del AF por el efecto del PEG 6000 fue drástica para 3, 5 y 7% (59, 64 y 67% respectivamente) sin diferencias significativas entre ellas y sí con el control (Figura 2 B). Para 9% de PEG 6000 no fue posible calcular el AF de las plantas.
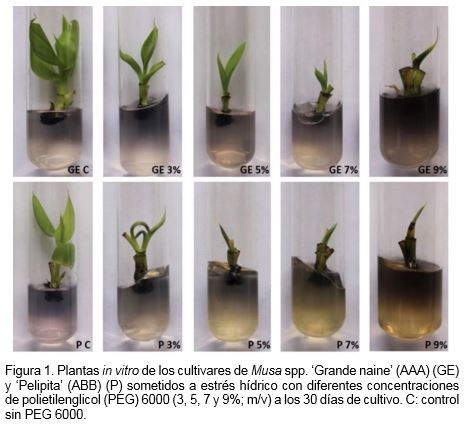

Para el cultivar ‘Pelipita’ con 3% de PEG 6000 en el medio de cultivo la reducción en la altura de las plantas no fue significativa cuando se comparó con el tratamiento sin estrés (Figura 2 A). Sin embargo, para concentraciones superiores no se pudo determinar esta variable debido a que las hojas no se expandieron. El área foliar, por la razón anterior, no pudo ser calculada para 5, 7 y 9% de PEG 6000; tampoco para 3%, pues aunque las hojas sí emergieron completamente permanecieron enrolladas (Figura 1).
Los resultados mostrados para las variables anteriormente analizadas concuerdan con lo informado por Wareing y Phillips (1970). Estos autores plantearon que tanto el crecimiento de las plantas como la expansión de las hojas involucran procesos como el crecimiento y desarrollo celular, los cuales son muy sensibles a la falta de agua por su dependencia con el grado de turgencia de las células. Por otra parte, estos resultados también confirman lo referido en la literatura científica sobre la sensibilidad de las musáceas a la sequía (Muthusamy et al., 2014). Sin embargo, aunque en ambos cultivares disminuyó la altura de las plantas y el AF como consecuencia del estrés ocasionado por el PEG 6000, la respuesta observada para cada uno fue diferente.
Para la variable altura de la planta, el cultivar ‘Grande naine’ mostró sensibilidad al déficit hídrico impuesto con todas las concentraciones de PEG 6000, ya que desde la mínima concentración empleada la altura disminuyó significativamente con respecto al control. En cambio, el cultivar ‘Pelipita’ toleró el déficit hídrico con 3% de PEG 6000 pues las afectaciones comenzaron a notarse a partir de 5% de esta sustancia.
A pesar de lo anterior, en el cultivar ‘Pelipita’ el AF no pudo ser calculada para ninguna de las concentraciones de PEG 6000 estudiadas por no existir hojas completamente expandidas, y sin embargo en el cultivar ‘Grande naine’ sí se pudo calcular esta variable hasta el 7% de PEG 6000. Esta respuesta por parte del cultivar ‘Pelipita’ a partir de la mínima concentración del agente osmoestresante, también podría estar relacionada con una tolerancia al déficit hídrico. Según García et al. (2015) la reducción del área foliar constituye una respuesta adaptativa para controlar la pérdida de agua bajo condiciones de sequía inducida, y es propia de cultivares tolerantes a este factor abiótico.
Resultados similares a los del presente estudio fueron obtenidos por Mohd et al. (2004) y Surendar et al. (2013) quienes observaron una reducción en la altura y el AF de diferentes cultivares de Musa spp. sometidas a déficit hídrico. Por otra parte, los resultados para estas dos variables corroboran lo informado en la literatura científica donde se plantea que en Musa spp. los cultivares con genotipo ABB son en particular los más tolerantes al estrés hídrico y otros estreses de tipo abiótico, y aquellos con genotipo AAA son los más sensibles (Ravi et al., 2013).
La MF y la MS también se afectaron por el efecto del estrés hídrico inducido con PEG 6000. En el cultivar ‘Grande naine’ se observó una reducción significativa de ambas variables con respecto al control, a partir del 3% del PEG 6000. La MF se redujo en todos los tratamientos entre 46.3 y 62.0%. Por otra parte, la MS se redujo en 30.5 y 47.8% para 3 y 7% de PEG 6000 respectivamente, y en 59.1 y 58.9% para 5 y 9% respectivamente (Figura 3 A y B).
Para el cultivar ‘Pelipita’ con 3% de PEG 6000 no se evidenció afectación significativa para la MF ni para la MS. Con concentraciones superiores del agente osmoestresante, al comparar con el tratamiento control, se observó una disminución significativa de ambas variables (Figura 3 A y B). La MF disminuyó respecto al tratamiento sin estrés entre 65.4 y 68.9%, y la MS entre 42.5 y 46.1% para las tres concentraciones de PEG 6000 más elevadas respectivamente, sin diferencias significativas entre ellas en ambas variables.
La MF y la MS pueden afectarse de acuerdo con el estado hídrico de las plantas por depender de procesos como la absorción y retención de agua en los tejidos, la transpiración y la producción de biomasa (dependiente de la turgencia celular). Estas variables han sido empleadas como indicadoras de estrés hídrico por varios autores (Baloglu et al., 2012; Kavas et al., 2013; Ravi et al., 2013). Los resultados del presente trabajo están en concordancia con lo anterior ya que se observó una reducción tanto de la MF como de la MS debido al estrés hídrico en los dos cultivares estudiados. En ‘Grande naine’ esta reducción fue significativa con respecto al control para todas las concentraciones de PEG 6000 evaluadas lo cual corroboró una vez más su sensibilidad ante un déficit de agua. Por otra parte, el cultivar ‘Pelipita’ fue tolerante a un déficit hídrico inducido con 3% de PEG 6000, por no observarse a esta concentración diferencias significativas con respecto al control para las dos variables.

Resultados similares a los del presente estudio también han sido obtenidos por Bidabadi et al. (2012), Mahmood et al. (2012) y Ravi et al. (2013). Estos autores también han constatado una reducción de la MF y la MS en diferentes cultivares de Musa spp. sometidos a estrés hídrico inducido tanto in vitro como ex vitro. En todos estos trabajos se han asociado las menores reducciones en estas dos variables con una mayor tolerancia al estrés.
El contenido de MDA se incrementó en ambos cultivares como consecuencia del estrés hídrico. En ‘Grande naine’ el aumento fue significativo con respecto al tratamiento control desde la concentración de 3% de PEG 6000. Los mayores valores se alcanzaron con 9% (69.4% más que en el control) con diferencias significativas con el resto de los tratamientos. En estos, los valores oscilaron entre 55.2 y 60.5% más que en el tratamiento sin estrés (Figura 4).

Por otra parte, en el cultivar ‘Pelipita’ el incremento de MDA fue significativo a partir del 5% del agente osmoestresante. Entre esta concentración y las siguientes (7 y 9%) no se observaron diferencias significativas para dicho indicador, y el incremento con respecto al tratamiento control estuvo entre 54.6 y 58.5%.
El MDA es un indicador de estrés ampliamente utilizado para la detección de plantas tolerantes al déficit hídrico. Esta sustancia es el producto final de la peroxidación lipídica, proceso que se refiere al ataque de los radicales libres originados por el estrés, a los lípidos de las membranas celulares. Aumentos de las concentraciones de MDA se asocian con un mayor daño celular por estrés oxidativo, y por el contrario, los bajos niveles se vinculan con un menor daño y por consiguiente una mayor tolerancia a la condición estresante (Wituszynska y Karpinski, 2013). De acuerdo con lo anterior los resultados mostrados para esta variable indicaron un daño por estrés oxidativo en ambos cultivares debido al estrés hídrico inducido con el PEG 6000. En ‘Grande naine’ el daño fue mayor dado porque el incremento significativo ocurrió desde la concentración más baja de PEG 6000 y continuó en ascenso hasta alcanzar un valor considerable a la mayor concentración de esta sustancia.
Por otro lado, en el cultivar ‘Pelipita’ ante un estrés hídrico inducido por 3% de PEG 6000 el daño celular no fue considerable, ya que los niveles de MDA no aumentaron significativamente con respecto al tratamiento control. Los daños en este caso comenzaron a ser significativos a partir de 5%. Esto corrobora la mayor capacidad por parte del cultivar ‘Pelipita’ para tolerar escenarios de un déficit de agua. Lo anterior también lo confirma el hecho de que entre las concentraciones superiores de PEG 6000 (5-9%) los niveles MDA no continuaron en ascenso. Probablemente en estos casos estuvieran teniendo lugar en las células los mecanismos de defensa antioxidantes que actúan para proteger las plantas contra el estrés.
Similar a estos resultados varios autores han referido incrementos de MDA en plantas in vitro de Musa spp. sometidas a estrés hídrico inducido, y han asociado los bajos niveles de esta molécula con una respuesta más tolerante (Shekhawat et al., 2014; Rustagi et al., 2015).
Para la selección in vitro de plantas tolerantes a al estrés hídrico donde sean empleados como referencia cultivares con sensibilidad y tolerancia a este factor, se debe tener en cuenta utilizar una concentración del agente osmoestresante en la cual se afecte el cultivar sensible, y el tolerante no muestre síntomas significativos de daños por el estrés. En consideración a lo anterior y de acuerdo con los resultados del presente trabajo, concentraciones superiores a 3% de PEG 6000 podrían no ser convenientes para la selección in vitro a estrés hídrico en Musa spp., si se usaran como controles de tolerancia cultivares con el genotipo ABB.
CONCLUSIONES
El cultivar de banano ‘Grande naine’ no toleró el déficit hídrico al que fue sometido en el presente estudio para las concentraciones de PEG 6000 empleadas. El cultivar ‘Pelipita’ toleró el estrés hasta 3% de esta sustancia y con concentraciones superiores se afectaron en él negativamente todas las variables evaluadas. Por lo anterior, la mínima concentración de PEG 6000 para seleccionar in vitro plantas de Musa spp. tolerantes al déficit hídrico puede ser el 3%, teniendo en cuenta como patrones de referencia los cultivares y las concentraciones utilizadas en el presente trabajo.
Arvanitoyannis IS, Mavromatis A (2009) Banana cultivars, cultivation practices, and physicochemical properties. Critical Reviews in Food Science and Nutrition 49(2): 113-135; doi:10.1080/10408390701764344
Baloglu MC, Kavas M, Aydin G, Oktem HA, Yucel AM (2012) Antioxidative and physiological responses of two sunflower (Helianthus annuus) cultivars under PEG-mediated drought stress. Turkish Journal of Biology 36(6): 707-714; doi:10.3906/bot-1111-20
Bidabadi SS, Mahmood M, Baninasab B, Ghobadi C (2012) Influence of salicylic acid on morphological and physiological responses of banana (Musa acuminata cv. ‘Berangan’, AAA) shoot tips to in vitro water stress induced by polyethylene glycol. Plant Omics Journal 5(1): 33-39; doi:10.3807/sd-1569-32
García LR, Leiva-Mora M, Carabeo PA, Collado R, Poveda MI, Veitía N, Martirena-Ramírez A, Torres D, Rivero L (2015) Efecto del estrés hídrico inducido con PEG 6000 sobre la germinación in vitro de semillas de Phaseolus vulgaris L. cv. ‘ICA Pijao’. Biotecnología Vegetal 15(4): 243-249
Kavas M, Baloglu MC, Akca O, Kose FS, Gokgay D (2013) Effect of drought stress on oxidative damage and antioxidant enzyme activity in melon seedlings. Turkish Journal of Biology 37(4): 491-498; doi:10.3906/biy-1210-55
Mahmood M, Bidabadi SS, Ghobadi C, Gray DJ (2012) Effects of methyl jasmonate treatment on alleviation of polyethylene glycol-mediated water stress in banana (Musa acuminate cv. 'Berangan‘, AAA) shoot tip cultures. Plant Growth Regulation 68(2): 161-169; doi:10.1007/s10725-012-9702-6
Mohd RI, Yusoff MK, Mahmood M (2004) Growth, water relations, stomatal conductance and proline concentration in water stressed banana (Musa spp.) plants. Asian Journal of Plant Sciences 3(6): 709-713
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15(3): 473-497; doi:10.1111/j.1399-3054.1962.tb08052.x
Muthusamy M, Uma S, Backiyarani S, Saraswathi MS (2014) Computational prediction, Identification, and expression profiling of microRNAs in banana (Musa spp.) during soil moisture deficit stress. The Journal of Horticultural Science and Biotechnology 89(2): 208-214; doi:10.1080/14620316.2014.11513070
Negi S, Tak H, Ganapathi TR (2016) Expression analysis of MusaNAC68 transcription factor and its functional analysis by overexpression in transgenic banana plants. Plant Cell, Tissue and Organ Culture 25(1): 59-70; doi:10.1007/s11240-015-0929-6
Obiefuna JC, Ndubizu TOC (1979) Estimating leaf area of plantain. Scientia Horticulturae 11(1): 31-36
Orellana PP (1994) Tecnología para la micropropagación in vitro de clones de Musa spp. Tesis en opción del Grado Científico de Doctor en Ciencias Agrícolas, Universidad Central Marta Abreu de Las Villas, Santa Clara, Cuba
Padam BS, Tin HS, Chye FY, Abdullah MI (2014) Banana by-products: an under-utilized renewable food biomass with great potential. Journal of Food Science and Technology 51(12): 3527-3545; doi:10.1007/s13197-012-0861-2
Po LO, Po EC (2012) Tropical fruits I: Banana, mango and pineapple. En: Sinha NK, Sidhu JS, Barta J, Wu JSB, Cano MP (Eds). Handbook of fruits and fruit processing, pp.565-589. John Wiley & Sons Ltd, Lowa
Rai MK, Kalia RK, Singh R, Gondola MP, Dhawan AK (2011) Developing stress tolerant plants through in vitro selection-An overview of the recent progress. Environmental and Experimental Botany 71(1): 89-98; doi:10.1016/j.envexpbot.2010.10.021
Ravi I, Subbaraya U, Muthu M, Vaganan MM, Mustaffa MM (2013) Phenotyping bananas for drought resistance. Frontiers in Physiology 4(9):1-15; doi:10.3389/fphys.2013.00009
Rustagi A, Jain S, Kumar D, Shekhar S, Jain M, Bhat V, Sarin NB (2015) High Efficiency Transformation of banana [Musa acuminata L. cv. Matti (AA)] for enhanced tolerance to salt and drought stress through overexpression of a peanut salinity-induced pathogenesis related class 10 protein. Molecular Biotechnology 57(1): 27-35; doi:10.1007/s12033-014-9798-1
Shekhawat U, Surendar K, Ganapathi TR (2014) Transgenic banana plants overexpressing MusabZIP53 display severe growth retardation with enhanced sucrose and polyphenol oxidase activity. Plant Cell, Tissue and Organ Culture 116(3): 387-402; doi:10.1007/s11240-013-0414-z
Surendar KK, Durga Devi D, Ravi I, Jeyakumar P, Velayudham K (2013) Water Stress affects plant relative water content, soluble protein, total chlorophyll content and yield of ratoon banana. International Journal of Horticulture 3(17): 12-18; doi:10.5376/ijh.2013.03.0017
Wang F, Zeng B, Sun Z, Zhu C (2009) Relationship between proline and Hg+2-induced oxidative stress in tolerant rice mutant. Archives of Environmental Contamination and Toxicology 56(4): 723-731; doi:10.1007/s00244-008-9226-2
Wareing PF, Phillips IDJ (1970) The control and development in plants. Pergamon Press, Oxford; ISBN: 19711701556
Wituszynska W, Karpinski S (2013) Programmed cell death as a response to high light, UV and drought stress in plants. En: Vahdati K, Leslie C (Eds). Abiotic Stress - Plant Responses and Applications in Agriculture, pp. 207-246. InTech Publisher, Rijeka; ISBN: 978-953-51-1024-8
Recibido: 08-02-2017
Aceptado: 20-04-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
