ARTÍCULO ORIGINAL
Biotecnología
Vegetal Vol. 14, No. 2: 99 - 105, abril - junio, 2014
ISSN
2074-8647, RNPS: 2154 (Versión electrónica)
Instituto
de Biotecnología de las Plantas. UCLV. MES.
Hongos asociados a semillas de Phaseolus vulgaris L. cultivadas en Cuba
Fungi associated with Phaseolus vulgaris L. seeds cultivated in Cuba
Einar Martínez de la Parte1*, Taimy Cantillo Pérez2, Dariel García2 Autor para correspondencia
1Instituto
de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa,
La Habana, CP 11 600. e-mail: emartinez@inisav.cu
2Laboratorio Central de Cuarentena Vegetal. Centro Nacional de Sanidad Vegetal. Ayuntamiento Nº 231 e/ San Pedro y Lombillo, Plaza de la Revolución, La Habana.
RESUMEN
El frijol común (Phaseolus vulgaris L.), es la especie de leguminosa más importante para Cuba, durante el 2012 se cosecharon en el país 123 434 ha para una producción de 127 100 toneladas del grano. La mayoría de los hongos fitopatógenos asociados al frijol emplean las semillas como vehículos de introducción en nuevas áreas donde bajo condiciones favorables pueden causar pérdidas considerables en el cultivo. El objetivo del presente trabajo fue identificar los hongos asociados a diferentes variedades de semillas de frijol así como determinar su frecuencia y grado de infección por variedad. Fueron estudiados 102 lotes de semilla de frijol, de 16 variedades provenientes de las provincias de Pinar del Río, Mayabeque y Artemisa. De cada lote se analizaron 400 semillas mediante el método de ensayo biológico de crecimiento en cámara húmeda. Se identificaron 679 aislados fúngicos pertenecientes a 34 especies de 20 géneros. Las especies de mayor frecuencia de aparición fueron Penicillium sp. (78.4%), Rhizoctonia solani (77.5%), Aspergillus niger (68.6%) y Fusarium solani (51.0%). Además, se identificaron nueve especies de Fusarium y seis de Aspergillus. Se detectó la presencia de Sclerotinia sclerotiorum en las variedades `BAT-58', `BAT-93' y `Delicia-365. De estas `BAT-93' fue en la que se detectó mayor porciento de semillas infectadas (3%). Este trabajo constituye el primer informe de la incidencia de S. sclerotiorum en semillas cubanas de frijol.
Palabras clave: Aspergillus, Fusarium, micobiota, Phaseolus, Sclerotinia
ABSTRACT
Common bean (Phaseolus vulgaris L.), is the most important legume specie for Cuba, 123 434 ha were harvested for a production of 127 100 t during 2012. Most of phytopathogenic fungi associated to beans used seeds to move their inoculum to new areas, which under favorable condition can cause considerable yield losses. The objective of the present study was to identify fungi associated with bean seeds, their frequency and incidence for bean variety. 102 seed bean lots of 16 varieties for Pinar del Río, Mayabeque and Artemisa provinces were studied. For each seed lot 400 seed were analyzed by blotter test. 679 fungal isolates belonging to 34 species of 20 genera were detected. Penicillium sp. (78.4%), Rhizoctonia solani (77.5%), Aspergillus niger (68.6%) and Fusarium solani (51.0%) were the predominant species. Nine Fusarium species and six Aspergillus species were identified. Sclerotinia sclerotiorum was detected in BAT-58, BAT-93 and Delicia-365 varieties, on which higher infected seed percent was detected in BAT-93. This paper is the first report of S. sclerotiorum incidence on Cuban seed bean.
Key words: Aspergillus, Fusarium, mycobiota, Phaseolus, Sclerotinia
INTRODUCCIÓN
El frijol común
(Phaseolus vulgaris L.), es uno de los cultivos más antiguos cosechados
en el mundo, con una gran importancia desde el punto de vista social, económico
y alimenticio en muchos países, principalmente en Centro y Suramérica
(Torres et al., 2009). Es dentro del grupo de las leguminosas comestibles,
la
especie más importante para Cuba y junto con el arroz (Oryza sativa
L.) conforma la base de la dieta diaria del cubano (Nerey et al., 2010).
Además, para el país es uno de sus principales cultivos; el tercero
con mayor área sembrada después del arroz y el maíz (Zea
mays L.). Durante el 2012 se sembraron 123 434 ha del cultivo para una producción
de 127 100 toneladas (FAOSTAT, 2014).
100 Biotecnología
Vegetal Vol. 14, No. 2, 2014
Los hongos asociados a las semillas provocan la pérdida de su calidad,
ya que afectan la viabilidad y reducen su germinación (Ghangaokar y Kshirsagar,
2013). Estos hongos inciden principalmente en el campo (fitopatógenos)
o durante su almacenamiento o conservación (de almacén). Los hongos
que contaminan las semillas en el campo usualmente permanecen inactivos durante
su almacenamiento. Sin embargo, los que inciden en almacén, producen
afectaciones debido a su capacidad de crecer en condiciones de baja humedad
en la cuales la mayoría de los hongos no consiguen desarrollarse.
La mayor parte de los hongos fitopatógenos que afectan al frijol emplean las semillas como vía de introducción en nuevas áreas donde bajo condiciones favorables pueden causar pérdidas considerables en el cultivo. A pesar de que en Cuba se han realizado varios estudios relacionados con la micobiota asociada a semillas de frijol (Sandoval y López, 2000; Díaz et al., 2005; Nerey et al., 2010), ninguno refleja la incidencia por variedad de las diferentes especies fúngicas asociadas a este tipo de semilla, lo que permitiría la selección de variedades con el objetivo de reducir la incidencia de estos patógenos y disminuir los costos de producción dirigidos al control fitosanitario.
Los objetivos del presente trabajo fueron identificar hongos asociados a semillas de frijol, así como determinar su frecuencia y grado de infección por variedad.
MATERIALES Y MÉTODOS
Material vegetal
Fueron analizados 102 lotes de semilla de frijol (Phaseolus vulgaris L.) de 16 variedades cultivadas en Cuba provenientes de las provincias de Pinar del Río, Mayabeque y Artemisa. De cada lote se analizaron 400 semillas mediante el método de ensayo biológico de crecimiento en cámara húmeda (blotter test) (ISTA, 1996).
Incidencia, aislamiento e identificación de hongos filamentosos
Las semillas fueron desinfectadas con hipoclorito de sodio (NaOCl 1%) por 1 min, colocadas en placas de Petri de 15 cm de diámetro con papel de filtro Whatman N°1, humedecido con agua destilada estéril e incubadas de 8-10 días con alternancia de luz-oscuridad (ocho horas de luz fluorescente y 16 horas de oscuridad), a 22-24ºC.
Transcurrido el período de incubación, se realizaron observaciones bajo el microscopio estereoscópico. Se observaron las características culturales de cada tipo de crecimiento fúngico y se cuantificó el número de semillas infectadas por cada uno. De todos los diferentes se realizaron aislamientos directos en medio de cultivo Agar Papa Dextrosa (PDA), se purificaron y se conservaron a 4ºC para su identificación.
Posteriormente se realizaron preparaciones microscópicas para observar los caracteres morfológicos de las estructuras vegetativas y de reproducción. La identificación se llevó a cabo mediante caracterización morfométrica y según los criterios taxonómicos descritos por Ellis (1971), Sutton (1980), Burgess et al. (2006) y Seifert et al. (2011).
Para la identificación de las especies de Fusarium, se obtuvieron cultivos monoconidiales de los diferentes aislados, los cuales se inocularon en placas con Agar Papa Dextrosa (PDA) y Agar hojas de clavel (CLA; 20 de agar en 1 litro de agua destilada y fragmentos de hojas de clavel estériles), las cuales fueron incubadas a 25ºC en la oscuridad. Transcurridos 5 días de incubación los aislados fueron caracterizados morfoculturalmente y se identificaron según los criterios taxonómicos descritos por Leslie y Summerell (2006).
A los aislados de Rhizoctonia sp. cultivados en placas con PDA se les determinó el número de núcleos presentes en las células de las hifas, para lo cual se siguió el procedimiento descrito por Saksena en 1961 (según Sneh et al., 1991): el micelio tomado de un cultivo puro fue fijado con una mezcla 3:1:1 de etanol absoluto, ácido acético glacial y ácido láctico durante 10 min., seguido de lavados con etanol al 95%, etanol al 70%, HCl 1M durante 5 minutos y HCl 1M a 60°C durante 7 min. Se lavó alternadamente cinco veces con agua destilada y tampón fosfato pH 6.9 y se colocó en una solución de colorante Giemsa y tampón fosfato (1:15) donde se mantuvo por dos horas.
Posteriormente se montó en glicerina y se observó directamente al microscopio con 400x de aumento. Estos aislados fueron caracterizados morfoculturalmente y se identificaron según los criterios taxonómicos descritos por Sneh et al. (1991).
En el caso de Aspergillus, cultivos monoconidiales de los diferentes aislados fueron inoculados en placas de Petri con Agar Czapek Extracto de Levadura (CYA; 1g de K2HPO4, 10 ml de concentrado Czapek, 5g de extracto de levadura, 30g de sacarosa, 15g de agar en 1 litro de agua destilada), CYA con 20% de sacarosa (CY20S; 1g de K2HPO4, 10 ml de concentrado Czapek, 5g de extracto de levadura, 200g de sacarosa, 15g de agar en 1 litro de agua destilada) y en Agar Extracto de Malta (AEM; 20g de extracto de malta, 1g de peptona, 20g de glucosa, 20g de agar en 1 litro de agua destilada) e incubados por 7 días en la oscuridad. Las placas con AEM y las de CY20S fueron incubadas a 25ºC, mientras que las de CYA se incubaron a 25ºC y a 37ºC, respectivamente. Posteriormente los aislados se caracterizaron morfoculturalmente y se identificaron según los criterios taxonómicos descritos por Klich y Pitt (1988).
Finalmente se calculó la frecuencia de aparición de cada especie así como su incidencia por variedad de semilla.
RESULTADOS Y DISCUSIÓN
Se identificaron un total de 679 aislados fúngicos pertenecientes a 34 especies de 20 géneros. De estas, Penicillium sp. (78.4%), Rhizoctonia solani Kühn (77.5%), Aspergillus niger van Tieghem (68.6%) y Fusarium solani (Martius) Appel & Wollenweber emend. Snyder & Hansen (51.0%) fueron las más frecuentemente observadas (Figura 1).
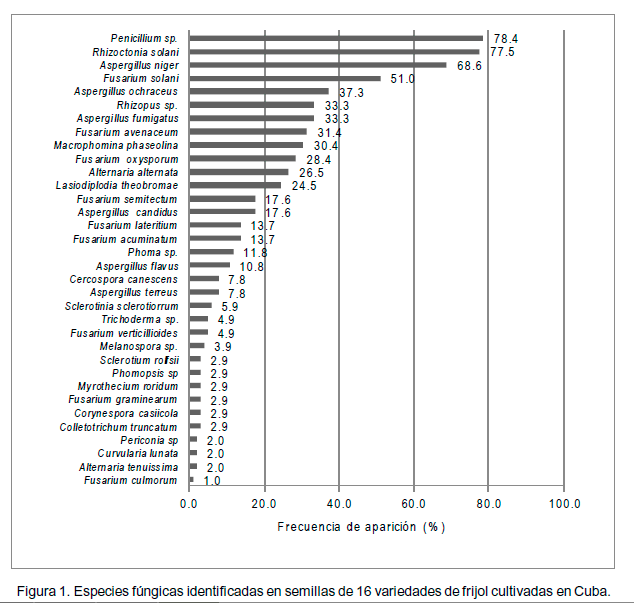
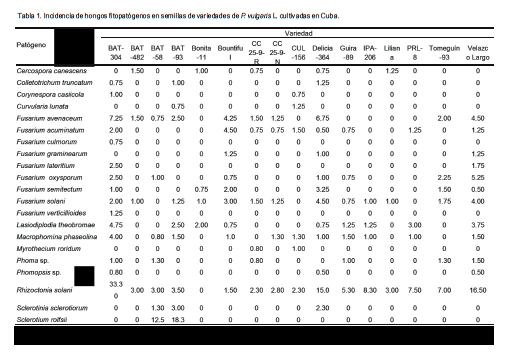
Rhizoctonia solani y Macrophomina phaseolina (Tassi) Goid detectados respectivamente en el 77.5% y 30.4% de los lotes de semilla analizados, son dos de los patógenos más importantes del frijol en Cuba (Sandoval y López, 2000; Díaz et al., 2005; Nerey et al., 2010). Con excepción de la var. `Bonita 11', R. solani fue identificada en el resto de las variedades mientras que M. phaseolina fue detectada en las var. `BAT-304', `BAT-58', `BAT-93', `Bountiful', `CC 25-9-N', `CUL-156', `Delicia-364', `Guira-89', `IPA-206', `PRL-8' y `Velazco largo' (Tabla 1), siendo en `BAT-304' donde se observó el mayor porciento de semillas infectadas por esta especie. Díaz et al. (2005) encontraron los menores valores de infección de R. solani en las variedades `BAT-58', `Güira-89' y `BAT-304'. Sin embargo, en el presente estudio, en la variedad `BAT-304' fue donde se observaron los mayores porcientos de semillas infectadas por este hongo fitopatógeno con un 33.3% (Tabla1).
Otro importante patógeno del frijol, Sclerotium rolfsii Sacc. solo fue observado en el 2% de los lotes de semilla analizados, con un porciento de semillas infectadas de 12.5% en la variedad `BAT-58' y 18.3% en `BAT-93'.
En el presente estudio se identificaron nueve especies de Fusarium, de ellas la más frecuentemente detectada fue F. solani (51.0%) seguida por F. avenaceum (Fries) Saccardo (31.4%), F. oxysporum Schlechtendahl emend. Snyder & Hansen (28.4%), F. semitectum Berkeley & Ravenel (17.6%), F. acuminatum Ellis & Everhart (13.7%), F. lateritium Nees (13.7%), F. verticillioides (Saccardo) Nirenberg (4.9%), F. graminearum Schwabe(2.9%) y F. culmorum (W.G. Smith) Saccardo (1%). A pesar de que según Farr y Rossman (2012) el frijol es hospedante de todas estas especies anteriormente mencionadas, se considera a F. solani y F. oxysporum como las especies fitopatógenas más importantes para el cultivo; la primera causa pudrición de la raíz (Sandoval y López, 2000;) y la segunda amarillamiento o marchitez (Sandoval y López, 2000; Montiel et al., 2005; Marino y Mesquita, 2009). Por otra parte, F. semitectum ha sido informado como el agente causal de la pudrición de vainas y semillas de frijol (Leslie y Summerell, 2006); mientras que F. lateritium, F. verticillioides y F. culmorum se han asociado con pudriciones en raíces de frijol (Montiel et al., 2005).
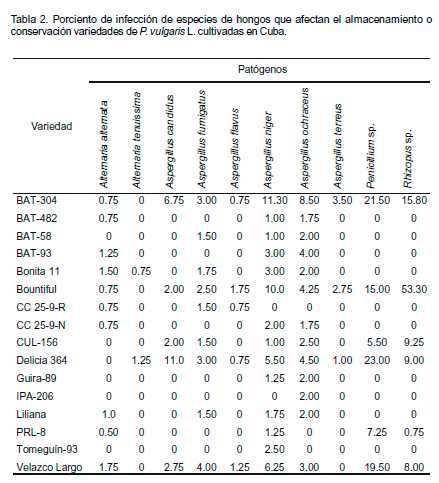
Penicillium sp., Aspergillus sp. y Alternaria sp., son considerados hongos de incidencia en almacén (Amadi y Adeniyi, 2009) los cuales no tienen gran importancia durante el ciclo del cultivo pero afectan negativamente la calidad de la semilla y su germinación. En el presente estudio Penicillium sp. fue identificado en el 78.4% de las muestras analizadas con porcientos de infección entre un 1.5-23% y alcanzó el valor máximo en la variedad `Delicia-364' (Figura 1, Tabla 2). Se detectaron dos especies de Alternaria (A. alternata y A. tenuissima) y seis de Aspergillus (Tabla 2). A pesar de que A. alternata puede ser considerado un hongo de almacén, tiene incidencia en campos de frijol y ocasiona manchas foliares (Sandoval y López, 2000).
Dentro de las especies de Aspergillus, la de mayor incidencia fue A. niger (68.6%) seguida por A. ochraceus (37.3%), Aspergillus fumigatus (33.3%), A. candidus (17.6%), Aspergillus flavus (10.8%), y A. terreus (7.8%), respectivamente. Estos resultados coinciden con lo informado por Marino y Mesquita (2009) quienes plantearon que Aspergillus y Penicillium son los hongos de almacén de mayor incidencia en semillas de frijol. Al igual que con Ghangaokar y Kshirsagar (2013) quienes afirmaron que de las especies asociadas a semillas de frijol, A. niger, A. fumigatus y A. flavus fueron de las más comúnmente detectadas. Los valores más elevados de semillas infectadas por variedad correspondieron a A. candidus en 'Delicia 364', A. fumigatus en `Velazco Largo', A. flavus en `Bountiful', A. niger, A. ochraceus y A. terreus en `BAT-304' (Tabla 2).
Todas las especies de Aspergillus identificadas en este estudio, son reconocidas como productoras de toxinas (Amadi y Adeniyi, 2009) por lo que además de afectar la germinación de las semillas o causar su pudrición pueden comprometer su consumo debido al riesgo que representan estos compuestos para la salud humana.
transmisión por semilla es una de las principales vías de dispersión
de este patógeno que presenta un muy amplio rango de hospedantes y que
constituye una de las plagas más importantes del frijol, especialmente
del cultivado en invierno y bajo riego (Parisi et al., 2006). A pesar
de que en Cuba se han realizado varios estudios relacionados con la micobiota
asociada a semillas de frijol ninguno refleja la incidencia de S. sclerotiorum
en este tipo de semilla por lo que el presente trabajo constituye el primer
informe para Cuba de la incidencia de S. sclerotiorum en semillas nacionales
de frijol.
La gran diversidad de especies de hongos asociados a semilla de frijol detectadas en este estudio; algunas de las cuales constituyen importantes fitopatógenos, demuestra la necesidad del tratamiento de semillas con
Por otra parte, se identificó Sclerotinia sclerotiorum (Lib.) de Bary, patógeno de interés cuarentenario para Cuba, que fue recientemente informado en campos de frijol de las provincias Artemisa, Mayabeque y Matanzas (Martínez et al., 2013). Esta especie fue detectada en las variedades `BAT-58', `BAT-93' y `Delicia-365' provenientes de Artemisa y Mayabeque. De estas, `BAT-93' fue en la que se observó el mayor porciento de semillas infectadas con 3% seguida por `Delicia 364' (2.25%) y `BAT-58' (1.25%) (Tabla 1). Estos valores fueron similares a los obtenidos por Parisi et al. (2006) al estudiar diferentes métodos de análisis de semilla para la detección de este patógeno. A pesar de que S. sclerotiorum, solo fue observado en el 5.9% de las muestras y con unos valores de infección relativamente bajos, su presencia en lotes de semilla es preocupante debido a que la fungicidas, como medida fundamental dentro del manejo fitosanitario del cultivo, encaminado al incremento de los rendimientos del frijol.
REFERENCIAS
Amadi, JE, Adeniyi, DO (2009) Mycotoxin production by fungi isolated from stored grains. African Journal of Biotechnology 8(7): 1219-1221
Díaz, M, Quintero E, Bernal A, Reinaldo Y (2005) Las enfermedades causadas por hongos del suelo en el cultivo del frijol común (Phaseolus vulgaris L.). Centro Agrícola 32(3): 43-46
Ellis, MB (1971) Dematiaceous Hyphomycetes. CMI. Kew Surrey
FAOSTAT (2014) Beans harvested area and production. [En línea]: http://www.fao.org/statistics. Consultado 15-01-2014
Farr, DF, Rossman AY (2014) Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. [En línea]: http://nt.ars-grin.gov/fungaldatabases/index.cfm. Consultado 15-01-2014
Ghangaokar, NM, Kshirsagar, AD (2013) Study of seed borne fungi of different legumes. Trends in Life Sciences 2(1): 32-35
ISTA (1996) International rules for seed testing. Seed Science Technology 24: 1-335
Klich, MA, Pitt JI (1988) A Laboratory Guide to the Common Aspergillus Species and their Teleomorphs. Commonwealth Scientific and Industrial Research Organization. London
Leslie, J, Summerell B (2006) The Fusarium Laboratory Manual. Blackwell Publishing. Ames
Marino, RH, Mesquita JB (2009) Micoflora de sementes de feijão comum (Phaseolus vulgaris L.) provenientes do Estado de Sergipe. Revista Brasileira de Ciências Agrárias 4(3): 252-256
Martínez-de la Parte, E, Trujillo M, Cantillo-Pérez T, García D (2013) First report of white mould of beans caused by Sclerotinia sclerotiorum in Cuba. New Disease Reports 27: 5
Montiel, L, González F, Sánchez BM, Gúzman S, Gámez FP, Acosta JA, Rodríguez R, Simpson J, Cabral M, Mendoza M (2005) Especies de Fusarium en raíces de frijol (Phaseolus vulgaris L.) con daños de pudrición, en cinco estados del centro de México. Revista Méxicana de Fitopatología 23(1): 1-7
Nerey, Y, Pannecoucque J, Hernández HP, Díaz M, Espinosa R, De Vos E, Van Beneden S, Herrera L, Höfte M (2010) Rhizoctonia spp. causing root and hypocotyl rot in Phaseolus vulgaris in Cuba. Journal of Phytopathology 158: 236-243
Parisi, JJD, Patrício FRA, Oliveira SHF (2006) Modification of the paper towel seed health test for the detection of Sclerotinia sclerotiorum in bean seeds (Phaseolus vulgaris L.). Summa Phytopathologica 32(3): 288-290
Sandoval, I, López MO (2000) Micobiota del cultivo del frijol (Phaseolus vulgaris L.) en Cuba. Fitosanidad 4(3-4): 15-21
Seifert, KA, Morgan-Jones G, Gams W, Kendrick B (2011) The Genera of Hyphomycetes. CBS Biodiversity Series 10.CBS-KNAW Fungal Biodiversity Center. Otawa
Sneh, B, Burpee L, Ogoshi A (1991) Identification of Rhizoctonia species. APS Press. St. Paul
Sutton, BC (1980) The Coelomycetes. Surrey, CABI Publications. London
Torres, AR, Cursino L, Muro-Abad JI, Gomes EA, Araujo EF, Hungria M, Alves ST (2009) Genetic diversity of indigenous common bean (Phaseolus vulgaris L.) rhizobia from the state of Minas gerais, Brazil. Brazilian Journal of Microbiology 40: 852856
Recibido: 20-02-2014
Aceptado:
31-03-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
