Artículo original
Biotecnología Vegetal Vol. 17, No. 2: 135 - 141, abril - junio, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto de edulcorante a base de Stevia rebaudiana en el cultivo in vitro de Cuitlauzina pendula
Effect of Stevia rebaudiana based sweetener on Cuitlauzina pendula in vitro culture
Juan Christian Altamirano López, Agustín Iván Cabezas Aguilar, David García Hernández
Universidad Tecnología de Morelia. Calle vicepresidente Pino Suárez No 750. Col Ciudad industrial. Morelia Michoacán de Ocampo. México. CP 58 200. e-mail: ing_agustin_utm@hotmail.com
RESUMEN
El cultivo in vitro es una alternativa para la conservación de orquídeas (Orchidaceae) amenazadas. El objetivo de este trabajo fue determinar el efecto de un edulcorante a base de Stevia rebaudiana sobre el desarrollo de plántulas y formación de pseudobulbos en Cuitlauzina pendula. Las semillas se germinaron en medio de cultivo MS sin reguladores de crecimiento. Las plántulas obtenidas se subcultivaron en un medio de cultivo MS con las sales al 100%, 1 g l-1 de carbón activado y 0.5 ml de 6-bencilaminopurina y se adicionaron diferentes concentraciones del edulcorante CANDEREL® stevia (5,10, 15, 20, 25 g l-1). Se usó un control que contenía sacarosa (25 g l-1) como fuente de carbono. Se midió la altura de las plántulas (cm) y se observó la presencia de pseudobulbos en cada tratamiento. La presencia del edulcorante en el medio de cultivo de 5 a 25 g l-1 no tuvo influencia en la altura de las plántulas. Las plántulas cultivadas con el edulcorante y el control con sacarosa desarrollaron pseudobulbos in vitro pero concentraciones superiores a 5 g l-1 se favoreció la formación de estas estructuras con respecto al control. El edulcorante CANDEREL® stevia puede ser utilizado como fuente alternativa de carbono en el cultivo in vitro de Cuitlauzina pendula ya que no afecta la altura de las plantas y favorece la formación de pseudobulbos. Este es el primer informe donde se utiliza como fuente de carbono un producto de stevia en el cultivo in vitro de orquídeas.
Palabras clave: carbohidratos, orquídea, pseudobulbos
ABSTRACT
In vitro culture is an alternative for the conservation of endangered orchids (Orchidaceae). The objective of this work was to determine the effect of a Stevia. rebaudiana sweetener based on the development of seedlings and pseudobulbs formation in Cuitlauzina pendula. The seeds were germinated in MS culture medium without growth regulators. The seedlings obtained were subcultured in an MS culture medium with 100% salts, 1 g l-1 activated charcoal and 0.5 ml 6-benzylaminopurine and different concentrations of the sweetener CANDEREL® stevia (5.10, 15, 20, 25 g l-1). A control containing sucrose (25 g l-1) was used as the carbon source. The height of the seedlings (cm) was measured and the presence of pseudobulbs was observed in each treatment. The presence of the sweetener in the culture medium of 5 to 25 g l-1 had no influence on the height of the seedlings. Seedlings cultured with sweetener and control with sucrose developed pseudobulbs in vitro but concentrations higher than 5 g l-1 favored the formation of these structures with respect to the control. The sweetener CANDEREL® stevia can be used as an alternative carbon source in the in vitro culture of Cuitlauzina pendula as it does not affect the height of the plants and favors the pseudobulbs formation. This is the first report where a stevia product is used as the carbon source in the in vitro culture of orchids.
Keywords: carbohidrate, orchid, pseudobubls
INTRODUCCIÓN
La familia Orchidaceae es una de los más grandes del Reino Plantae. Estimaciones sugieren que deben existir entre 20 000 y 30 000 especies (Hagsater et al., 2005). La mayoría son plantas epífitas, algunas son terrestres y otras son litofíticas (Damon, 2006). Las orquídeas son consideradas como una de las flores más hermosas a nivel mundial.
Cuitlauzina pendula La Llave & Lex. (1825) es una planta endémica de México, su distribución abarca desde el sureste del país, la sierra madre occidental y la Sierra Madre del sur. Se han encontrado en bosques de robles, en los estados de Jalisco, Nayarit, Michoacán, México, Guerrero y Oaxaca, desde los 1400 a 2300 metros sobre el nivel del mar (Jenny, 2007). Es una de las orquídeas más conocidas por la población local, tiene el nombre común de chorrito. Grandes cantidades de C. pendula son ofrecidos cada año en los mercados de las ciudades del sur del país (Soto y Solano, 2007). Esto ha ocasionado que esta orquídea de acuerdo con la norma oficial mexicana NOM-059-SEMARNAT-2010 (NOM-059-SEMARNAT, 2010) se considere una especie amenazada.
Otra desventaja para la conservación de las orquídeas es que sus semillas se caracterizan por ser diminutas y carecer de endospermo (Aguilar y López, 2013). El cultivo in vitro es una alternativa de conservación que incrementa el porcentaje de germinación de las semillas (Flores-Escobar et al., 2011; Salazar y Orlando, 2012; Zhao et al., 2013; Afraire et al., 2015; Bertolini et al., 2014).
Para el desarrollo de las orquídeas en cultivo in vitro la fuente de carbono es muy importante (Harvais y Hadley, 1967). Se conoce que la glucosa en diferentes concentraciones favorece el crecimiento in vitro de orquídeas (Hong et al., 2008). Otros estudios informan del uso de fructuosa y sacarosa (Faria et al., 2004; Murdad et al., 2010; Rafique et al., 2013). La concentración de los carbohidratos también favorece la formación de callos para regenerar plantas por embriogénesis u organogénesis indirecta (Tokuhara y Mii, 2003; Rafique et al., 2013).
Varios autores mencionan que los pseudobulbos son una fuente de almacenamiento de carbohidratos, los cuales son utilizados por las orquídeas cuando se encuentran bajo condiciones de estrés para la formación de nuevos brotes e inflorescencias (Zimmerman y Whigham, 1992; Vaz et al., 1998; Yew y Sin, 2000; Cesare et al., 2001; Jin et al., 2013). En este sentido, Vaz et al. (1998) determinaron que los carbohidratos solubles en agua representaron una alternativa de reserva en los pseudobulbos de Catasetum fimbriatum (C.Morren) Lindl., siendo los glucomananos el principal carbohidrato de las plantas jóvenes con el 70% del total.
Los extractos de stevia (Stevia rebaudiana Bertoni), contienen un alto nivel de compuestos edulcorantes (esteviósido y rebaudiósido A), conocidos como glucósidos de esteviol. Son termoestables incluso a temperaturas de hasta 200 °C. Se cree que poseen actividad antioxidante, antimicrobiana y antifúngica (Lemus et al., 2012). Texeira (2015) informó del uso de un extracto de hojas frescas de S. rebaudiana en el cultivo in vitro de Syngonium podophyllum L. Resultó en pobre crecimiento de las plantas posiblemente atribuido a la baja concentración usada. Su uso como fuente de carbono en el medio de cultivo para la germinación in vitro de semillas de orquídeas podría ser una alternativa al empleo de sacarosa y permitir el desarrollo de las plántulas. Atendiendo a lo anterior, el objetivo del trabajo fue determinar el efecto in vitro de un edulcorante a base de S. rebaudiana sobre el crecimiento de plántulas y formación de pseudobulbos en Cuitlauzina pendula. Este es el primer informe donde se utiliza como fuente de carbono un producto de stevia en el cultivo in vitro de orquídeas.
MATERIALES Y METODOS
Material vegetal
Se emplearon semillas de orquídea C. pendula que fueron donadas de una colección privada de la ciudad de Morelia, México.
Obtención de plántulas
A las semillas se les dio un tratamiento de desinfección de acuerdo con el método propuesto por SEMARNAT (2011) y en la campana de flujo laminar se colocaron en un medio de cultivo MS (Murashige y Skoog, 1962) sin reguladores de crecimiento. Aproximadamente 0.5 g de semillas fueron distribuidas en tres frascos de vidrio tipo Gerber®. Los frascos de cultivo con las semillas de C. pendula se ubicaron a 27°C, 16 horas de luz y 8 de oscuridad. Las plántulas se mantuvieron en este medio de cultivo hasta obtener una altura promedio de 1.4 cm.
Efecto de la adición de edulcorante a base de S. rebaudiana en el medio de cultivo
Las plántulas obtenidas se subcultivaron en un medio de cultivo MS con las sales al 100%, 1 g l-1 de carbón activado y 0.5 ml de 6-bencilaminopurina (BAP). El pH fue ajustado a 5.7 antes de la esterilización y se adicionaron diferentes concentraciones del edulcorante a base de S. rebaudiana (CANDEREL® stevia, composición: azúcar 1.45 g 100 g-1 de producto y rebaudiósido A 0.40 g 100 g-1 de producto) (5,10, 15, 20, 25 g l-1). Se usó un control que contenía sacarosa (25 g l-1) como fuente de carbono.
Todos los medios de cultivo utilizados en los tratamientos se esterilizaron en autoclave (1 atm de presión/15min/121°C). Cada tratamiento consistió en un total de ocho frascos con cinco plántulas cada uno. Estos se mantuvieron a 27°C, 16/8 h de luz/oscuridad durante 30 días. Después de este periodo se tomaron tres muestras por tratamiento durante 10 semanas, se midió la altura de las plántulas (cm) y se observó la presencia de pseudobulbos en cada tratamiento.
Análisis estadístico
Los datos se sometieron a análisis de normalidad y homogeneidad de varianzas con prueba de Bartlett. Se llevó a cabo un ANOVA simple y las medias se compararon mediante la prueba Tukey con una p≤0.05. Los datos se procesaron mediante el software STATGRAPHICS Centurion XV Versión 15.2.06.
RESULTADOS Y DISCUSIÓN
Después de 8 meses in vitro, a partir de las semillas germinadas se obtuvieron 180 plántulas con una altura promedio de 1.4 cm (Figura 1).

La presencia del edulcorante en el medio de cultivo de 5 a 25 g l-1 no tuvo influencia en la altura de las plántulas. No se encontraron diferencias significativas con respecto al control con sacarosa en las evaluaciones realizadas (Figura 2). Este aspecto indicó que la incorporación del edulcorante al medio de cultivo puede ser una alternativa para el crecimiento de las plántulas de esta especie de orquídea.
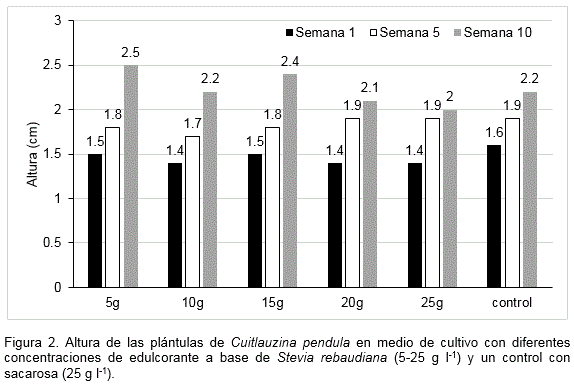
Por otra parte, las plántulas cultivadas con las diferentes concentraciones del edulcorante y el control con sacarosa desarrollaron pseudobulbos in vitro. A partir de la semana 5 y hasta la semana 10 de cultivo se apreciaron en los tratamientos con el producto a base de S. rebaudiana (Figura 3).

La presencia del edulcorante en el medio de cultivo en los tratamientos con concentraciones superiores a 5 g l-1 favoreció la formación de pseudobulbos. A excepción de este tratamiento, en el resto, el número de estas estructuras sobrepasó al control con sacarosa (Figura 4).
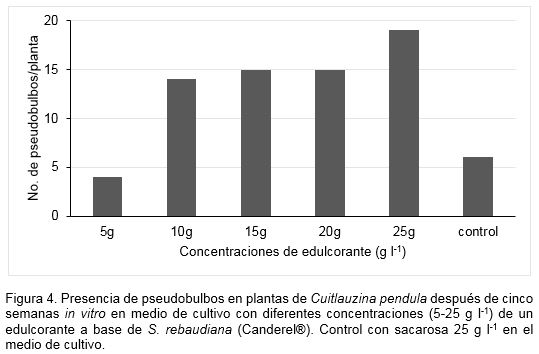
Vaz et al. (1998), mencionaron que las plantas jóvenes almacenan el 70% de los carbohidratos en los pseudobulbos. Los glucósidos contenidos en el edulcorante, donde el Rebaudiósido A tiene la mayor proporción, pudieron haber sido asimilados por las plántulas y esto ayudó a la formación de los pseudobulbos y posiblemente a la acumulación de sustancias de reserva. En el cultivo in vitro de otras plantas ornamentales se ha comprobado que los niveles elevados de carbohidratos como glucosa, fructuosa o sacarosa inducen la formación de órganos de almacenamiento. Especialmente, la glucosa puede actuar como molécula señal ya que las hexosas son consideradas como un regulador de muchos procesos biológicos (Koch, 1996; Podwyszynska, 2012).
Sin embargo, se requieren otros estudios que permitan dilucidar el papel de estas sustancias en la morfogénesis de los pseudobulbos de C. pendula quizás vinculado al mayor número de moléculas de glucosa presentes en el edulcorante, su solubilidad en el medio de cultivo o al potencial osmótico. El incremento de la osmolaridad del medio de cultivo y la adición de fuentes metabolizables de carbono estimula la formación de bulbos independientemente del tipo de carbohidrato (Koch, 1996). Según Yaseen et al. (2013) en sistemas de micropropagación el potencial morfogenético de los tejidos de las plantas puede ser manipulado por variaciones en el tipo y concentración de fuentes de carbono.
CONCLUSIONES
El edulcorante a base de S. rebaudiana CANDEREL® stevia puede ser utilizado como fuente alternativa de carbono en el cultivo in vitro de Cuitlauzina pendula ya que no afecta la altura de las plantas y favorece la formación de pseudobulbos.
AGRADECIMIENTOS
Al programa CONACYT-FORDECYT-SICDET del Gobierno del Estado de Michoacán por el apoyo económico otorgado para la realización de este proyecto y a Karen Monserrat Rodríguez Solís, Ricardo Santillán Mendoza y Amelia Cristina Montoya Martínez por su apoyo otorgado.
REFERENCIAS
Afraire L, Borges V, Galdi B, Fernanda F, Aguiar T, Ferreira S. Campos O (2015) In vitro propagation of Cyrtopodium saintlegerianum rchb. f. (orchidaceae), a native orchid of the Brazilian Savanna. Crop Breeding and Applied Biotechnology 15(1): 10-17; doi:10.1590/1984-70332015v15n1a2
Aguilar M, López A (2013) Germinación in vitro de Laelia speciosa (Kunth) Schltr, una herramienta para su conservación ex situ. En: Pulido-Flores G y Scoot M (eds). Estudios científicos en el estado de Hidalgo y zonas aledañas, pp. 18-24. Zea Books, Lincoln
Bertolini V, Damon A, Rojas A (2014) Quelato de hierro y agua de coco en la germinación in vitro de Rossioglossum grande (Orchidaceae). Acta Agronómica 63(3): 229-237; doi:10.15446/acag.v63n3.42735
Cesare G, Mazzaferab P, Silveira M (2001) Effect of a drought period on the mobilisation of non-structural carbohydrates, photosynthetic efficiency and water status in an epiphytic orchid. Plant Physiology and Biochemistry 39(11): 1009−1016; doi:10.1016/S0981-9428(01)01321-3
Damon A (2006) Cultivo rústico y sustentable de orquídeas nativas del Soconusco. Fundación produce Chiapas, Chiapas
Faria R, Rodrigues F, Oliveira L, Müller C (2004) In vitro Dendrobium nobile plant growth and rooting in different sucrose concentration. Horticultura Brasileira 22(4): 780-783; doi:10.1590/S0102-05362004000400023
Flores-Escobar G, Gil I, Colinas M, Mata M (2011) Propagación in vitro de la orquídea Brassia verrucosa bateman ex. Lind. Revista Chapingo Serie Horticultura 17(1): 5-8
Harvais G, Hadley G (1967) The development of Orchis purpurella in asymbiotic and inoculated cultures. New Phytologist 66(2): 217-230
Hagsater E, Soto M, Salazar G, Jiménez R, López M, Dressler L (2005) Las orquídeas de México. Productos Farmacéuticos, México; ISBN: 968-7889-07-1
Hong P, Chen J, Chang W (2008) Promotion of direct somatic embryogenesis of Oncidium by adjusting carbon sources. Biologia Plantarum 52(3): 597-600; doi:10.1007/s10535-008-0119-z
Jenny R (2007) Cuitlauzina pendula History and Culture of an Orchid Described in 1825. Disponible en: https://aos.org/am/images/pdf/cuitlauzina_pendula.pdf. Consultado 22/12/2016
Jin Y, Jae H, Sun K (2013) Carbohydrate changes in Cymbidium ‘Red Fire’ in response to night interruption. Scientia Horticulturae 162: 82–89; doi:10.1016/j.scienta.2013.07.045
Koch KE (1996) Carbohydrate regulated gene expression in plants. Annual Review of Plant Physiology and Plant Molecular Biology 47: 509-540; doi:10.1146/annurev.arplant.47.1.509
Lemus R, Vega A, Zura L, Ah L (2012) Stevia rebaudiana Bertoni, source of a high-potency natural sweetener: A comprehensive review on the biochemical, nutritional and functional aspects. Food Chemistry 132(1): 1121–1132; doi:10.1016/j.foodchem.2011.11.140
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiology plant 15(3): 473-497; doi:10.1111/j.1399-3054.1962.tb08052.x
Murdad R, Latip M, Abdul Z, Ripin R (2010) Effects of carbon source and potato homogenate on in vitro growth and development of Sabah’s Endangered orchid: Phalaenopsis gigantea. Asia-Pacific Journal of Molecular Biology and Biotechnology 18(1): 199-202
NOM-059-SEMARNAT (2010) NOM-059-SEMARNAT-2010 Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial, México DF
Rafique R, Fatima B, Usma M, Iqbal M, Hassan S, Shabbir K, Rasheed M (2013) Effect of sucrose on in vitro callogenesis, embryogenesis and organogenesis of Dendrobium sabin H. International Journal of Modern Agriculture 2(1): 43-47
Salazar S, Orlando G (2012) Evaluación del efecto de dos suplementos orgánicos en la germinación in vitro de orquídeas nativas de la provincia de Pamplona, Colombia. Revista Colombiana de Biotecnología 14(1): 53-59
SEMARNAT (2011) Manual para la propagación de orquídeas. Gobierno federal, México
Soto M, Solano A (2007) Ficha técnica de Cuitlauzina pendula. En: Soto- Arenas M A (ed). Información actualizada sobre las especies de orquídeas del PROY- NOM-059-ECOL-2000, pp. 1-9. Instituto Chinoin AC Herbario de la Asociación Mexicana de Orquideología AC Bases de datos SNIB-CONABIO Proyecto W029, México
Tokuhara K, Mii M (2003) Highly-efficient somatic embryogenesis from cell suspension cultures of phalaenopsis orchids by adjusting carbohydrate sources. In Vitro Cellular, Developmental Biology Plant 39(6): 635–639; doi:10.1079/IVP2003466
Vaz A, Kerbauy G, Figueiredo R (1998) Changes in soluble carbohydrates and starch partitioning during vegetative bud formation from root tips of Catasetum fimbriatum (Orchidaceae). Plant Cell, Tissue and Organ Culture 54(2): 105–111; doi:10.1023/A:1006179404376
Yaseen M, Touqeer A, Gaurav S, Alvaro S, Ahmad H (2013) Review: role of carbon sources for in vitro plant growth and development. Molecular Biology Reports 40(4): 2837–2849; doi:10.1007/s11033-012-2299-z
Yew C, Sin C (2000) Orchid pseudobulbs - "falseʺ bulbs with a genuine importance in orchid growth and survival. Scientia Horticulturae 83(3): 165-172; doi:10.1016/S0304-4238(99)00084-9
Zimmerman J, Whigham D (1992) Ecological Functions of Carbohydrates Stored in Corms of Tipularia discolor (Orchidaceae). Functional Ecology 6(5): 575-58; doi:10.2307/2390055
Zhao D, Hu G, Chen Z, Shi Y, Zheng L, Tang A, Long C (2013) Micropropagation and in vitro flowering of Dendrobium wangliangii: a critically endangered medicinal orchid. Journal of Medicinal Plants Research 7(28): 2098-2110; doi:10.5897/JMPR11.1777
Recibido: 31-03-2017
Aceptado: 10-05-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
