Artículo original
Biotecnología Vegetal Vol. 17, No. 3: 181 - 190, julio - septiembre, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Efecto de parámetros que intervienen en la transformación vía Agrobacterium tumefaciens en la regeneración de Phaseolus vulgaris L. cultivares 'ICA Pijao' y 'BAT 93'
Effect of parameters involved in the transformation via Agrobacterium tumefaciens in the regeneration of Phaseolus vulgaris L. cultivars 'ICA Pijao' and 'BAT 93'
Dianella Iglesias1,2, Lyselle Ruiz de León2, Damaris Torres1, Raúl Collado1
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: raulc@ibp.co.cu
2Departamento de Biología, Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: diglesias@uclv.cu
RESUMEN
Phaseolus vulgaris L. es un cultivo muy empleado en el consumo humano. Su producción se encuentra afectada por la incidencia de factores bióticos y abióticos. La transformación genética brinda la posibilidad de reducir estas afectaciones, pero la baja eficiencia en la regeneración in vitro constituye una limitante para el desarrollo de protocolos para la obtención de plantas transformadas en esta especie. El objetivo de este trabajo fue determinar el efecto de la concentración de la suspensión bacteriana, el tiempo de infiltración por vacío y de co-cultivo en la regeneración de brotes de P. vulgaris en los cultivares 'ICA Pijao' y 'BAT 93'. Callos nodulares verdes se inocularon con una suspensión de A. tumefaciens ajustada a DO600 de 0.1, 0.2 y 0.3. Se evaluaron tres tiempos de infiltración por vacío: 1, 2 y 3 min y tiempos de co-cultivo de tres y cinco días. La concentración de la suspensión bacteriana, el tiempo de infiltración por vacío y el período de co-cultivo afectan la regeneración de brotes de P. vulgaris cv. 'ICA Pijao' y 'BAT 93'. Los mayores porcentajes de regeneración de brotes de P. vulgaris se lograron al inocular los callos con una suspensión bacteriana ajustada a DO600=0.1, sin infiltración con vacío y 3 días en co-cultivo. Los resultados de esta investigación constituyen los primeros aportes a la comunidad científica en demostrar el efecto de la infiltración por vacío en la regeneración de tejido de P. vulgaris inoculado con A. tumefaciens.
Palabras clave: co-cultivo, infiltración por vacío, regeneración, suspensión bacteriana
ABSTRACT
Phaseolus vulgaris is a crop widely used in human consumption. Its production is affected by the incidence of biotic and abiotic factors. Genetic transformation provides the possibility of reducing these affections, but the low efficiency in vitro regeneration constitutes a limiting factor for the development of protocols for obtaining plants transformed in this species. The aim of this work was to determine the effect of bacterial suspension concentration, vacuum infiltration time and co-culture on the regeneration of P. vulgaris shoots in 'ICA Pijao' and 'BAT 93' cultivars. Green nodular calli were inoculated with a suspension of A. tumefaciens at a DO600 0.1, 0.2 and 0.3. Three times of infiltration by vacuum were evaluated: 1, 2 and 3 min and co-culture period of three and five days. The concentration of the bacterial suspension, the vacuum infiltration time and the co-culture period affected the regeneration of shoots of P. vulgaris cv. 'ICA Pijao' and 'BAT 93'. The highest percentages of P. vulgaris shoot regeneration were achieved by inoculating the calli with a bacterial suspension adjusted at DO600=0.1, without vacuum infiltration and 3 days in co-culture. The results of this research constitute the first contributions to the scientific community in show the effect of vacuum infiltration on the regeneration of P. vulgaris tissue inoculated with A. tumefaciens.
Keywords: co-culture, vacuum infiltration, regeneration, bacterial suspension
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.) es una de las leguminosas más empleadas en el consumo humano en todo el mundo (Lanna et al., 2016). Esta especie se cultiva en hábitats muy diversos por lo que se enfrenta a condiciones ambientales que disminuyen su productividad, así como a la incidencia de plagas y enfermedades (Nanjareddy et al., 2016).
La biotecnología vegetal puede facilitar la generación de cultivares de P. vulgaris con tolerancia o resistencia a condiciones ambientales desfavorables (Kwapata et al., 2012). En este sentido, la transformación genética vía Agrobacterium tumefaciens representa una alternativa viable para incrementar la diversidad genética de esta especie (Mukeshimana et al., 2013).
La transformación genética vía A. tumefaciens en P. vulgaris se dificulta debido a que los protocolos existentes se han desarrollado en cultivares específicos. Además, existe una escasa estandarización de parámetros que pueden incrementar la transferencia de ADN como la concentración de la suspensión bacteriana, el periodo de co-cultivo (Martirena-Ramírez y Veitía, 2013) y la infiltración por vacío (Nanjareddy et al., 2016).
Collado et al. (2015) establecieron un protocolo de transformación genética vía A. tumefaciens para el cultivar 'CIAP7247F'. Este fue probado en otros cultivares de interés comercial como 'ICA Pijao' y 'BAT 93'. Sin embargo, su aplicación se vio limitada debido a la naturaleza genotipo dependiente de la respuesta in vitro de P. vulgaris. Por esta razón, aún es un propósito de los programas de mejoramiento genético establecer un protocolo de transformación vía A. tumefaciens eficiente, reproducible y rutinario que pueda ser adaptado a los diferentes cultivares.
El desarrollo de un evento de transformación genética depende en gran parte del establecimiento de un sistema de regeneración in vitro eficiente (Espinosa-Huerta et al., 2013). La regeneración a partir del cultivo de tejidos en P. vulgaris se ha mejorado en los últimos años. Sin embargo, los efectos del genotipo en la capacidad regenerativa, así como la eficiencia y la reproductibilidad han sido factores limitantes (Chandel y Pandey, 2014).
Teniendo en cuenta la problemática expuesta con anterioridad, el objetivo de este trabajo fue determinar el efecto de la concentración de la suspensión bacteriana, el tiempo de infiltración por vacío y el periodo de co-cultivo en la regeneración de brotes de P. vulgaris cv. 'ICA Pijao' y 'BAT 93'.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon semillas maduras de P. vulgaris cv. 'ICA Pijao' y 'BAT 93', provenientes del banco de germoplasma del Centro de Investigaciones Agropecuarias (CIAP), de la Universidad Central "Marta Abreu" de Las Villas.
Desinfección y germinación de las semillas
Las semillas se lavaron con una solución de detergente y agua común durante 10 min. Luego se enjuagaron con agua común y se desinfectaron en etanol al 70% (v/v) por 20 s y se transfirieron a una solución de hipoclorito de sodio (NaOCl) al 3% (v/v) durante 10 min. Posteriormente, fueron enjuagadas tres veces con agua desionizada estéril. Se colocaron en medio de cultivo de germinación (MG, Tabla 1). El material vegetal se mantuvo a 27 ± 2 °C en oscuridad total durante tres días para la germinación.
Formación de callos
Para la obtención de los explantes iniciales, posterior a la germinación se eliminó la testa y la raíz según el protocolo descrito por Collado et al. (2013). En el cultivar 'ICA Pijao' se realizó una herida en la unión de uno de los cotiledones con el eje embrionario y se separó el cotiledón, el eje embrionario con un cotiledón se utilizó como explante inicial para la formación de callos. En el cultivar 'BAT 93' se emplearon los dos cotiledones con el nudo cotiledonal. Los explantes se transfirieron a un medio de cultivo de formación de callos (MFC, Tabla 1) y se mantuvieron en cámaras de cultivo a 27 ± 2 °C, durante los primeros siete días en oscuridad. Luego, se eliminaron los brotes, se transfirieron nuevamente a MFC y se colocaron en una cámara de crecimiento con un fotoperíodo de 16 h luz/8h oscuridad y una intensidad luminosa de 45 µmol m-2 s -1 durante 21 días. Transcurrido este periodo, los callos nodulares verdes fueron separados del explante inicial sin ser fraccionados.
Preparación de la suspensión bacteriana
La cepa de A. tumefaciens C58C1RifR, que contiene el plásmido (pTJK136 MtDHDPS3) conservada en glicerol, se inoculó por agotamiento por estrías en una placa de Petri de 90 mm de diámetro con medio de cultivo Luria-Bertani (LB, Tabla 1) semisólido con antibióticos (Espectinomicina 100 mg l -1, Estreptomicina 300 mg l -1, Gentamicina 50 mg l -1 y Rifampicina 50 mg l -1). Las placas se incubaron a 28 °C durante 48 h en oscuridad.
Una colonia de A. tumefaciens aislada del cultivo fresco se suspendió en 3 ml de medio de cultivo LB líquido con los antibióticos mencionados con anterioridad y se incubó a 28 °C en agitación constante (120 rpm) durante 24 h. El cultivo crecido (50-100 µl) se transfirió a un Erlenmeyer de 250 ml de capacidad con 50 ml de medio de cultivo YEP (por sus siglas del inglés: Yeast Extract Peptone) (Tabla 1) con los mismos antibióticos. Este se incubó bajo las condiciones anteriormente mencionadas durante 12 h (DO600 entre 0.7 y 1.2, ~1x109 ufc ml -1). Alícuotas de 45 ml del cultivo de A. tumefaciens se centrifugaron a 5000 rpm a 21 °C por 10 min. El pellet se lavó en un medio de cultivo líquido de inoculación de la bacteria (MIB, Tabla 1). Después de la centrifugación, el pellet lavado se resuspendió en 45 ml de MIB y se centrifugó una vez más en las condiciones descritas. La suspensión bacteriana se diluyó en MIB hasta alcanzar la DO600 deseada.
Inoculación y co-cultivo
Para la inoculación y el co-cultivo se siguió el protocolo descrito por Collado et al. (2015). Se realizaron tres experimentos independientes y consecutivos para determinar el efecto de la concentración de la suspensión bacteriana, el tiempo de infiltración por vacío y el periodo de co-cultivo en la regeneración de brotes.
En todos los tratamientos, para la inoculación y co-cultivo, 50 callos nodulares verdes de cada cultivar con 30 ml de la suspensión de A. tumefaciens se colocaron en Erlenmeyers de 250 ml de capacidad. En los controles donde los explantes no se inocularon con la bacteria se empleó un número de muestras similar. Para cada tratamiento se emplearon tres réplicas y los experimentos se repitieron dos veces.
En los tres experimentos, los callos inoculados se enjuagaron tres veces con MIB al que se le adicionó Timentina (200 mg l-1). Se secaron sobre papel de filtro estéril y se transfirieron a MMC con Timentina (200 mg l-1) durante siete días a 25±2°C y fotoperiodo de 16 h luz/8h oscuridad y una intensidad luminosa de 45 µmol m-2s-1 para su recuperación. Posteriormente los callos se colocaron sobre medio de cultivo para la regeneración de brotes con 200 mg l -1 de Timentina (MRBT, Tabla 1) y se mantuvieron en similares condiciones durante 10 días. Transcurrido este período los callos se subcultivaron a MRBT nuevamente donde permanecieron en las condiciones de cultivo anteriormente descritas hasta los 21 días después de la recuperación.
En el primer experimento, durante la inoculación se estudiaron tres concentraciones de la suspensión bacteriana (ajustada a DO600 de 0.1, 0.2 y 0.3). Se empleó un control de explantes sin inocular con la bacteria. Se empleó un tiempo de co-cultivo de cinco días. Se seleccionó la concentración donde se obtuvo un mayor porcentaje de regeneración de brotes.
En el segundo experimento los explantes fueron inoculados con A. tumefaciens a la concentración de la suspensión bacteriana seleccionada en el experimento anterior y se probaron tres tiempos de infiltración por vacío: 1, 2 y 3 min, con un régimen de presión de 60-70 mm de Hg en una bomba de vacío. Se utilizaron dos controles: un control que se inoculó con la bacteria, al cual no se le aplicó vacío y otro control sin inocular. Se empleó un tiempo de co-cultivo de cinco días. Se seleccionó el tratamiento donde se obtuvo un mayor porcentaje de regeneración de brotes.
En el tercer experimento se estudiaron periodos de co-cultivo de tres y cinco días, durante los cuales las placas se incubaron a 22 ± 2 °C en oscuridad. En este experimento se empleó un control sin inocular con A. tumefaciens, la concentración de la suspensión bacteriana seleccionada en el primer experimento y el tratamiento seleccionado en el segundo experimento.
En todos los experimentos, se realizó la primera evaluación durante el primer sub-cultivo a los 10 días posteriores a la recuperación y la segunda a los 21 días en regeneración, durante el segundo sub-cultivo. Se analizó en cada caso la regeneración a partir del número de explantes (callos) que formaron al menos un brote. Se calculó el porcentaje de regeneración.

Procesamiento estadístico
Los datos fueron analizados con el paquete estadístico PASW Statistics, versión 23, para Windows verificándose los supuestos de normalidad mediante la prueba Sapiro Wilk. Los datos que no seguían distribución normal se procesaron mediante análisis de varianza para dos variables no relacionadas, U de Mann Whitney y varias muestras independientes, H de Kruskal Wallis. En todos los casos las diferencias se consideraron significativas para un valor de p<0.05.
RESULTADOS Y DISCUSIÓN
En el cultivar 'ICA Pijao', la inoculación con A. tumefaciens afectó la regeneración de brotes pues existieron diferencias significativas entre los tratamientos y el control. En el primer período de sub-cultivo, al aumentar la concentración de la suspensión bacteriana disminuyó el porcentaje de regeneración de brotes. En el segundo período de sub-cultivo no se encontraron diferencias significativas entre los porcentajes de regeneración para la inoculación con la suspensión bacteriana ajustada a DO600=0.1 y 0.2, pero fueron inferiores al 10% con la mayor concentración celular (Figura 1).
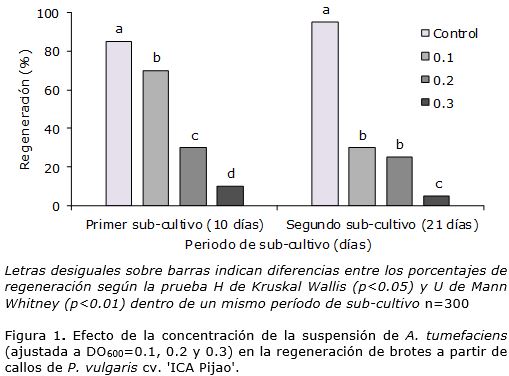
Es importante destacar que durante el segundo período de cultivo de los callos en MRBT, se observó sobrecrecimiento de A. tumefaciens, ello impidió la formación de brotes y causó la mortalidad de brotes que anteriormente habían regenerado, lo que disminuyó el porcentaje de explantes regenerados en el segundo subcultivo con respecto al primero.
En el cultivar 'BAT 93' la inoculación con A. tumefaciens también afectó la regeneración de brotes pues existieron diferencias significativas entre los tratamientos y el control. Cuando se aplicó la suspensión bacteriana ajustada a DO600=0.3, disminuyó la regeneración de brotes en ambos periodos de sub-cultivo (Figura 2).
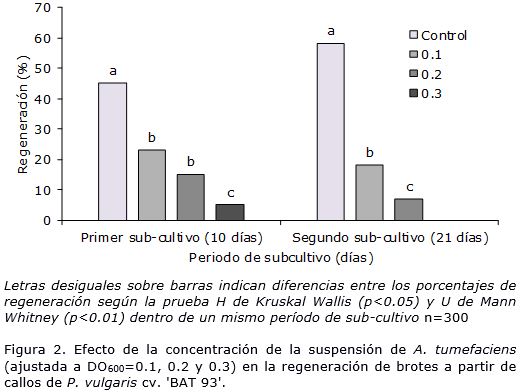
Similar a lo ocurrido en el cultivar 'ICA Pijao', en 'BAT 93' el sobrecrecimiento de A. tumefaciens causó la mortalidad de los brotes regenerados durante el segundo subcultivo. Este fue mayor en los explantes inoculados con la suspensión bacteriana ajustada a DO600=0.3 donde a los 21 días de cultivo no se observaron explantes regenerados vivos (Figura 2).
Los resultados demostraron que la concentración celular de la suspensión bacteriana tuvo un efecto negativo sobre la regeneración de brotes en los dos cultivares estudiados. Existen varios informes de los efectos perjudiciales de la inoculación con A. tumefaciens sobre la regeneración in vitro de frijol común. Muchos intentos de transformar frijol común usando A. tumefaciens (Amugune et al., 2011; Mukeshimana et al., 2013; Espinosa-Huerta et al., 2013) fallaron, y el tejido transformado no pudo ser recuperado principalmente debido a la pobre regeneración. En este estudio, a los 21 días de cultivo de los callos en MRBT a causa de la inoculación con A. tumefaciens, el porcentaje de regeneración disminuyó de 95 a 30% para ‘ICA Pijao’ y de 58 a 18% para ‘BAT93’. Esta afectación en la eficiencia de la regeneración debe estar relacionada con el crecimiento excesivo de A. tumefaciens o causada por una respuesta hipersensible de las células de frijol común para rechazar el ataque bacteriano, lo que provocó la muerte de los explantes, e impidió su regeneración.
Atendiendo a los resultados se seleccionó la menor concentración de la suspensión bacteriana (ajustada a DO600=0.1) para continuar los experimentos.
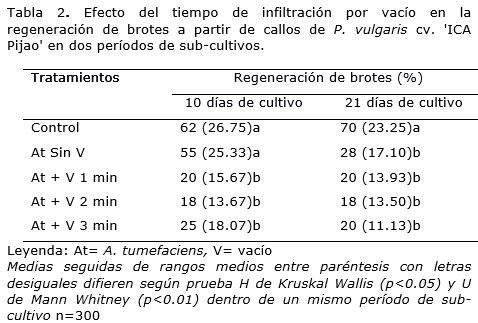
Al aplicar los tratamientos de infiltración por vacío, en el cultivar 'ICA Pijao' el porcentaje de regeneración de brotes disminuyó significativamente en comparación con el tratamiento donde los explantes no se trataron con vacío y el control (Tabla 2). No se observó diferencia significativa en la regeneración de brotes a partir de los explantes tratados con diferentes tiempos de vacío en el primer período de sub-cultivo. Al transcurrir 21 días de cultivo, el porcentaje de regeneración de brotes de los callos inoculados con A. tumefaciens sin aplicación de vacío decreció en un 27%. Independientemente de la aplicación o no de vacío, en el segundo subcultivo no se observaron diferencias significativas en la regeneración de brotes entre los distintos tratamientos donde los explantes fueron inoculados con A. tumefaciens (Tabla 2).
La infiltración por vacío también afectó la regeneración de callos en el cultivar 'BAT 93' en el primer sub-cultivo, se presentaron diferencias significativas entre los tratamientos y los controles (Tabla 3). A los diez días de cultivo se observó que la aplicación de 1 min de vacío provocó una disminución de 15% en la regeneración de los brotes respecto al tratamiento donde los callos se inocularon con A. tumefaciens sin la aplicación de vacío. Cuando se incrementó el tiempo de infiltración por vacío de 1 a 2 min el valor del porcentaje de regeneración disminuyó. En el tratamiento donde los explantes se expusieron a 3 minutos de infiltración por vacío, no se observó regeneración. En el segundo periodo de sub-cultivo, en los callos que fueron inoculados con A. tumefaciens recibieran o no tratamiento con vacío murieron los brotes regenerados y no se observó formación de nuevos brotes.
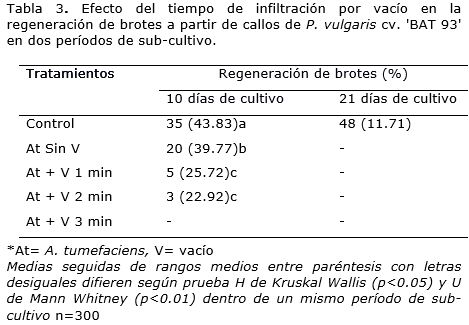
El efecto negativo de la infiltración por vacío sobre la regeneración de brotes observado en este experimento, pudo deberse a diferentes causas. Entre ellas, el vacío puede dañar mecánicamente la vitalidad del explante (Subramanyam et al., 2011), lo cual dificulta su posterior regeneración in vitro. Otra de las causas puede estar relacionada con el aumento de la presión de inóculo de la bacteria. Al aplicar vacío se extrae aire del tejido y este espacio puede ser ocupado por el líquido que cubre el explante (suspensión bacteriana). Una vez eliminado el vacío el aire intenta volver a las cavidades donde se encontraba y actúa como un pistón presionando la suspensión bacteriana hacia lo interno del tejido. Ello puede provocar la acumulación de gran cantidad de bacterias en el tejido de tal manera que el sobrecrecimiento de la bacteria no pueda ser controlado por las concentraciones de antibiótico empleadas para ello.
En la literatura científica internacional es limitada la información sobre el empleo de la infiltración por vacío en la transformación genética de frijol común. Liu et al. (2005) utilizaron una combinación de sonicación e infiltración por vacío en P. vulgaris en un evento de transformación genética vía A. tumefaciens. Estos autores informaron que la mayor frecuencia de transformación estuvo condicionada por tratamientos de 5 min de sonicación y 5 min de infiltración por vacío durante la inoculación. Ellos utilizaron como explante blanco plántulas las cuales fueron co-cultivadas por 24 horas y posteriormente trasplantadas a suelo. A diferencia del presente estudio, estos autores no emplearon el cultivo de tejidos in vitro para la regeneración del tejido transformado. Sin embargo, debido a la muy baja probabilidad de obtener una planta totalmente transformada a partir de la inoculación de una plántula, estos resultados no han tenido seguimiento por este ni otros grupos de investigación en el mundo.
En otra investigación, Nanjareddy et al. (2016) con el empleo de la infiltración por vacío incrementaron la expresión transitoria en hojas de P. vulgaris, pero no se logró regeneración a partir de este explante. Es importante destacar que para lograr la transformación genética debe existir un balance entre la transferencia de ADN de A. tumefaciens al tejido blanco y la regeneración del tejido transformado. Aunque se incremente la transferencia de ADN, si no se logra regenerar plantas a partir de las células transformadas, no se obtienen individuos geneticamente modificados. De ello la importancia de los resultados del presente trabajo donde se demostró que la infiltración por vacío redujo la regeneración de brotes. Los resultados de esta investigación constituyen los primeros aportes a la comunidad científica en demostrar el efecto de la infiltración por vacío en la regeneración de tejido de P. vulgaris inoculado con A. tumefaciens.
Teniendo en cuenta los resultados no se aplicó la infiltración por vacío durante la inoculación de los callos con A. tumefaciens en el siguiente experimento.
Independientemente del periodo de co-cultivo en los explantes inoculados con A. tumefaciens se afectó la regeneración de brotes en los cultivares 'ICA Pijao' y 'BAT 93' en los dos períodos de sub-cultivo, pues se observaron diferencias significativas entre los tratamientos y el control (Figura 3 y Figura 4). Cuando el periodo de co-cultivo se redujo de 5 a 3 días, el porcentaje de regeneración de brotes se incrementó para los dos cultivares objeto de estudio (Figura 3 y Figura 4).

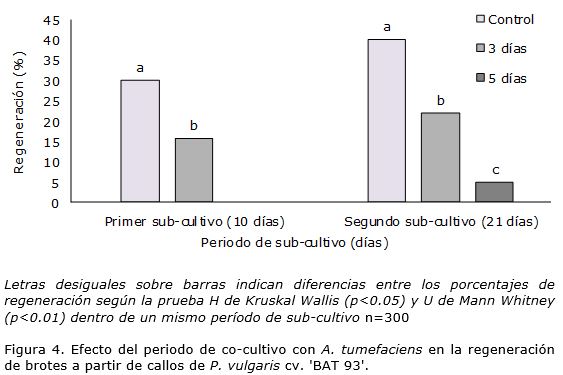
En el género Phaseolus para la transformación genética mediada por A. tumefaciens, se han informado diferentes períodos de co-cultivo, 7 días (Zambre et al., 2005) en Phaseolus acutifolius, 3 días (Amugune et al., 2011) y 8 días (Mukeshimana et al., 2013) en P. vulgaris. En este estudio se demostró que los mayores porcentajes de regeneración se lograron al aplicar el menor periodo de co-cultivo. Estos resultados indicaron que cortos períodos de co-cultivo pueden favorecer la regeneración de brotes a partir de callos inoculados con A. tumefaciens en P. vulgaris cultivares 'ICA Pijao' y 'BAT 93'.
El porcentaje de regeneración de los controles en este experimento sobre el efecto del tiempo de co-cultivo fue inferior al de los otros dos experimentos lo cual debió ser causado por el envejecimiento de la semilla (Collado et al., 2013) ya que entre el primer experimento y el último medió un período de cinco meses. En investigaciones previas Collado et al. (2013) indicaron que la formación de callos morfogéneticos y su regeneración estuvieron determinados por la edad de la semilla. Estos autores informaron que con semillas almacenadas por más de cuatro meses la regeneración de brotes a partir de callos disminuyó. Ello sugiere que en este experimento, independientemente del tratamiento o no con A. tumefaciens y del tiempo de co-cultivo empleado, la regeneración de brotes estuvo influenciada por este factor.
Atendiendo a los resultados se requiere continuar los estudios para ajustar los parámetros analizados y realizar esfuerzos adicionales para lograr un balance adecuado entre la transferencia de ADN de A. tumefaciens a tejidos de P. vulgaris y la regeneración del tejido transformado.
CONCLUSIONES
La concentración de la suspensión bacteriana, el tiempo de infiltración por vacío y el período de co-cultivo afectan la regeneración de brotes de P. vulgaris cv. 'ICA Pijao' y 'BAT 93'. Los mayores porcentajes de regeneración de brotes de P. vulgaris se lograron al inocular los callos con una suspensión bacteriana ajustada a una densidad óptica de 0.1, sin infiltración con vacío y manteniéndolos 3 días en co-cultivo.
REFERENCIAS
Chandel SCR, Pandey SK (2014) Effect of N6-benzylaminopurine and adenine sulphate in in-vitro plant regeneration of Phaseolus vulgaris L. International Journal of Current Microbiology and Applied Sciences 3(12): 801-806
Collado R, Bermúdez-Caraballoso I, García LR, Veitía N, Torres D, Romero C, Martirena-Ramírez A, Angenon G (2015) Agrobacterium-mediated transformation of Phaseolus vulgaris L. using indirect organogenesis. Scientia Horticulturae 95: 89-100; doi:10.1016/j.scienta.2015.06.046
Collado R, Veitía N, Bermúdez-Caraballoso I, García L, Torres D, Romero C, Lorenzo J, Angenon G (2013) Efficient in vitro plant regeneration via indirect organogenesis for different common bean cultivars. Scientia Horticulturae 153: 109-116; doi:10.1016/j.scienta.2013.02.007
Espinosa-Huerta E, Quintero-Jiménez A, Cabrera-Becerra KV, Mora-Avilés MA (2013) Stable and efficient Agrobacterium tumefaciens mediated transformation of Phaseolus vulgaris. Agrociencia 47(4): 319-333
Gamborg OL, Miller RA, Ojima K (1969) Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research 50: 151-158; doi:10.1016/0014-4827 (68)90403-5
Kwapata K, Nguyen T, Sticklen M (2012) Genetic transformation of common bean (Phaseolus vulgaris L.) with the Gus color marker, the Bar herbicide resistance, and the Barley (Hordeum vulgare) HVA1 drought tolerance genes. International Journal of Agronomy 2012: 1-8; doi:10.1155/2012/198960
Lanna AC, Taeko S, Gledson T, Pereira R, Alves M (2016) Physiological characterization of common bean (Phaseolus vulgaris L.) genotypes, water-stress induced with contrasting response towards drought. Australian Journal of Crop Science 10(1): 1-6
Liu Z, Park BJ, Kanno A, Kameya T (2005) The novel use of a combination of sonication and vacuum infiltration in Agrobacterium-mediated transformation of kidney bean (Phaseolus vulgaris L.) with lea gene. Molecular Breeding 16(3): 189-197; doi:10.1007/s11032-005-6616-2
Martirena-Ramírez A, Veitía N (2013) Factores que influyen en la transformación genética vía Agrobacterium tumefaciens en Phaseolus vulgaris L. Biotecnología Vegetal 13(2): 67-74
Mukeshimana G, Ma Y, Walworth AE, Song G, Kelly JD (2013) Factors influencing regeneration and Agrobacterium tumefaciens mediated transformation of common bean (Phaseolus vulgaris L.). Plant Biotechnology Reports 7(1): 59-70; doi:10.1007/s11816-012-0237-0
Nanjareddy K, Arthikala MK, Blanco L, Arellano ES, Lara M (2016) Protoplast isolation, transient transformation of leaf mesophyll protoplasts and improved Agrobacterium-mediated leaf disc infiltration of Phaseolus vulgaris: tools for rapid gene expression analysis. BMC Biotechnology 16(1): 53-66; doi:10.1186/s12896-016-0283-8
Subramanyam K, Subramanyam K, Sailaja KV, Srinivasulu M, Lakshmidevi K (2011) Highly efficient Agrobacterium-mediated transformation of banana cv. Rasthali (AAB) via sonication and vacuum infiltration. Plant Cell Reports 30(3): 425-436; doi:10.1007/s00299-011-1010-5
Zambre M, Goossens A, Cardona C, Van Montagu M, Terryn N, Angenon G (2005) A reproducible genetic transformation system for cultivated Phaseolus acutifolius (tepary bean) and its use to assess the role of arcelins in resistance to the Mexican bean weevil. Theoretical and Applied Genetics 110(5): 914-924; doi:10.1007/s00122-004-1910-7
Recibido: 30-06-2017
Aceptado: 25-08-2017
Copyright (c) 2017 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
