Artículo original
Biotecnología Vegetal Vol. 17, No. 4: 251 - 257, octubre - diciembre, 2017
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Caracterización morfológica en vivero de plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática
Morphological characterization in nursery of Coffea arabica L. cv. Caturra rojo J-884 plants obtained by somatic embryogenesis
Nosleiby Ortiz1,2, Raúl Barbón2, Alina Capote2, Anabel Pérez2, Modesto Robaina3
1Estación Experimental Agro-forestal de Jibacoa. Rincón Naranjo, Jibacoa. Manicaragua. Villa Clara. Cuba. CP 54 590. e-mail: nosly@jibacoa.inaf.co.cu
2Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: raulb@ibp.co.cu
3UBPC La Herradura, Empresa Agroforestal Jibacoa. La Herradura. Manicaragua. Villa Clara. Cuba. CP 54 590.
RESUMEN
El cultivo de células y tejidos vegetales desempeña un papel importante en la biotecnología agrícola, la embriogénesis somática como método de regeneración de plantas se ha logrado en un gran número de familias y especies incluyendo al cultivo de cafeto (Coffea spp.). La investigación se realizó con el objetivo de caracterizar la morfología de plantas de cafeto obtenidas por embriogénesis somática durante su adaptación ex vitro en vivero. Plantas obtenidas por embriogénesis somática del cultivar Caturra rojo J-884 fueron caracterizadas y comparadas con plantas obtenidas por embriogénesis cigótica del mismo cultivar. Las plantas de ambas procedencias fueron adaptadas en vivero en la zona de macizo de Guamuhaya durante 180 días. Las variables evaluadas fueron la supervivencia de las plantas, altura, área foliar, diámetro del tallo y número de pares de hojas. Las plantas obtenidas por embriogénesis somática fueron más uniformes en su altura, con valores entre 14 -17.9 cm con un rango de 3.9; mientras que, las plantas procedentes de embriogénesis cigótica oscilaron en valores entre 9.5 – 28.5 cm con valor de rango de 19. Las plantas obtenidas por las dos vías morfogenéticas presentaron características morfológicas similares en cuanto al diámetro del tallo y altura. Sin embargo, las plantas procedentes por embriogénesis somática desarrollaron mayor número de pares de hojas nuevas y área foliar total.
Palabras clave: cafeto, conversión, embriogénesis cigótica, supervivencia
ABSTRACT
The culture of plant cells and tissues plays an important role in agricultural biotechnology, somatic embryogenesis as a method of plant regeneration has been achieved in a large number of families and species including the cultivation of coffee (Coffea spp.). The research was carried out with the objective of determining the morphology of coffee plants obtained by somatic embryogenesis during their ex vitro adaptation in the nursery. Plants obtained by somatic embryogenesis of the red Caturra J-884 cultivar were characterized and compared with plants obtained by zygotic embryogenesis from the same cultivar. The plants of both origins were adapted in a nursery in the area of the Guamuhaya massif for 180 days. The variables evaluated were the survival of the plants, height, leaf area, stem diameter and number of pairs of leaves. The plants obtained by somatic embryogenesis were more uniform in their height. Values between 14 -17.9 cm were found with a range of 3.9; while, plants derived from zygotic embryogenesis oscillated in height values between 9.5 - 28.5 cm with a range value of 19. The plants obtained by the two morphogenetic pathways presented similar morphological characteristics in terms of stem diameter and height. However, plants derived from somatic embryogenesis developed a greater number of pairs of new leaves and total leaf area.
Keywords: coffee, conversion, survival, zygotic embryogenesis
INTRODUCCIÓN
El café es uno de los productos más importante en el comercio internacional después del petróleo y constituye el principal producto en el cual se basan su economía alrededor de 70 países. Las áreas cultivadas de cafeto (Coffea sp.) son aproximadamente 10.2 millones de hectáreas distribuidas en más de 80 países, sobre todo en las regiones tropicales y subtropicales de África, Asia y América Latina (Argoti y Belalcazar, 2017).
El cultivo de células y tejidos vegetales desempeña un papel importante en la biotecnología agrícola. La embriogénesis somática como método de regeneración de plantas se ha logrado en un gran número de familias y especies, incluyendo al cafeto (Barbón et al., 2014a). Este método ofrece la posibilidad de obtener un alto número de plantas con las mismas características genéticas de la planta madre, aún para aquellas especies difíciles de propagar por métodos convencionales. Además de estas ventajas, se tiene el costo económico, ya que la propagación se puede lograr en menor tiempo, en un espacio reducido y con la posibilidad de conservarla por cortos o largos periodos de tiempo (Botero et al., 2015).
Con la propagación acelerada de plantas de cafeto mediante embriogénesis somática se pretende establecer la propagación de plantas de gran potencial y reducir los costos de producción de posturas (De Rezende et al., 2012; Etienne et al., 2016).
En Cuba, el cafeto se ubica entre los principales cultivos de la estructura agraria y ha sido objeto de mejoramiento genético, mediante su inclusión en los programas nacionales. Uno de los problemas de la caficultura cubana es la demanda de semilla de alto valor genético, ya que no se satisfacen las necesidades en la base productiva. La producción de semilla es imprescindible para abastecer tanto los bancos de semilla como las áreas cafetaleras comerciales. En este contexto, la embriogénesis somática puede servir de apoyo al método tradicional de propagación de plantas de cafeto.
Un aspecto importante para introducir en la producción plantas obtenidas por métodos biotecnológicos es determinar cómo es su crecimiento, desarrollo y niveles productivos en condiciones de campo. El cultivar Caturra rojo J-884 tiene entre sus principales características su alto potencial productivo lo cual lo hace atractivo para los productores cafetaleros. Aunque se han regenerado plantas por embriogénesis somática (Barbón et al., 2003), su respuesta en condiciones ex vitro no ha sido evaluada.
Atendiendo a lo anterior esta investigación se realizó con el objetivo de caracterizar la morfología de plantas de cafeto, obtenidas por embriogénesis somática, durante su adaptación ex vitro en vivero con respecto a plantas procedentes de semilla tradicional (embriogénesis cigótica).
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon plantas de Coffea arabica L. cv. Caturra rojo J-884 obtenidas por embriogénesis somática según la metodología propuesta por Barbón et al. (2003) y con las siguientes características morfológicas: tres pares de hojas, una altura de 2.0–3.0 cm medida de base de tallo hasta el ápice y con desarrollo de las raíces.
Como control se utilizaron plantas procedentes de embriogénesis cigótica (a partir de semillas botánicas con categoría certificada). Las semillas botánicas fueron pregerminadas en propagadores hasta que alcanzaron una altura de 4.0-4.5 cm, medida desde la base del tallo hasta el ápice y desarrollo de las hojas cotiledonales y raíces.
Caracterización morfológica
Se realizó la caracterización de plantas obtenidas por embriogénesis somática y su comparación con plantas obtenidas por embriogénesis cigótica (grupo control) durante su adaptación ex vitro en vivero.
El ensayo se realizó en un vivero, ubicado en la zona del macizo de Guamuhaya (Villa Clara, Cuba). Se utilizaron 300 plantas obtenidas por embriogénesis somática y la misma cantidad de plantas procedentes de semilla botánica. Estas se plantaron en tubetes de polipropileno atóxico con AntiUV con una capacidad de 180 cm3 que contenían un sustrato compuesto por suelo Fersialítico pardo (Categoría 2) con un contenido de 3.8% de materia orgánica, 8.7% de P2O, 11.66% de K2O, pH de 5.53 y humus de lombriz en una relación 1:1.
El ensayo se realizó a una temperatura promedio durante el día de 24.5±3.0 °C, humedad relativa del 85% y una intensidad luminosa que osciló entre 224-457 µmol m-2 s-1 medida con un luxómetro EXTECH Light meter. Se empleó una malla de color negro para obtener un 70% de sombreo durante los primeros 15 días de cultivo y posteriormente fue retirada.
Se utilizó un sistema de riego por microaspersión. La frecuencia de riego fue de dos minutos de duración cuatro veces al día (9.00, 11.00, 14.00 y 16.00 horas). Las labores de cultivo se efectuaron según Díaz et al. (2013). Además, a las plantas se les realizaron tres aplicaciones de fertilizante (NPK) en una proporción (7:14:7) diluido al 12% y se añadieron 20 ml por tubete.
A los 180 días de cultivo se evaluaron las variables siguientes:
- Supervivencia (%) que se definió como el número de plantas vivas a los 15 días de cultivo en vivero y se calculó el porcentaje con respecto al total de plantas inicial.
- Coloración de las hojas de las plantas (Observación visual).
- Altura de la planta (cm) medida desde la base del tallo hasta el ápice. Se realizó la medición con el empleo de una regla graduada.
- Diámetro del tallo de las plantas (cm). Se realizó la medición con el empleo de un Pie de Rey a 1 cm de altura de la base del tallo.
- Número de pares de hojas nuevas por planta (u).
- Contenido de clorofilas totales (SPAD).
- Área foliar de las plantas (cm2). Se realizó según el método propuesto por Soto (1980) para cultivares de C. arabica L. basada en la fórmula siguiente:
- AF (cm2) = largo de hoja x ancho de la hoja x 0.64 (referido a área foliar de todas hojas nuevas formadas durante la adaptación ex vitro).
Análisis estadísticos
La comparación de valores de las variables, se realizó mediante una prueba de Tukey, con previa comprobación de los supuestos de normalidad y homogeneidad de varianza utilizando el paquete estadística InfoStat versión 1.0 (2012).
RESULTADOS Y DISCUSIÓN
A los 15 días de cultivo, se obtuvieron diferentes valores de supervivencia de las plantas obtenidas por embriogénesis somática y cigótica en de vivero, con valores de 85.76% y 99.0% respectivamente. Las plantas mostraron las características fenotípicas del cultivar (Figura 1).

En las plantas procedentes de embriogénesis somática se observaron los menores valores de supervivencia. Esto podría deberse a que el cambio de estas plantas de condiciones in vitro a ex vitro es un punto crítico en el proceso de adaptación a las nuevas condiciones ex vitro (De Rezende et al., 2016). Durante la fase de conversión cambian las condiciones fisiológicas ambientales y las plantas deben desarrollar características morfológicas de adaptación a las nuevas condiciones de cultivo.
Esto confirma los resultados obtenidos por Santana et al. (2007), quienes demostraron que un adecuado manejo de las condiciones de cultivo durante la fase de conversión es importante para la supervivencia de las plantas. Con el control de la transpiración durante los primeros siete días de cultivo posteriores a la plantación se produce un incremento de la supervivencia de las plantas. Estos autores observaron que las plantas de cafeto con al menos cuatro pares de hojas produjeron una población homogénea con una tasa de supervivencia del 90%. También Barbón et al. (2014b) alcanzaron en la fase de conversión de la embriogénesis somática de cafeto valores de supervivencia de un 100% en casa de cultivo. En dichas condiciones semicontroladas, se estandarizan algunos parámetros de cultivo que contribuyen a una mejor adaptación ex vitro de las plantas como es la frecuencia de riego y la luminosidad. Sin embargo, en vivero no hay uniformidad en toda el área de cultivo, debido a que la estructura constructiva abierta no permite una homogeneidad de las condiciones ambientales.
A los 180 días de cultivo las plantas obtenidas por embriogénesis somática no presentaron diferencias significativas en la altura y diámetro del tallo con respecto a las plantas procedentes de embriogénesis cigótica. Sin embargo, los valores de las variables número de pares de hojas nuevas por planta, área foliar total y contenido de clorofila total fueron significativamente mayores (Tabla 1).

Sin embargo, en las plantas cuyo origen fue a partir de la embriogénesis somática se observó una homogeneidad en los valores de altura con respecto a las plantas procedentes de método de tradicional de semilla o embriogénesis cigótica (Figura 2).
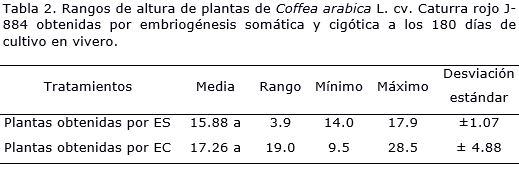
Las plantas procedentes de embriogénesis cigótica oscilaron en valores de altura entre 9.5 – 28.5 cm con valor de rango de 19; mientras que las plantas obtenidas por embriogénesis somática se encontraron valores de altura entre 14.0 -17.9 cm con un rango de 3.9 (Tabla 2).
La heterogeneidad de las plantas procedente embriogénesis cigótica pudiera deberse al origen y características de las semillas tomadas para obtener las plantas, las cuales indistintamente pudieran proceder de diferentes plantas y de distintos tiempos de inicio de la formación del embrión cigótico lo cual produce una respuesta diferente en el crecimiento y desarrollo de las plantas durante la adaptación ex vitro (Etienne et al., 2016).
En las plantas obtenidas por embriogénesis somática se observó un crecimiento uniforme y con las características fenotípicas típicas de este cultivar. Esto corrobora lo planteado por Etienne et al. (2016) quienes determinaron que cerca del 99% de las plantas de cafeto regeneradas por embriogénesis somáticas son idénticas morfológicamente a la planta madre que les dio origen. Esto garantiza que existan pocas diferencias en la calidad de las plantas que son llevadas a condiciones de campo. En este sentido, Freire et al. (2016) en estudios realizados en plantas obtenidas por embriogénesis somática de caña de azúcar (Saccharum spp.) también refirieron homogeneidad en el crecimiento y no encontraron plantas fuera de tipo en las poblaciones evaluadas.

En las plantas procedentes de semilla botánica además de tener un crecimiento no uniforme entre ellas, con respecto a las obtenidas por embriogénesis somática, se observó un 3.0% de plantas con brotes de color bronceado (#996B26) (Figura 3 A). Las plantas procedentes de embriogénesis somática presentaron en todos los casos la coloración verde (#01DF3 A) típica de este cultivar (Figura 3 B).

En estudios realizados por Menéndez y Ríos (2008), se encontró que los patrones de proteínas solubles de hojas de plantas in vitro de cafeto se mantienen estables después de su paso por cultivo in vitro, tanto al comparar las plantas in vitro entre sí, como con respecto a las hojas de las plantas donantes. Ello demostró que las plantas in vitro de cafeto regeneradas por embriogénesis somática son estables a nivel de su patrón electroforético de proteínas solubles y pueden ser propagadas a escala comercial. Los resultados de estos autores pudieran contribuir a explicar la similaridad morfológica de plantas obtenidas por embriogénesis somática con respecto las plantas obtenidas por semilla botánica.
En apoyo a lo anterior, Bobadilla et al. (2013) en estudios realizados sobre la estabilidad genética y epigenética en plantas de cafeto obtenidas in vitro, plantearon que la embriogénesis somática en Coffea arabica L. es confiable para su utilización en la regeneración de plantas en una producción a gran escala, tanto por suspensiones celulares como por embriogénesis somática secundaria. También en otros cultivos como el guayabo (Psidium guajava L.) autores como Vílchez et al. (2015) demostraron la superioridad de las plantas obtenidas por embriogénesis somática en comparación con las procedentes de embriogénesis cigótica.
Atendiendo a que se ha referido el empleo de la embriogénesis somática como una alternativa al método tradicional de propagación de plantas (Etienne et al., 2016), los resultados alcanzados con este cultivar de cafeto en su adaptación ex vitro permiten recomendar este método para su propagación.
CONCLUSIONES
Las plantas de cafeto Caturra rojo cv. J-884 procedentes de embriogénesis somática presentan características morfológicas similares a las plantas obtenidas por semilla botánica pero con una mayor homogeneidad en la altura, mayor desarrollo foliar y niveles de clorofilas durante adaptación ex vitro en vivero. Por ello, pueden emplearse como alternativa para su propagación.
Referencias
Argoti A, Belalcazar N (2017) El mercado del café en los contextos mundial, nacional y regional. Revista UNIMAR 35(2): 325-348
Barbón R, Nguyen H, Capote A, de Feria M, Quiala E, Pérez A (2014a) Efecto de la densidad de inoculación en la germinación de embriones somáticos de Coffea arabica L. cv. ‘Caturra rojo’ en Sistemas de Inmersión Temporal RITA®. Biotecnología Vegetal 14(2): 91 – 97
Barbón R, Nguyen H, Capote A, de Feria M, Pérez A, Rivero L, Leiva M, O Hurtado (2014b) Efecto de mezclas de sustratos en la fase de conversión de plantas de Coffea arabica L. cv. ‘Caturra rojo’ obtenidas por embriogénesis somática. Biotecnología Vegetal 14(4): 205 – 213
Barbón R, Jiménez E, Capote A (2003) Influencia del genotipo y la densidad de inoculación sobre la diferenciación de embriones somáticos de Coffea arabica L. cv. Caturra rojo y Coffea canephora cv Robusta. Biotecnología Vegetal 3(3): 131-135
Bobadilla LR, Cenci A, Georget F, Camayo G, Dechamp E, Herrera JC, Santoni S, Lashermes P, Simpson J, Etienne H (2013) High genetic and epigenetic stability in Coffea arabica plants derived from embryogenic suspensions and secondary embryogenesis as revealed by AFLP, MSAP and the phenotypic variation rate. PLoS ONE 8:e56372; doi:10.1371/journal.pone.0056372
Botero C, Urrea AI, Naranjo EJ (2015) Potencial de regeneración de Psychotria ipecacuanha (Rubiaceae) a partir de capas delgadas de células. Acta biológica Colombiana 20(3): 181-192; doi:10.15446/abc.v20n3.47354
De Rezende J, De Carvalho C, Carolina R, Pasqual M, Batista J (2012) Multiplication of embryogenic calli in Coffea arabica L.. Acta Scientiarum Agronomy Maringá 34(1): 93 – 98; doi:10.4025/actasciagron.v34i1.11230
De Rezende AL, Almendagna F, Pasqual M, Siqueira CE (2016) Acclimatization of coffee (Coffea racemosa x Coffea arabica) somaclones obtained from temporary immersion bioreactor system (RITA®). AJCS 10(2): 169-175
Díaz W, Caro P, Bustamante C, Sánchez C, Rodríguez M, Vázquez E, Grave de Peralta G, Ramajo J, Ramos R, Navarro D, Fernández I, Martínez F, Rodríguez Y, Arañó L,Yero A, Morán N (2013) Instructivo Técnico Café Arábico. Instituto de Investigaciones Agro-forestales, La Habana
Etienne H, Bertrand B, Dechamp E, Maurel P, Georget F, Guyot R, Breitler JC (2016) Are genetics and epigenetic instabilities of plant embryogenic cells a fatality? The experience of coffee somatic embryogenesis. Human Genetics and Embryology 6 (136): 1-5; doi:10.4172/2161-0436.1000136
Freire M, Gómez R, Herrera I, Reyes M, de Feria M, Barbón R, Jiménez E (2016) Variabilidad fenotípica en campo de plantas de Saccharum spp. híbrido cv. ‘C87-51’ regeneradas vía embriogénesis somática. Biotecnología Vegetal 16(4): 215 – 222
Menéndez Y, Ríos AL (2008) Estabilidad en los patrones de proteínas de plántulas de café regeneradas por embriogénesis somática. ΦYTON 77: 49-64
Santana N, Rojas R, Galaz RM, Ku JR, Mijangos J, Gutiérrez L, Canto A, Quiroz F, Loyola VM (2007) Advances in coffee tissue culture and its practical applications. In Vitro Cell Dev Biol Plant 43 (6): 507 –520; doi:10.1007/s11627-007-9074-1
Soto F (1980) Estimación del área foliar en Coffea arabica L. a partir de las medidas lineales de las hojas. Cultivos Tropicales 2(3):115-128
Vílchez J, Martínez L, Albany N (2015) Comparación del crecimiento en vivero entre plántulas y vitroplantas de guayabo cultivar enana roja cubana EEA-1840. Interciencia 40 (4): 270-274
Recibido: 25-07-2017
Aceptado: 29-09-2017
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
