Artículo original
Biotecnología Vegetal Vol. 18, No. 1: 21 - 32, enero - marzo, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Dosis óptima de radiaciones Gamma para la regeneración de plantas in vitro de Phaseolus vulgaris L. cultivar ‘BAT-93’
Optimal dose of Gamma radiation for Phaseolus vulgaris L. cultivar 'BAT-93' in vitro plants regeneration
Amanda Martirena-Ramírez1, Novisel Veitía1, Lourdes R García1, Raúl Collado1, Damaris Torres1, Leonardo Rivero, Miriam Ramírez-López2
1Instituto de Biotecnología de las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: amanda@ibp.co.cu
2Facultad de Ciencias Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
RESUMEN
La aplicación de radiaciones Gamma combinada con el cultivo de tejidos en frijol común (Phaseolus vulgaris L.) constituye una herramienta para acelerar los programas de mejoramiento genético. El presente trabajo tuvo como objetivo determinar la dosis óptima de radiaciones Gamma para la regeneración de plantas in vitro de Phaseolus vulgaris L. cultivar ‘BAT-93’. Se aplicaron dosis de 20, 30, 40, 50 o 60 Gy a semillas maduras y se incluyó un control sin irradiar. Las semillas se colocaron a germinar in vitro y se utilizó el nudo cotiledonal con dos cotiledones para la formación de callos. Se emplearon 100 semillas por tratamiento mutagénico y del control. Las evaluaciones se realizaron a los 21 días después de aplicado el tratamiento mutagénico. Se registró el porcentaje de explantes que formaron callos y su masa fresca (g). Con estos valores se determinó la Dosis letal media (DL50). En la regeneración, se cuantificó el número de brotes por callo y a partir de estos valores se calculó la Dosis Reductiva media (GR50). Las principales afectaciones se produjeron en la formación de los callos y en la regeneración de brotes. La dosis de 30 Gy se seleccionó para la irradiación masiva de semillas de frijol común cultivar ‘BAT-93’ con radiaciones Gamma. Esta fue la dosis más próxima a la DL50 y GR50.
Palabras clave: cultivo in vitro, frijol común, radiosensibilidad, semillas
ABSTRACT
The application of Gamma radiations combined with tissues cultures in common bean constitutes a tool to accelerate the programs of genetic improvement. The determination of the optimal radiation dose is an important aspect to be defined in order to generate genetic variability. For this reason, the objective of this study was to determine the optimal dose of Gamma radiation for regenerating Phaseolus vulgaris L. cultivar 'BAT-93'in vitro plants. It were applied doses of 20, 30, 40, 50 or 60, Gy to mature seeds and an unirradiated control was included. The seeds were in vitro germinated and the cotyledonary nodes with two cotyledon was used for callus formation. Per mutagenic treatment and the control without irradiation 100 seeds were used. The evaluations were made 21 days after the radiation was applied. The percentage of explants that formed calluses and its fresh weight (g) were recorded. With these values, the mean lethal dose (LD50) was determined. In the regeneration, the number of shoots per callus was determined, from these values the mean Reductive Dosage (GR50) was calculated. The main affectations occurred in the callus formation and in the shoots regeneration. The dose of 30 Gy was selected for the massive treatments of common bean cv. 'BAT-93' seeds with Gamma radiations. This dose was closer to the LD50 and GR50).
Keywords: in vitro culture, common bean, radiosensitivity, seeds
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.), es una de las leguminosas de consumo humano más importantes a nivel mundial y la principal fuente de alimentos para los países en vías de desarrollo (Polania et al., 2017). El cultivo de esta especie está principalmente en manos de pequeños productores, que enfrentan una serie de limitantes bióticas y abióticas para su producción. Dentro de las abióticas están el estrés hídrico y las altas temperaturas, que afectan entre el 30 y 73% de las áreas de siembra de este cultivo a nivel mundial y que se agravarán por los efectos del cambio climático (Rippke et al., 2016).
Debido a que la productividad del frijol común se ve limitada severamente por los problemas abióticos antes mencionados, los programas de mejoramiento genético, se han orientado hacia el desarrollo de germoplasma con tolerancia a este tipo de limitantes. Para ello se emplean métodos alternativos como el cultivo in vitro y la inducción de mutaciones (Beebe et al., 2013).
La inducción de mutaciones es una alternativa para generar variabilidad genética no presente en la naturaleza o para obtener variedades que pueden emplearse como progenitores en programas de fitomejoramiento, al producir nuevas combinaciones genéticas o al incrementar la variabilidad en una población. Entre los agentes mutagénicos físicos, los rayos Gamma han sido los más exitosos en la obtención de mutaciones viables de alta frecuencia en un gran número de cultivares de diferentes especies (Iyas y Naz, 2014).
La producción de mutantes por irradiación de tejidos cultivados in vitro proporciona numerosas ventajas como son: un medio para tratar grandes poblaciones en un período de tiempo corto, en comparación con el empleo de las técnicas de mejoramiento genético tradicional, así como la eficiencia en la selección y la multiplicación rápida de cultivares. Estos métodos se ha empleado principalmente con el objetivo de obtener variedades mejor adaptadas a través de provocar la alteración de rasgos como la duración de la madurez y la floración, tamaño de las semillas, resistencia a enfermedades, componentes del rendimiento, así como la tolerancia a estrés biótico y abiótico (Yaqoob y Rashid, 2001).
Un requisito previo fundamental en trabajos de mejoramiento genético donde se utilice la inducción de mutaciones, lo constituye la determinación de la dosis de radiación óptima para posteriormente aplicar de forma masiva el tratamiento mutagénico. Para ello se requiere definir los intervalos de radiaciones en los que se inducen mutaciones favorables en especies cultivadas, lo que equivale a evaluar la radiosensibilidad de los tejidos a diferentes intensidades de radiación (Ramírez et al., 2006).
En la literatura científica se ha utilizado durante los últimos años, la inducción de radiaciones Gamma en frijol común en condiciones ex vitro para inducir variabilidad genética en diferentes aspectos como por ejemplo: la inducción de la floración temprana (Jan et al., 2010), color de la flor (Mahamune y Kothekar, 2011) y variación de pigmentos clorofílicos (Borka y More, 2016).
Sin embargo, en P. vulgaris se refieren escasos trabajos de radiosensibilidad a nivel de semilla en condiciones in vitro (Bajaj et al., 1970; Carneiro et al., 1987), debido fundamentalmente a que esta es una especie que se ha mostrado recalcitrante al cultivo de tejidos, por lo que se requiere contar con un protocolo de regeneración de plantas eficiente (Kwapata et al., 2010).
Los trabajos más recientes donde se combinan la inducción de radiaciones Gamma y el cultivo de tejidos en semillas de esta especie han sido desarrollados por el Grupo de Mejoramiento genético de granos del Instituto de Biotecnología de las Plantas para el cultivar ‘ICA Pijao’ (Martirena-Ramírez et al., 2015a; Martirena-Ramírez et al., 2015b). Teniendo en cuenta que se ha descrito que el nivel de radiosensibilidad difiere aún para cultivares de la misma especie (Predieri, 2001), la presente investigación tuvo como objetivo determinar la dosis óptima de radiaciones Gamma para la regeneración de plantas in vitro de Phaseolus vulgaris L. cultivar ‘BAT-93’.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon semillas maduras de Phaseolus vulgaris L. cultivar ‘BAT-93’, obtenidas por selección en el “Centro Internacional de Agricultura Tropical” de Colombia (CIAT) y cultivadas en Cuba. El material de partida fue donado por el Centro de Investigaciones Agropecuarias de la Universidad Central “Marta Abreu” de Las Villas (CIAP). Las semillas colectadas fueron cosechadas en casa de cultivo.
Cultivo in vitro
Para el desarrollo de los experimentos in vitro se emplearon los medios de cultivo y el sistema de regeneración de plantas vía organogénesis indirecta de Phaseolus vulgaris L. cultivar ‘BAT-93’ desarrollado en el Instituto de Biotecnología de las Plantas por el grupo de Mejoramiento genético de granos (Collado et al., 2013), el cual se resume en un esquema de trabajo (Figura 1).
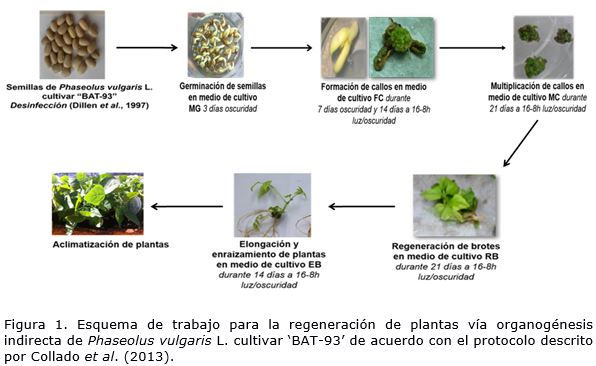
Tratamiento mutagénico
Para determinar la curva de dosis de radiación con rayos Gamma fuente 60Co se irradiaron semillas maduras de frijol común con diferentes dosis de radiación (0, 20, 30, 40, 50 o 60 Gy) para un total de seis tratamientos. Para ello se utilizó un irradiador MPX-25, con una potencia de dosis de 11.3 Gy min-1, el cual se encuentra en el Centro de Aplicaciones Tecnológicas y desarrollo Nuclear (CEADEN) de La Habana, Cuba.
Después de la irradiación, las semillas se transfirieron a un medio de cultivo de germinación durante tres días. Posteriormente, la formación y multiplicación de los callos durante 21 días y la regeneración de plantas a los 21 días de cultivo se llevó a cabo según el esquema de trabajo (Figura 1).
Se emplearon 100 semillas por tratamiento mutagénico y del control sin irradiar y se colocaron a 25±20 C en la cámara de crecimiento con una intensidad luminosa de 45 µmol m 2s-1 proveída por lámparas fluorescentes frías.
Las evaluaciones se realizaron a los 21 días después de aplicado el tratamiento mutagénico. Se registró el número de explantes que formaron callos, así como su masa fresca (g) en medio de cultivo de formación de callos, por cada dosis de radiación aplicada. Con estos valores se determinó la Dosis letal media (DL50) (dosis con la cual se reduce el 50% de la población). En la regeneración de brotes, se cuantificó el número de brotes por callo y a partir de estos valores se calculó la Dosis Reductiva media (GR50) (dosis con la cual se reduce el crecimiento en el 50% de la población). Para describir el color de los brotes, se utilizó el código hexadecimal de colores (http:// www.cwp.linet.edu/cwis/cwp.html).
Todos los experimentos fueron desarrollados bajo un diseño completamente al azar. Se utilizó un análisis de regresión lineal, así como la prueba H de Kruskal Wallis y U de Mann Whitney para las comparaciones entre las parejas de grupos con un nivel de significación para p≤0.05 al no cumplirse los supuestos de normalidad y
homogeneidad de varianzas. El procesamiento estadístico de los datos se realizó con la ayuda del paquete estadístico Statistic Packaged for Social cience (SPSS) versión 21.0 sobre Windows.
RESULTADOS Y DISCUSIÓN
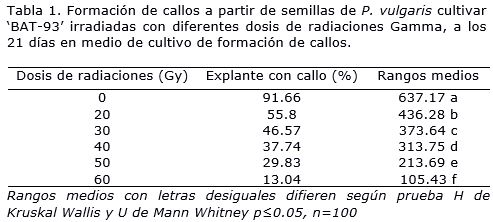
El porcentaje de formación de callos fue afectado con las dosis de radiaciones estudiadas (Tabla 1). Los mayores valores para esta variable se alcanzaron con las dosis de 20 y 30 Gy con diferencias significativas entre ellas, con las restantes dosis estudiadas y el control sin irradiar, con valores por encima del 45%. Sin embargo, con las dosis de 40 y 50 Gy, el porcentaje de explantes que formó callo se redujo por debajo del 40% en comparación con el control, con diferencias significativas entre ellos. Con 60 Gy se lograron valores inferiores, menos del 20% de explantes con formación de callos.
Los resultados de la presente investigación coinciden con los obtenidos para esta misma especie pero en el cultivar ‘ICA Pijao’, donde se encontró que en las semillas irradiadas con dosis por encima de 70 Gy, menos del 50% de los explantes formaron callos en comparación con el control, donde ocurrió en más del 90% de los explantes (Martirena-Ramírez et al., 2015b). La disminución del porcentaje de explantes con callo en menos del 30% de las semillas irradiadas con las dosis más elevadas, pudo deberse a que en la mayoría de estos explantes se produjo la caída del cotiledón, que se ha descrito como la principal fuente de almacenamiento de reguladores de crecimiento que promueven el desarrollo del callo (Collado et al., 2013).
En la multiplicación de los callos a los 21 días de cultivo, se observó que las dosis de radiaciones Gamma afectaron su masa fresca (Tabla 2). Todos los tratamientos evaluados presentaron diferencias significativas entre ellos y con respecto al control (Tabla 2). Los mayores valores para esta variable se alcanzaron con las dosis de 20 y 30 Gy con diferencias significativas entre ellas, con las restantes dosis estudiadas y el control sin irradiar. Sin embargo, con las dosis de 40, 50 y 60 Gy, se obtuvieron valores de masa fresca cinco veces inferiores a los mostrados por el control sin irradiar, con diferencias significativas entre ellos.
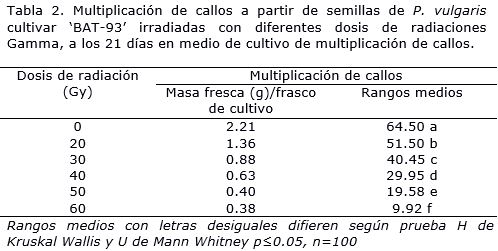
Los resultados de la presente investigación corroboraron hallazgos previos obtenidos en otros cultivares tales como ‘ICA Pijao’ (Martirena Ramírez et al., 2015a). Esto también se ha descrito en otras especies de leguminosas como por ejemplo Cajanus cajan L. (Rao y Narayanaswamy, 1975). En ese caso los autores irradiaron semillas con dosis de 10 a 50 Gy y encontraron que la masa fresca de los callos se redujo en la medida que se incrementó las dosis de radiación.
La disminución en los valores de masa fresca con dosis superiores a 30 Gy puede ser atribuida a los efectos provocados por la radiación Gamma, ya que es altamente efectiva y penetrante, lo que trae consigo cambios conformacionales que provocan una reducción de la competencia de esas células y sus progenies (Stajner et al., 2007). Estos efectos biológicos, se basan en la interacción con átomos o moléculas en la célula, particularmente agua, para producir radicales libres, los cuales pueden dañar o modificar componentes importantes de las células vegetales que afectan diferencialmente la morfología, anatomía y fisiología de las plantas. Los efectos incluyen cambios en la estructura celular de la planta y el metabolismo, por ejemplo, modulación del sistema antioxidante y la acumulación de compuestos fenólicos (Ashraf, 2009).
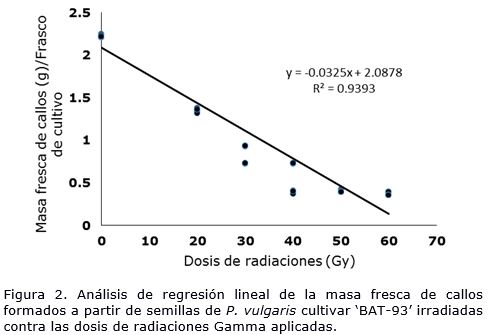
De las dosis de radiaciones estudiadas el valor más próximo a la Dosis Letal media (DL50) (30.24 Gy) según la ecuación de regresión lineal, fue 30 Gy (Figura 2). Con esta se logró una disminución de la masa fresca de los callos próximos a la mitad de los valores mostrados por el control.
En relación con esto, se ha descrito que la DL50 es un parámetro importante para medir el potencial de toxicidad a corto plazo de un tratamiento mutagénico y es ampliamente usada para determinar la frecuencia de mutación óptima con el menor daño posible al tejido vegetal (Mba et al., 2010).
Por otro lado, se encontró que las dosis de radiaciones afectaron la regeneración de brotes, ya que se redujo el número de brotes por callo (Tabla 3). Se encontraron diferencias significativas entre todos los tratamientos con las dosis estudiadas y de estos con respecto al control. Con las dosis de 20 y 30 Gy se alcanzaron los mayores valores del número de brotes por callo, pero estos fueron diferentes significativamente en relación con los valores mostrados por el control. Con las dosis de 40, 50 y 60 Gy se lograron valores tres veces inferiores en comparación con el control. Las mayores afectaciones en el número de brotes se produjeron con 70 Gy con la cual fueron seis veces inferiores al control.
Contrario a los resultados de la presente investigación, Martirena-Ramírez et al. (2015a) informaron que los callos obtenidos a partir de semillas irradiadas de P. vulgaris cultivar ‘ICA Pijao’ con dosis superiores a 70 Gy sí lograron formar más de un brote por explante con hojas trifoliadas de color verde oscuro. La respuesta diferente obtenida con ambos cultivares pudo estar relacionada con la capacidad regenerativa del cultivar ‘BAT-93’. Sobre lo anterior, Collado et al. (2013) refirieron que al estudiar la regeneración de plantas de P. vulgaris para cinco cultivares vía organogénesis indirecta, el cultivar ‘BAT-93’ presentó valores inferiores en cuanto al número de brotes por callo, en comparación con el cultivar ‘ICA Pijao’, lo que corrobora la condición genotipo dependiente de esta especie para el cultivo in vitro.
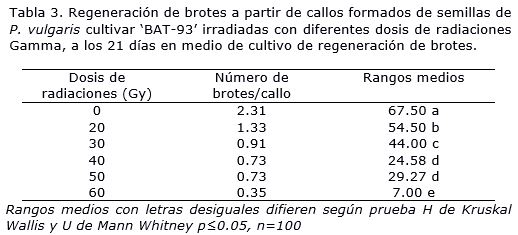
La curva de ajuste en base a la ecuación de regresión lineal mostró una relación negativa entre la regeneración de brotes y las dosis de radiaciones Gamma aplicadas (Figura 3). De las dosis de radiaciones estudiadas el valor más próximo a la Dosis Reductiva Media (GR50) (30.95 Gy) según la ecuación de regresión lineal, fue 30 Gy, con la cual se logró una disminución del número de brotes por callo próximos a la mitad de los valores mostrados por el control.
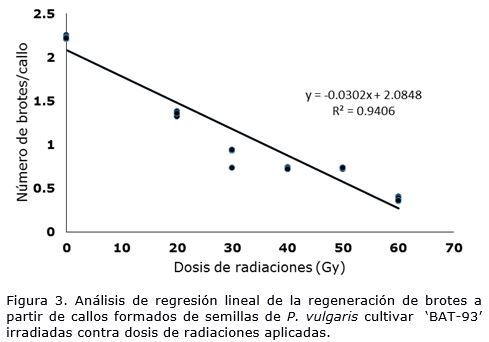
La disminución en la regeneración de brotes con diferentes dosis de radiaciones Gamma también ha sido referida en otros cultivos como por ejemplo: Lepidium sativum L. (Majeed y Muhammad, 2010), caña de azúcar (Saccharum spp. híbrido) (Balero et al., 2004). En otra investigación, González et al. (2007) al irradiar ápices de henequén (Agave fourcroides Lemark) cultivados in vitro, definieron el rango de dosis entre 20 y 30 Gy como la DL50 y la GR50 ya que el número de brotes por explante se redujo entre 40 y 60%, con diferencias significativas con el control y las restantes dosis de radiación. Las diferencias en cuanto al nivel de radiosensibilidad de los tejidos en las diferentes especies de plantas cultivadas in vitro, pudiera estar relacionada con diferentes factores como el cultivar, las condiciones fisiológicas de las plantas u órganos a irradiar, así como la manipulación del material vegetal antes y después de la irradiación (Predieri, 2001).
Las plantas regeneradas a partir de callos formados de semillas no irradiadas presentaron hojas trifoliadas de color verde oscuro (#006400) (Figura 4 A). De igual forma en el tratamiento con 30 Gy también se logró regenerar plantas con hojas trifoliadas definidas, de color verde oscuro (#006400), similares a las presentadas por el control. En menos del 5% de los brotes se observaron hojas de coloración amarilla (#FFFF00), y otras con márgenes lobulados hacia el ápice (Figura 4 B). Estos resultados pudieron relacionarse con que dosis altas de radiaciones Gamma pueden causar un desequilibrio de los reguladores del crecimiento de las plantas que conduzca a clorosis y senescencia foliar (Wi et al., 2007). De igual forma, Soehendi et al. (2007) informaron que al irradiar semillas de Vigna radiata L. se produjeron alteraciones morfológicas en cuanto a la forma y la coloración que presentaron las hojas.

El desarrollo de este tipo de anomalías en las hojas de los brotes regenerados a partir de callos formados de semillas irradiadas con 30 Gy, pudo deberse también a otras alteraciones en la fisiología y a aberraciones cromosómicas. En este sentido, se considera que la aberración cromosómica, la disminución en el nivel de auxina, la variación en la concentración de ácido ascórbico y el cambio en la actividad enzimática, son factores que pueden traer consigo malformaciones y cambios en la coloración de las hojas. De igual forma, se ha descrito que el parénquima esponjoso y las divisiones celulares de las hojas irradiadas con radiaciones Gamma pueden encontrarse disminuidos, estos efectos pueden ser la causa del desarrollo de hojas con malformaciones y los cambios en su coloración (Pinet-Leblay et al., 1992).
Teniendo en cuenta los resultados descritos anteriormente, se seleccionó la dosis de 30 Gy para la irradiación masiva de semillas de P. vulgaris cultivar ‘BAT-93’ con radiaciones Gamma, ya que esta fue la dosis más próxima a la DL50 y GR50. Estos estudios permiten la utilización de las radiaciones Gamma para inducir variabilidad genética como parte del programa de mejoramiento genético que se desarrolla en el Instituto de Biotecnología de las Plantas en el frijol común cultivar ‘BAT-93’.
CONCLUSIONES
Las semillas de frijol común cultivar ‘BAT-93’ son sensibles a las radiaciones Gamma y con la dosis de 30 Gy se logra la formación de callos y la regeneración brotes, lo que permite inducir variabilidad genética en este cultivar en la búsqueda de plantas tolerantes a estrés hídrico y a altas temperaturas.
Conflicto de intereses
Los autores no declaran conflicto de intereses.
REFERENCIAS
Ashraf M (2009) Biotechnological approach of improving plant salt tolerance using antioxidants as markers. Biotechnol Adv 27(1): 84–93; doi:10.1016/j.biotechadv.2008.09.003
Bajaj Y, Saettler A, Adams M (1970) Gamma irradiation studies on seeds, seedlings and callus tissue cultures of Phaseolus vulgaris L.. Radiation Botany 10(2): 119–124; doi:10.1016/S0033-7560(70)80032-1
Balero VA, Orellana P, Veitía N, Torres D (2004) Crecimiento, regeneración y radiosensibilidad de callos de caña de azúcar (Saccharum spp. híbrido var. SP 70-1284) tratados con radiación Gamma fuente 60Co. Biotecnología Vegetal 4(3): 165-169
Beebe SE, Rao IM, Blair MW, Acosta-Gallegos JA (2013) Phenotyping common beans for adaptation to drought. Front Physiol 4:1–20; doi:10.3389/fphys.2013.00035
Borka AT, More AD (2016) Mutagenic Effectiveness and Efficiency of Gamma Rays and EMS in Phaseolus vulgaris L.. International Journal of Current Microbiology and Applied Sciences 5(10): 544-55; doi:10.20546/ijcmas.2016.510.061
Carneiro JE, Barbosa HM, Cardoso AA, Vieira C (1987) The sensitivity of seeds of Phaseolus vulgaris L. cv. Milionario 1732 to Gamma radiation. Rev Ceres 34: 306-312
Collado R, Veitía N, Bermúdez-Caraballoso I, García LR, Torres D, Romero C, Rodríguez-Lorenzo JL, Angenon G (2013) Efficient in vitro plant regeneration via indirect organogenesis for different common bean cultivars. Sci Hortic 153: 109–116; doi:10.1016/j.scienta.2013.02.007
González GS, Alemán M, Garriga RO, de la Fe C (2007) Radiosensitivity to Gamma rays (60Co) in shoot tips of henequen. Biotecnología Vegetal 7: 115-117
Iyas S, Naz S (2014) Effect of Gamma irradiation on morphological characteristics and isolation of curcuminoids and oleoresins of Curcuma longa L.. J Anim Plant Sci 24(5): 1396-1404
Jan S, Parween T, Siddiqi TO, Mahmooduzzafar X (2010) Gamma radiation effects on growth and yield attributes of Psoralea corylifolia L. with reference to enhanced production of psoralen. Plant Growth Regul 64(2): 163–171; doi:10.1007/s10725-010-9552-z
Kwapata KR, Sabzikar MB, Sticklen JD, Kelly D (2010) In vitro regeneration and morphogenesis studies in common bean. Plant Cell Tiss Organ Cult 100: 97-105
Mahamune SE, Kothekar VS (2011) Gamma ray induced flower colour and seed mutants in french Bean (Phaseolus vulgaris L.). Recent Research in Science and Technology 3(5): 33-35
Majeed A, Muhammad Z (2010) Gamma irradiation effects on some growth parameters of Lepidium sativum L.. World J Fungal Plant Biol 1(1): 8–11
Martirena-Ramírez A, Veitía N, García LR, Collado R, Torres D, Rivero L, Ramírez-López M (2015a) Respuesta in vitro de semillas de Phaseolus vulgaris L. cultivar ‘Ica Pijao’ irradiadas con diferentes dosis de radiación Gamma. Biotecnología Vegetal 15(1): 9– 15
Martirena-Ramírez A, Veitía N, García LR, Collado R, Torres D, Rivero L, Ramírez-López M (2015b) Efecto de radiaciones Gamma 60Co sobre la regeneración de plantas de Phaseolus vulgaris L. cultivar ‘ICA Pijao’ vía organogénesis indirecta. Biotecnología Vegetal 15(4): 207 – 215
Mba C, Afza R, Jain SM (2010) Induced mutagenesis in plants using physical and chemical agents. Plant Cell Culture Essential methods, Wiley, New York
Pinet-Leblay C, Turpin F, Chevreau E (1992) Effect of Gamma and ultraviolet irradiation on adventitious regeneration from in vitro cultured pear leaves. Euphytica 62(3): 225-233; doi:10.1007/BF00041757
Polania J, Rao IM, Cajiao C, Grajales M, Rivera M, Velasquez F, Raatz B, Beebe SE (2017) Shoot and Root Traits Contribute to Drought Resistance in Recombinant Inbred Lines of MD23–24 × SEA5 of Common Bean. Front Plant Sci 8:296; doi:10.3389/fpls.2017.00296
Predieri S (2001) Induced mutation and tissue culture in fruits. Plant Cell Tissue Organ Culture 64(3): 185-210; doi:10.1023/A:1010623203554
Ramírez R, González L, Camejo Y, Zaldívar NF (2006) Estudio de radiosensibilidad y selección del rango de dosis estimulantes de rayos X en cuatro variedades de tomate (Lycopersicon esculentum Mill). Cultivos Tropicales 27(1): 63-67
Rao KS, Narayanaswamy S (1975) Effect of Gamma irradiation on cell proliferation and regeneration in explanted tissues of pigeon pea, Cajanus cajan (L.) mills P.. Radiation Botany 15(3): 301-305; doi:10.1016/S0033-7560(75)80029-9
Rippke U, Ramirez-Villegas J, Jarvis A, Vermeulen SJ, Parker L, Mer F (2016) Timescales of transformational climate change adaptation in sub-Saharan African agriculture. Nat Clim Chang 6: 605–609; doi:10.1038/nclimate2947
Soehendi R, Chanprame S, Toojinda T, Ngampongsai S, Srinives P (2007) Genetics, agronomic, and molecular study of leaflet mutants in mungbean (Vigna radiata (L.) Wilczek). J Crop Sci Biotech 10(3): 193–200
Stajner D, Milosevic M, Popovic BM (2007) Irradiation Effects on Phenolic content, lipid and protein oxidation and scavenger ability of soybean seeds. Int J Mol Sci 8: 618–627
Yaqoob M, Rashid A (2001) Induced mutation studies in some mungbean (Vigna radiata (L.) Wilczek) cultivars. Online J Biol Sci 1(9): 805–808
Wi SG, Chung BY, Kim JS, Kim JH, Baek MH, Lee JW, Kim YS (2007) Effects of Gamma irradiation on morphological changes and biological responses in plants. Micron 38: 553–564
Recibido: 17-10-2017
Aceptado: 04-12-2017
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
