COMUNICACIÓN CORTA
Biotecnología
Vegetal Vol. 14, No. 2: 123 - , abril - junio, 2014
ISSN
2074-8647, RNPS: 2154 (Versión electrónica)
Instituto
de Biotecnología de las Plantas. UCLV. MES.
Efecto del H2O2 sobre el crecimiento in vitro de un aislado cubano de Mycosphaerella fijiensis
Effect of H2O2 on the in vitro growth of Mycosphaerella fijiensis Cuban isolate
María I. Oloriz* y Bárbara Ocaña. Autora para correspondencia
Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5. Santa Clara. Villa Clara. Cuba. CP 54 830. e-mail: maria@ibp.co.cu
RESUMEN
El rayado negro de la hoja (Mycosphaerella fijiensis Morelet) es la principal enfermedad foliar que afecta el cultivo de bananos y plátanos. Uno de los posibles mecanismos de resistencia es la respuesta de tipo hipersensible observada en `Calcutta 4' (Musa AA) que involucra la formación de especies reactivas de oxígeno. Con el objetivo de determinar el efecto de H2O2 sobre el crecimiento in vitro de un aislado cubano de M. fijiensis CCIBP-Pf-83, se probaron varias concentraciones adicionadas al medio de cultivo PDB. Transcurridos siete días de incubación se determinó la masa seca del micelio. Se comprobó que con 30 mmol l-1 de H2O2 en el medio de cultivo se estimuló el crecimiento del micelio y con 50 a 100 mmol l-1 se redujo. Los resultados aportan elementos para la comprensión de las interacciones planta-patógeno en este patosistema.
Palabras clave: cultivo in vitro, rayado negro de la hoja, ROS
ABSTRACT
Black leaf streak disease (Mycosphaerella fijiensis Morelet) is the main foliar disease of bananas and plantain. One of the possible mechanisms of resistance is the hypersensitive response observed in `Calcutta 4' (Musa AA) that involves the formation of reactive oxygen species. In order to determine the effect of H2O2 on the in vitro growth of M. fijiensis Cuban isolate CCIBP-Pf-83, several concentrations added to a culture medium PDB were tested. After seven days of incubation the mycelial dry weight was determined. It was found that with 30 mmol l-1 H2O2 in the culture medium, mycelial growth was stimulated and with 50 up to 100 mmol l-1 it decreased. The results provide elements for understanding plant-pathogen interactions in this pathosystem.
Key words: black leaf streak disease, in vitro culture, ROS
INTRODUCCIÓN
El Rayado negro de la hoja (Sigatoka negra) es una de las enfermedades de mayor importancia para el cultivo de bananos y plátanos (Carlier et al., 2000). Esta es ocasionada por el hongo hemibiotrófico Mycosphaerella fijiensis Morelet.
El control de la enfermedad resulta difícil (Orozco-Santos et al., 2013). El empleo de cultivares resistentes es la medida de control más efectiva, sin embargo hasta el momento los cultivares de mejor aceptación por la población (bananos con genomas AAA y algunos AAB y plátanos del grupo AAB), resultan susceptibles o con resistencia parcial a M. fijiensis (Churchill, 2010).
Algunas de las posibles fuentes de resistencia encontradas en Musa a M. fijiensis incluyen acumulación de compuestos como fenilfenalenonas, felanonona y perinaftenonas (Otálvaro et al., 2007; Hidalgo et al., 2009), así como se ha descrito una respuesta similar a la respuesta hipersensible (RH) en el cultivar resistente `Calcutta 4' (Musa AA) (Cavalcante et al., 2011; Torres et al., 2012).
Teniendo en cuenta que entre los factores involucrados en una RH, se encuentra la acumulación de especies reactivas de oxígeno, es de interés determinar el efecto del peróxido de hidrógeno sobre el crecimiento in vitro de un aislado cubano de M. fijiensis (CCIBP-Pf-83).
MATERIALES Y MÉTODOS
Se empleó el aislado de M. fijiensis (CCIBP-Pf-83) perteneciente a la Coleción de Cultivos Microbianos del Instituto de Biotecnología de las plantas (IBP). Este fue obtenido de hojas del cultivar `Grande naine' (Musa AAA), con síntomas característicos de la enfermedad del rayado negro de la hoja. Este aislado ha sido caracterizado sobre la base de su agresividad, caracteres culturales, morfológicos y moleculares (Cruz et al., 2004; Leiva-Mora et al., 2014). El aislado CCIBP-Pf-83 se ha empleado en estudios previos de interacción de M. fijiensis con Musa spp. cv. `Grande naine' (AAA) y `Calcutta 4' (AA) (Portal et al., 2011).
Para determinar el efecto de H2O2 sobre el crecimiento in vitro de M. fijiensis se empleó como inóculo una suspensión micelial de un cultivo crecido en caldo papa dextrosa (PDB) por una semana. De este se tomaron 5.0 g de micelio (masa fresca), se le adicionó medio de cultivo fresco y se preparó una suspensión de micelio con un homogeneizador Ultra Turrax T25 (Rose Scientific Ltd., Canadá) durante 1 min. Con esta suspensión se inocularon Erlenmeyer de 100 ml de capacidad que contenían 50 ml de PDB y diferentes concentraciones de H2O2 (0, 30, 50, 75, 85 y 100 mmol l-1). Cada Erlenmeyer contenía aproximadamente 250 mg de micelio. Se utilizaron tres réplicas por tratamiento y el experimento se repitió tres veces.
Los cultivos del hongo se incubaron en agitador orbital a 120 rpm, en la oscuridad y 28°C por una semana. Al cabo del tiempo, se describieron los caracteres culturales del micelio y se separó por filtración con papel de filtro Whatman 1 (125 mm). Posteriormente, se determinó la masa seca del micelio (g) en cada tratamiento. Para ello, el micelio se secó a 60°C hasta obtener un peso constante (aproximadamente 40 h).
Para el análisis estadístico de los datos se empleó el programa SPSS Statistics versión 18.00. Previa comprobación del no cumplimiento de los supuestos de normalidad y homogeneidad de varianzas se emplearon las pruebas de Kruskal Wallis y Mann-Whitney para la comparación de las medias entre tratamientos.
RESULTADOS Y DISCUSIÓN
Los resultados del experimento demostraron que el H2O2 influyó en el crecimiento in vitro del aislado cubano M. fijiensis CCIBP-Pf-83. Se observaron cambios en la coloración del micelio a partir de 75 mmol l-1, con pérdida de la pigmentación (Figura1).
Los resultados de las determinaciones de la masa seca del micelio, mostraron variaciones en en el crecimiento del micelio en medio de cultivo PDB con diferentes concentraciones de H2O2 (Figura 2). Al adicionar 30 mmol l-1 de H2O2 se incrementó significativamente el crecimiento. Sin embargo, a partir de 50 mmol l-1, se produjo una reducción significativa, que para esta concentración fue de un 35.42%. El sucesivo incremento de las concentraciones de H202, redujo aún más el crecimiento de M.fijiensis.

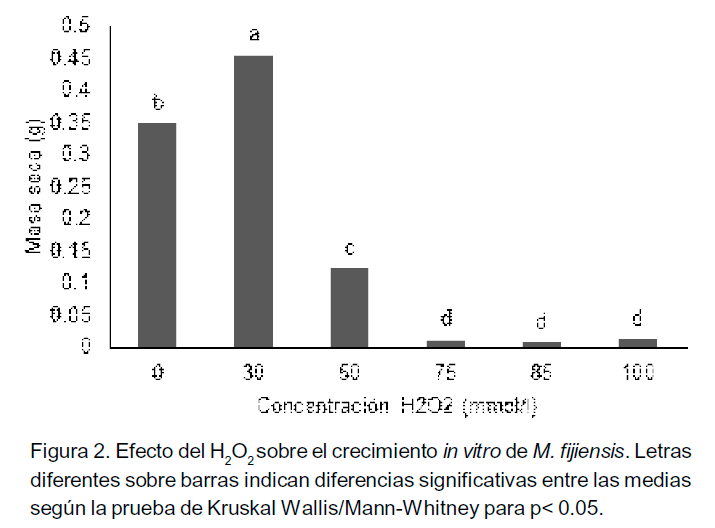
este experimento in vitro, salvando las diferencias con las condiciones in vivo, dan una idea de la necesidad de generar por la planta concentraciones iguales o superiores a los 50 mmol l-1 H2O2 en el tejido foliar en contacto con el hongo, para limitar su crecimiento durante el proceso de colonización. Por otro lado, aquellos cultivares que generen concentraciones iguales o próximas a los 30 mmol l-1 de H2O2, pudieran tener consecuencias peores en el desarrollo de la enfermedad porque podrían estimular el crecimiento.
Comparando los resultados con un estudio similar de un aislado mexicano de M. fijiensis realizado por Beltrán-García et al. (2009), el aislado cubano CCIBP-Pf-83 sufre una mayor reducción del crecimiento a partir de la concentración de 50 mmol l-1 de H2O2. Según Beltrán-García et al. (2009), el aislado empleado provenía de un campo de banana donde los fungicidas son extensivamente usados, desarrollando un mecanismo de adaptación que le permite mayor resistencia a los efectos del H2O2. Contrariamente, CCIBP-Pf-83 fue aislado de una pequeña parcela, donde no se aplican fungicidas, aunque en Cuba las aplicaciones de fungicidas para la Sigatoka negra, son consideradas bajas.
Este estudio permitió
determinar el efecto del peróxido de hidrógeno sobre el crecimiento
in vitro de un aislado cubano de M. fijiensis CCIBP-Pf-83
y contribuye a brindar un análisis
Estudios realizados en varias especies de hongos fitopatógenos, han mostrado
tres respuestas diferentes en cuanto a la capacidad de crecimiento del micelio
frente a concentraciones de H2O2 entre 10-9
a 10-3 M, incluidas las especies que contienen melanina Alternaria
alternata y Cladosporium cladosporioides. Los tipos de respuesta
fueron: 1) crecimiento constante entre 10-9 a 10-4
M de H2O2 y decrece el crecimiento a partir de 10-3
M; 2) decrecimiento constate cuando se incrementan las concentraciones de H2O2
y 3) incremento del crecimiento del micelio en concentraciones entre 10-7
a 10-5 M (Ivanova et al., 2005). Estas respuestas no fueron
observadas de igual forma en este experimento a las concentraciones empleadas
(10-2M).
Para el caso del
aislado CCIBP-Pf-83 la presencia de 30 mmol l-1 (3.10-2M)
de H2O2 representó un estímulo para el crecimiento
en las condiciones del experimento, contrastando con la reducción del
crecimiento observado a partir de 50 mmol l-1 (5.10-2 M).
Aunque no se tienen referencias exactas de las concentraciones de peróxido
que se producen en cultivares de banano resistentes y susceptibles a M. fijiensis
durante la interacción, sí es conocido que la respuesta del cultivar
resistente `Calcutta 4' genera especies reactivas de oxígeno anticipadamente
y en mayor magnitud con respecto al cultivar susceptible `Grande naine' (Sánchez-García
et al., 2010; Mendoza, 2013). Los resultados de
más integrador de los resultados obtenidos en los estudios de la interacción
con Musa donde se ha utilizado. Sin lugar a dudas, abre nuevas interrogantes
para un fenómeno tan complejo como la interacción Musa
spp.-M. fijiensis.
AGRADECIMIENTOS
A los miembros del laboratorio de Microbiología aplicada del IBP que amablemente ofrecieron el aislado (CCIBP-Pf-83) de M. fijiensis.
REFERENCIAS
Beltrán-García MJ, Manzo-Sanchez G, Guzmán-González S, Arias-Castro C, Rodríguez-Mendiola M, Avila-Miranda M, Ogura T (2009) Oxidative stress response of Mycosphaerella fijiensis, the causal agent of black leaf streak disease in banana plants, to hydrogen peroxide and paraquat. Can J Microbiol 55: 887894
Carlier J, Fouré E, Gauhl F, Jones DR, Lepoivre P, Mourichon X, Pasberg-Gauhl C, Romero, RA (2000) Black leaf streak. En: DR Jones (Ed.) Diseases of Banana, Abacá and Enset, pp. 3779. CABI Publishing. New York
Cavalcante MdJB, Escoute J, Madeira JP, Romero RE, Nicole MR, Oliveira LC, Hamelin C, Lartaud M, Verdeil J L (2011) Reactive oxygen species and cellular interactions between Mycosphaerella fijiensis and banana. Tropical Plant Biology 4: 134-143
Churchill ACL (2010) Mycosphaerella fijiensis, the black leaf streak pathogen of banana: progress towards understanding pathogen biology and detection, disease development, and the challenges of control. Mol Plant Pathol 12: 307-328
Hidalgo W, Duque L, Saez J, Arango R, Gil J, Rojano B, Schneider B, Otálvaro F (2009) Structure»activity relationship in the interaction of substituted perinaphthenones with Mycosphaerella fijiensis. Journal of Agricultural and Food Chemistry 57: 7417-7421
Ivanova AE, Aslanidi KB, Karpenko IuV, Belozerskaia TA (2005) The effect of hydrogen peroxide on the growth of microscopic mycelial fungi isolated from habitats with different levels of radioactive contamination. Mikrobiologiia 74:756-65
Mendoza MF (2013) Caracterización molecular de la interacción Musa acuminata- Mycosphaerella fijiensis Morelet. Tesis de Doctorado. Universidad Central `Marta Abreu' de Las Villas, Santa Clara
Orozco-Santos M, García-Mariscal K, Manzo-Sánchez G, Guzmán-González S, Martínez-Bolaños L, Garrido-Ramírez E, Torres-Amezcua JA, Canto-Canché B (2013) La sigatoka negra y su manejo integrado en banano. Libro Técnico Núm. 1. Campo Experimental Tecomán, CIRPAC, INIFAP. Tecomán, Colima
Otálvaro F, Nanclares J, Vásquez L E, Quiñones W, Echeverri F, Arango R, Schneider B (2007) Phenalenone-type compounds from Musa acuminata var. `Yangambi km 5' (AAA) and their activity against Mycosphaerella fijiensis. Journal of Natural Products 70: 887-890
Portal O, Izquierdo Y, De Vleesschauwer D, Sánchez-Rodríguez A, Mendoza-Rodríguez M, Acosta-Suárez M, Bárbara O, Jiménez E, Höfte M (2011) Analysis of expressed sequence tags derived from a compatible Mycosphaerella fijiensis -banana interaction. Plant Cell Rep. 30: 913-918
Sánchez-García C, Alvarado-Capó Y, Cruz-Martín M, Acosta-Suárez M, Leiva-Mora M, Roque B (2010) Detección de compuestos bioquímicos relacionados con la respuesta defensiva en plantas de Musa spp. inoculadas artificialmente con Mycosphaerella fijiensis. Biotecnología Vegetal 2 (2): 89-97
Torres J M, Calderón H, Rodríguez-Arango E, Morales J G, Arango R (2012) Differential induction of pathogenesis-related proteins in banana in response to Mycosphaerella fijiensis infection. European Journal of Plant Pathology 133: 887-898
Leiva-Mora M, Portal O, Alvarado-Capó Y, Acosta-Suárez M, Cruz-Martín M, Sánchez-García C, Rojas L, Roque B, Carrera K (2014) Caracterización molecular de aislados cubanos de Mycosphaerella fijiensis Morelet en base a grupos de apareamiento sexual. Rev. Protección Veg 1:70-74
Recibido: 6-02-2014
Aceptado:
21-03-2014
Copyright (c) 2016 Biotecnología Vegetal
![]()
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
