Artículo original
Biotecnología Vegetal Vol. 18, No. 2: 97 – 103, abril - junio, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Caracterización morfológica cualitativa en campo de plantas de Sorghum bicolor (L.) Moench cultivar ‘CIAP 132R-05’ regeneradas vía embriogénesis somática
Qualitative morphological characterization in field of Sorghum bicolor (L.) Moench cultivars 'CIAP 132R-05' plants regenerated via somatic embryogenesis
Silvio de Jesús Martinez Medina1,2, Raúl Barbón2, Novisel Veitía2, Gudelia Rodríguez Valdés1, Raúl Collado2, Orlando Saucedo Castillo1
1Centro de Investigaciones Agropecuarias, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830. e-mail: silviod@uclv.edu.cu
2Instituto de Biotecnología de Las Plantas, Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5,5. Santa Clara. Villa Clara. Cuba. CP 54830.
RESUMEN
La estabilidad fenotípica de las plantas obtenidas en condiciones in vitro es esencial para el éxito de cualquier protocolo de regeneración de plantas. El presente trabajo se realizó con el objetivo de caracterizar morfológicamente, a través de caracteres cualitativos y en condiciones de campo, plantas de Sorghum bicolor (L.) Moench cultivar ‘CIAP 132R-05’ regeneradas vía embriogénesis somática. Plantas obtenidas de embriones somáticos se compararon con plantas procedentes de semilla botánica. Se realizó una descripción de las etapas fenológicas durante el crecimiento y desarrollo de las plantas en condiciones de campo. Se evaluaron los caracteres morfológicos cualitativos de las hojas, el tallo y la panícula en dos progenies. Durante los periodos de cultivo se produjo homogeneidad en las etapas de desarrollo de las plantas de ambas poblaciones y en los caracteres morfológicos evaluados. La población de plantas obtenidas a partir de embriones somáticos y evaluados en condiciones de campo, durante dos generaciones, manifestó estabilidad fenotípica en los caracteres morfológicos cualitativos.
Palabras clave: caracteres cualitativos, estabilidad fenotípica, etapa fenológica, progenies
Abstract
The phenotypic stability of plants obtained under in vitro conditions is essential for the success of any plant regeneration protocol. The present work was carried out with the aim to characterize morphologically, through qualitative characters and in field conditions, plants of Sorghum bicolor (L.) Moench cv. 'CIAP 132R-05' regenerated via somatic embryogenesis. Plants obtained from somatic embryos were compared with plants from botanical seed. A description was made at the phenological stages during the growth and development of the plants under field conditions. The qualitative morphological characters of the leaves, the stem and the panicle were evaluated in two progeny. During the cultivation periods there was homogeneity in the stages of development of both plants populations and in the morphological characters evaluated. The population of plants obtained from somatic embryos and evaluated under field conditions, during two generations, showed phenotypic stability in the qualitative morphological characters.
Keywords: phenotypic stability, phenological stage, progenies, qualitative characters
INTRODUCCIÓN
El sorgo (Sorghum bicolor (L.) Moench) es un cultivo de adaptación en zonas tropicales y subtropicales del mundo, resulta de gran importancia para la alimentación humana y animal (Rooney et al., 2007). La planta de sorgo se desarrolla bajo condiciones ambientales desfavorables en las cuales es difícil de cultivar otros cereales. Esta característica se debe fundamentalmente a su resistencia al estrés hídrico y se considera como el cultivo más apto para las regiones áridas con bajos regímenes de precipitaciones (Metwali et al., 2013).
En Cuba, la producción de sorgo constituye una alternativa para la alimentación animal y humana. En el año 2015 en el país se cultivaron 14 036 ha, de las cuales 1 267 fueron del cultivar 'CIAP 132R-05' con una producción de 2 535 t en el año, lo que representó el 24.49% de la producción total (IIG, 2016). Este cultivar es muy aceptado por los productores debido a su ciclo semiprecoz, que permite la rotación con el cultivo del tabaco (Nicotiana tabacum L.). Se caracteriza por su capacidad media de rebrote, fácil cosecha manual (porte pequeño), alto rendimiento agrícola en condiciones de secano (2.5 t ha-1) y tolerancia a plagas (MINAG, 2005).
El cultivo de células in vitro induce cambios en muchas especies vegetales, los cuales son denominados como variación somaclonal (Bairu et al., 2011). En sorgo existen pocos estudios en condiciones de campo relacionados con la estabilidad fenotípica de las plantas regeneradas in vitro. En este sentido, Hungtu et al. (1986) encontraron en la progenie R0 variaciones morfológicas y citológicas donde la mayoría de estas no se transmitieron a las progenies R1 y R2.
En otra planta monocotiledónea como la caña de azúcar (Sacharum spp.), Castañeda et al. (2014) y Wendling et al. (2014) hicieron referencia al efecto del rejuvenecimiento fisiológico inducido por el cultivo in vitro en las plantas obtenidas por esta vía. También Freire et al. (2016) encontraron en la propagación de plantas regeneradas por embriogénesis somática en medio de cultivo líquido, la aparición de variaciones fenotípicas en campo asociadas al rejuvenecimiento in vitro.
Los embriones somáticos según Freire (2003) son material vegetal clonado comparado con los embriones cigóticos, por ello es esencial verificar la fidelidad genética y las características fenotípicas en condiciones de campo de las plantas, regeneradas de embriones somáticos para asegurarse de que la embriogénesis somática para cada especie en particular entre ellas el sorgo, no está causando modificaciones genéticas. En S. bicolor cv. 'CIAP 132R-05', Martínez et al. (2016) encontraron cambios en varios caracteres morfológicos cuantitativos en la R0 que no aparecieron al evaluar la R1 y consideraron que estos se debían al efecto del rejuvenecimiento fisiológico y que pueden ser causados por cambios epigenéticos durante el cultivo de tejidos per se. Sin embargo estos autores al evaluar las dos progenies de plantas no hacen referencia a los resultados relacionados con los caracteres morfológicos cualitativos.
Debido a lo anteriormente expuesto se realizó el presente trabajo con el objetivo de caracterizar morfológicamente los caracteres cualitativos en condiciones de campo de plantas de Sorghum bicolor (L.) Moench cultivar ‘CIAP 132R-05’ regeneradas vía embriogénesis somática.
MATERIALES Y MÉTODOS
La presente investigación se realizó en la CCS El Vaquerito ubicado en el municipio de Santa Clara, provincia de Villa Clara en un suelo oscuro mullido medianamente lixiviado (Hernández et al., 2015) y la topografía ligeramente llana.
Material vegetal
Plantas regeneradas de embriones somáticos del cultivar de sorgo granífero 'CIAP 132R-05' según el procedimiento descrito por Martínez et al. (2016) y plantas obtenidas de semilla botánica con categoría básica procedentes del banco de semillas del Centro de investigaciones Agropecuarias de la Universidad Central Marta Abreu de Las Villas.
Diseño y condiciones experimentales
Se compararon plantas procedentes de embriones somáticos y de semilla botánica con 30 días de cultivo en condiciones de campo. Se empleó un diseño experimental de bloques al azar compuesto por tres réplicas por tratamiento y de 1500 plantas por tratamiento. Cada parcela (réplica) tenía de 25.2 m2, con 6 m de largo y 4.20 m de ancho, seis surcos espaciados a 0.70 m uno de otro y 16 plantas por metro lineal. Se evaluaron 50 plantas al azar por réplica cada 10 días en dos progenies.
El experimento para la evaluación de la progenie R0 se desarrolló en condiciones de temperaturas máximas que fluctuaron entre 30.4 y 33.3 °C, humedad relativa entre 84 y 86%, precipitaciones promedio de 114.8 y 280 mm y velocidad del viento entre 3.7 y 4.5 km h-1. El experimento de la progenie R1 se llevó a cabo con temperaturas máximas que oscilaron entre 26.4 y 29.0 °C, humedad relativa entre 82 y 88%, precipitaciones entre 9.8 y 102.5 mm y una velocidad del viento entre 5.0 y 5.5 km h-1.
Todas las labores agrotécnicas al cultivo, fertilización, riego y control de plagas y arvenses, se realizaron según las normas técnicas propuestas por Canet et al. (2011) para el cultivo del sorgo.
Caracteres morfológicos cualitativos
Etapas de crecimiento y desarrollo
Se realizó una descripción de las etapas fenológicas durante el crecimiento y desarrollo de las plantas en condiciones de campo (desde los diez días hasta los 55 días después del trasplante para R0 y desde la siembra hasta la madurez fisiológica a los 85 días después de la siembra para R1). Esta se realizó según las etapas de crecimiento del sorgo adaptada por Frederiksen (1986). Las evaluaciones se realizaron cada 24 horas, para determinar el momento de ocurrencia de cada etapa fenológica.
Caracteres cualitativos relacionados con la morfología de la planta
Para evaluar la estabilidad fenotípica de las plantas obtenidas a partir de embriones somáticos, en comparación con las plantas procedentes de semilla botánica se empleó el descriptor del Registro Nacional de Variedades Comerciales (MINAG, 2005) para este cultivar, en cual aparecen los caracteres morfológicos cuantitativos, cualitativos y agronómicos.
Los caracteres cualitativos (Tabla 1) se describieron según sus expresiones fenotípicas. Para ello se tomaron 50 plantas al azar por réplica en las dos poblaciones de plantas, tanto para la progenie R0 como la R1 .
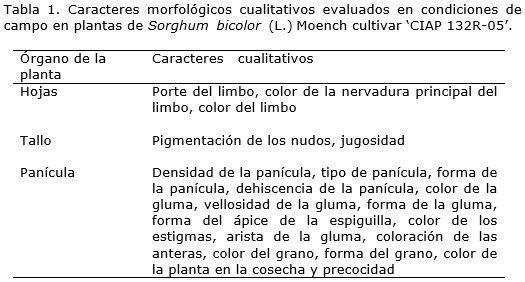
También en las poblaciones de plantas estudiadas se evaluó de forma visual la incidencia de las plagas de importancia económica que aparecen referidas en el Registro de Nacional de Variedades Comerciales (MINAG, 2005) para el cultivar en estudio.
RESULTADOS Y DISCUSIÓN
Caracteres morfológicos cualitativos
Etapas de crecimiento y desarrollo
Las plántulas después de ocho días de trasplantadas en campo iniciaron un rápido crecimiento y desarrollo (Figura 1 A). A los 30 días después del trasplante, el grano se tornó lechoso y tomó una coloración verde (Figura 1 B). Después de 42 días en condiciones de campo se inició el desarrollo de la masa del grano y comenzó un cambio de coloración de verde a rojo claro (Figura 1 C). Las plantas alcanzaron la madurez fisiológica a los 55 días después del trasplante. En esta etapa de desarrollo el grano tomó la coloración roja típica del cultivar (Figura 1 D). Las etapas se correspondieron con la descripción realizada por Canet et al. (2011).

Caracteres cualitativos relacionados con la morfología de las plantas
Los caracteres cualitativos relacionados con la morfología de la planta de las dos poblaciones en estudio, tanto para la progenie R0 como para la R1 , se correspondieron con los descritos para este cultivar según MINAG (2005) (Tabla 2, Figura 2).
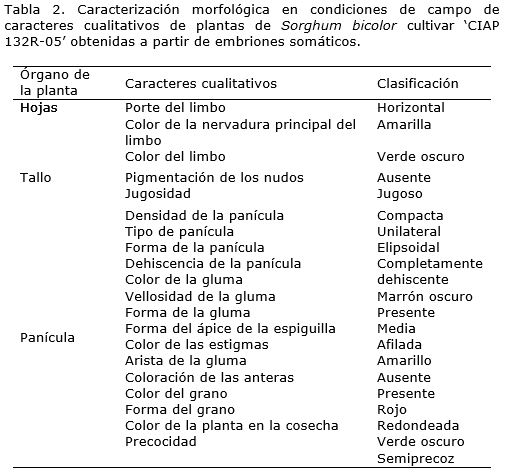

Los factores del medioambiente no influyeron en los caracteres cualitativos. Según González y Rojo (2008) los caracteres cualitativos son menos influenciados por el ambiente y se pueden identificar fácilmente. Los cultivares deben tener, además de altos rendimientos, características uniformes y una respuesta consistente que permita identificarlos y facilitar su multiplicación (Douglas et al., 1991).
Los criterios anteriormente expuestos permitieron concluir que en las plantas de las poblaciones estudiadas existía correspondencia entre los caracteres morfológicos cualitativos, así como con la descripción del Registro Nacional de Variedades Comerciales (MINAG, 2005). En condiciones ex vitro la respuesta de las plantas de sorgo regeneradas in vitro no presentaron variación en los caracteres morfológicos cualitativos evaluados con respecto al cultivar donante, estos resultados coinciden con los obtenidos por Amali et al. (2014). Los efectos del rejuvenecimiento in vitro referidos por Martínez et al. (2016) no se observaron a nivel de caracteres cualitativos, por ello es necesario un análisis integral de los caracteres cualitativos y cuantitativos en poblaciones de plantas obtenidas por cultivo de tejidos.
Al evaluar la incidencia de plagas de importancia económica en este cultivar, en las poblaciones de plantas estudiadas no se observaron daños de relevancia en el cultivo.
CONCLUSIONES
Los caracteres morfológicos cualitativos de la población de plantas obtenidas a partir de embriones somáticos coinciden con los de la población de plantas de semilla botánica y manifestaron estabilidad fenotípica en los caracteres evaluados en condiciones de campo durante dos generaciones.
Conflicto de intereses
Los autores no declaran conflicto de interés.
REFERENCIAS
Amali P, Kingsley SJ, Ignacimuthu S (2014) Enhanced plant regeneration involving somatic embryogenesis from shoot tip explants of Sorghum bicolor (L. Moench). Asian Journal of Plant Science and Research 4(3): 26-34
Bairu MW, Aremu AO, Van Staden J (2011) Somaclonal variation in plants: causes and detection methods. Plant Growth Regul 63(2): 147-173; doi:10.1007/s10725-010-9554-x
Canet R, Rivero L, Armenteros M (2011) Manual para la producción del cultivo del sorgo (Sorghum bicolor (L.) Moench. Instituto de Investigaciones de Granos, Cuba; ISBN: 959-246-094-9
Castañeda O, Gómez FC, Trejo LI, Morales V, González MT, Martínez YM, Gómez R, Pastelim MC (2014) Aplicaciones del cultivo de tejidos vegetales en caña de azúcar. AGROproductividad 7(2): 18-23
Douglas JH, Sullivan TW, Bond PL, Robersom LG (1991) Chemical Composition and Nutritional Value of Shattercane Sorghum for Broilers. Poultry Science 70(2): 408-411; doi:10.3382/ps.0700408
Frederiksen RA (1986) Compendio de enfermedades de sorgo. The American Phytopathological Society, Minnesota
Freire M (2003) Aspectos básicos de la embriogénesis somática. Biotecnología Vegetal 4(3): 195 – 200
Freire M, Gómez-Kosky R, Herrera I, Reyes M, de Feria M, Barbón R, Jiménez E (2016) Variabilidad fenotípica en campo de plantas de Saccharum spp. híbrido cv. ‘C87-51’ regeneradas vía embriogénesis somática. Biotecnología Vegetal 16(4): 215-222
González TF, Rojo HC (2008) Gramíneas y seudocereales. Portuario de agricultura: cultivos agrícolas. Mundi Prensa, Madrid
Hernández A, Pérez JM, Bosch D, Rivero N (2015) Clasificación de los Suelos de Cuba. Instituto Nacional de Ciencias Agrícolas, Cuba; ISBN: 978-959-7023-77-7
IIG (2016) Instituto de Investigaciones de Granos, Informe anual sobre las producción de granos. Ministerio de la Agricultura, La Habana
Hungtu M, Minghong G, Liang GH (1986) Plant regeneration from cultured immature embryos of Sorghum bicolor (L.) Moench. Theoretical and Applied Genetic 73(3): 389-394
Martínez S, Gómez-Kosky R, Rodríguez Valdés G, Veitía Rodríguez N, Saucedo Castillo O, Gil Díaz V (2016) Caracterización morfológica de plantas de sorgo granífero variedad CIAP 132R-05 regeneradas vía embriogénesis somática en condiciones de campo. Centro Agrícola 43(3): 73-79
MINAG (2005) Registro de Variedades Comerciales. Dirección de Semillas Ministerio de la Agricultura, Cuba
Metwali EMR, Gowayed SMH, Al-Maghrabi O, Mosleh YY (2013) Evaluation of toxic effect of copper and cadmium on growth, physiological traits and protein profiles of wheat (Triticum aestivum L.), maize (Zea mays L.) and sorghum (Sorghum bicolor L.). World Appl Sci J 21(3): 301-314; doi:10.5829/idosi.wasj.2013.21.3.2835
Rooney WL, Blumenthal J, Bean B, Mollet JE (2007) Designing sorghum as a dedicated bioenergy feedstock. Biofuels, Bioprod and Bioref 1: 147-157
Wendling I, Trueman SJ, Xavier A (2014) Maturation and related aspects in clonal forestry part II: reinvigoration, rejuvenation and juvenility maintenance. New Forests 45: 473
Recibido: 09-01-2018
Aceptado: 29-03-2018
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
