Artículo original
Biotecnología Vegetal Vol. 18, No. 2: 105 - 110, abril - junio, 2018
Instituto de Biotecnología de las Plantas. UCLV. MES.
eISSN 2074-8647, RNPS: 2154
Propagación in vitro de germoplasma nativo de Hedeoma multiflora Benth. vía organogénesis
In vitro propagation of Hedeoma multiflora Benth. native germplasm via organogenesis
María Soledad Díaz Gabutti, Jorge Leporati, Patricia Verdes
Facultad de Ingeniería y Ciencias Agropecuarias (FICA), Universidad Nacional de San Luis (Argentina). 25 de Mayo 384. Villa Mercedes. San Luis. Argentina. CP 5730. e-mail: peverdes@unsl.edu.ar
RESUMEN
Las poblaciones naturales de Hedeoma multiflora Benth. (Lamiaceae) se encuentran sobreexplotadas y en peligro de extinción por sus múltiples usos. Resulta necesario implementar métodos de propagación de germoplasma nativo para lograr la sostenibilidad del recurso vegetal. El objetivo del presente trabajo fue propagar in vitro germoplasma nativo de H. multiflora vía organogénesis. Segmentos binodales de plantas crecidas en condiciones naturales se establecieron in vitro en medio de cultivo Murashige y Skoog (MS) 50% con 2.69 μM de ácido naftalenacético (ANA) y 2.22 μM de bencilaminopurina (BA). Los brotes obtenidos se individualizaron y se subcultivaron a medio de cultivo MS 50% con diferentes concentraciones de ANA y BA. Las plantas obtenidas in vitro fueron aclimatizadas en cuatro sustratos: perlita, perlita : suelo (1:1), perlita : turba (1:1) y suelo. Con las condiciones experimentales ensayadas fue posible el establecimiento in vitro de H. multiflora. No se observaron diferencias significativas para el número de brotes por explante con las combinaciones de reguladores del crecimiento utilizadas. En la fase de aclimatización ex vitro se obtuvo una supervivencia entre 40 y 80% que luego disminuyó por debajo de 20%. La propagación in vitro de germoplasma nativo de H. multiflora vía organogénesis genera un elevado número de plantas in vitro. Estas podrían emplearse para restaurar ecosistemas dañados, la conservación de germoplasma y la producción de metabolitos secundarios.
Palabras clave: cultivo in vitro, especie nativa, medicinal
ABSTRACT
The natural populations of Hedeoma multiflora Benth. (Lamiaceae) are overexploited and endangered due to their multiple uses. It is necessary to implement propagation methods of native germplasm to achieve the sustainability of the plant resource. The objective of the present work was to in vitro propagate H. multiflora native germplasm via organogenesis. Binodal segments of plants grown under natural conditions were in vitro established in 50% Murashige and Skoog medium with 2.69 μM naphthaleneacetic acid (NAA) and 2.22 μM benzylaminopurine (BA). The shoots obtained were individualized and subcultured to 50% MS with different concentrations of NAA and BA. The in vitro plants were acclimatized in four substrates: perlite, perlite: soil (1:1), perlite: peat (1:1) and soil. With the experimental conditions tested, the in vitro establishment of H. multiflora was possible. No significant differences were observed for the number of shoots per explant with the combinations of growth regulators used. In the ex vitro acclimatization stage, a survival between 40 and 80% was obtained, and then decreased below 20%. The in vitro propagation of H. multiflora native germplasm via organogenesis generates a high number of in vitro plants. These could be used to restore damaged ecosystems, the germplasm conservation and the production of secondary metabolites.
Keywords: in vitro culture, medicinal, native plant
INTRODUCCIÓN
Hedeoma multiflora Benth. (Lamiaceae), conocida como “Tomillo de las Sierras” o “Peperina de las Lomas” es una especie originaria de zonas templadas de América, se encuentra en las sierras centrales de Argentina, especialmente en San Luis y Córdoba (Barboza et al., 2006; Elechosa, 2009). Secreta aceites esenciales (Amorin, 1988; Mulder-Krieger et al., 1988; Vazquez et al., 2007; van Baren et al., 2010) compuestos principalmente por una mezcla de terpenos donde los monoterpenos son los principales constituyentes (Soheil y Rodney, 2003). Dentro de sus múltiples usos, posee propiedades aromatizantes, digestivas y medicinales para dolores reumáticos (Retamar, 1986; Barboza et al., 2006).
Esta especie se encuentra en peligro de extinción debido a que se recolecta de manera manual en poblaciones naturales, lo cual conlleva a su sobreexplotación (Martínez et al., 2006). A su vez, el avance de la frontera agropecuaria ha generado una disminución de ejemplares naturales (Brunetti et al., 2007). Por ello se hace necesario el uso de métodos de propagación que sean eficientes, sostenibles y garanticen la conservación del recurso vegetal.
El empleo de técnicas biotecnológicas podría contribuir al desarrollo y conservación de germoplasma nativo. En este sentido, para especies del género Hedeoma tales como H. todsenii y H. drummondii Benth existen antecedentes propagación por cultivo in vitro (Pence et al 2009; Zamora-Hierro y López-Escamilla, 2013). También para H. multiflora se ha observado que a partir de ápices o segmentos nodales de plantas cultivadas en campo es posible establecer plantas in vitro (Brunetti et al., 2007; Koroch et al., 1997; Díaz et al., 2010; Díaz et al., 2016). Sin embargo, aun los estudios sobre la multiplicación y aclimatización de las plantas son escasos.
Atendiendo a todo lo anterior, el objetivo del presente trabajo fue propagar in vitro germoplasma nativo de H. multiflora vía organogénesis, como herramienta para la domesticación y desarrollo de germoplasma nativo con valor agregado.
MATERIALES Y MÉTODOS
Material vegetal
Tallos de plantas de H. multiflora con las características fenotípicas de la especie y sin síntomas visibles de incidencia de patógenos se recolectaron manualmente respetando las buenas prácticas de recolección (Elechosa, 2009) en el área silvestre Potrero de los Funes (Altitud 84 m.s.n.m, 32° 24´ 00´´ S 65° 01´ 00´´ 0) provincia de San Luis (Argentina).
Establecimiento y multiplicación in vitro
Los explantes (segmentos binodales) tomados de los tallos de las plantas crecidas en condiciones naturales se establecieron in vitro en medio de cultivo Murashige y Skoog (MS) 50% (Murashige y Skoog, 1962), 2.69 μM de ácido naftalenacético (ANA) y 2.22 μM de bencilaminopurina (BA) según lo descrito por Díaz et al. (2016). Las condiciones de cultivo fueron las informadas por dichos autores.
Los brotes obtenidos se individualizaron y se subcultivaron a medio de cultivo MS 50% con diferentes concentraciones de ANA y BA para su multiplicación: tratamiento 1: 0.054 ANA + 1.11 BA, tratamiento 2: 0.269 ANA + 2.22 BA y tratamiento 3: 2.690 ANA + 2.22 BA (control)
Los explantes individualizados se colocaron en tubos de vidrio con 50 ml de medio de cultivo estéril, y se posteriormente se mantuvieron en cámara de crecimiento a 24 ± 2 °C con fotoperiodo de 16 horas y una intensidad de 48 mmol s-1 m-1. Se colocó un explante por tubo y se realizaron 30 repeticiones de cada tratamiento. La tasa de multiplicación se calculó a la cuarta semana de cultivo como el número de brotes obtenido por cada explante subcultivado. Se describieron las características fenotípicas de las plantas in vitro.
Aclimatización
Las plantas obtenidas in vitro fueron aclimatizadas en cuatro sustratos: perlita, perlita : suelo (1:1), perlita : turba (1:1) y suelo (obtenido en el sitio de muestreo, Haplustol udorténtico Familia francogruesa, mixta, térmica. Serie Cortaderas) (Peña et al., 2006).
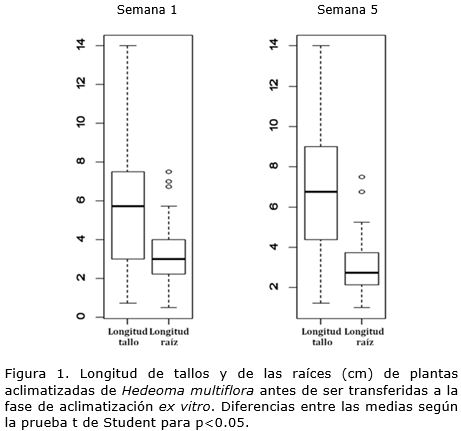
Antes de colocar las plantas en los sustratos, se calculó el promedio de la longitud de los tallos y de las raíces de cada planta para determinar el efecto de la relación tallo:raíz y de las longitudes del tallo y de la raíz sobre la supervivencia de las plantas. El promedio de la longitud de los tallos y de las raíces de cada planta se calculó con las mediciones de la longitud del tallo/raíz más cortos y más largos.
En recipientes de plástico de 150 ml de capacidad con el sustrato correspondiente, se colocaron las plantas (una por cada vaso, sin individualizar los brotes) y se regaron con 50 ml de agua. Además, se colocó una bolsa de nylon ajustada para mantener la humedad. Se mantuvieron en cámara a 24 ± 2 °C con fotoperiodo de 16 horas y una intensidad de 48 mmol s-1 m-1.
Después de una semana en fase de aclimatización se cuantificó el número de plantas vivas y se calculó el porcentaje de la supervivencia. Este análisis se repitió a las cinco semanas después de aclimatizadas.
Análisis estadísticos
Los análisis estadísticos se realizaron con el programa R (Botella-Rocamora et al., 1998). Se comprobó la normalidad de los datos en cada análisis mediante la prueba Shapiro-Wilk y la homogeniedad de varianzas mediante la prueba de Bartlett. Al no cumplirse los supuestos el análisis se realizó con estadísticos no paramétricos (Kruskal Wallis). El análisis del efecto del promedio de la longitud del tallo y de la raíz sobre la supervivencia se realizó con la prueba t de Student.
RESULTADOS Y DISCUSIÓN
Con las condiciones experimentales ensayadas fue posible el establecimiento in vitro de H. multiflora. Después de ocho semanas de cultivo las plantas in vitro mostraban color verde, numerosos brotes y raíces en correspondencia con lo descrito previamente (Díaz et al., 2016).
Los resultados del análisis de la multiplicación de los brotes demostraron que con la combinación de reguladores del crecimiento utilizada (ANA y BA) no se observaron diferencias significativas para el número de brotes por explante (T1 0.054 ANA + 1.11 BA: 4.20 ± 3.25, T2 0.269 ANA + 2.22 BA: 3.67 ± 2.80 y T3 2.690 ANA + 2.22 BA: 5.73 ± 3.91) a las cuatro semanas de cultivo. Estos resultados coincidieron con informes previos de otros autores que demostraron que es posible multiplicar in vitro de esta especie con ANA y/o BA con un número variable de brotes por explante. En este sentido, Koroch et al. (1997), utilizaron un medio de cultivo MS 50% con 22.20 μM de BA sola o en combinación con 0.05 μM ANA. De igual forma, Brunetti et al. (2007) refirieron el empleo de un medio de cultivo basal MS 50%, con 0.054 µM de ANA. En otra especie, H. todsenii, Pence et al. (2009) obtuvieron el mayor promedio en el número de brotes/cultivo en medio de cultivo basal MS con 0.5 μM de 6- bencilaminopurina (BAP). Además, se ha ensayado con otros medios de cultivo y reguladores del crecimiento. Por ejemplo, Díaz et al. (2010) emplearon medio de cultivo Schenk y Hildebrandt (SH) (Schenk y Hildebrandt, 1972) con 0.50 μM de ANA y BA y Zamora-Hierro y López-Escamilla (2013) obtuvieron el mayor número de brotes/explante de H. drummondii en el medio de cultivo MS 100% con 2 mg l-1 de isopentenil adenina y en el medio de cultivo MS 100% con 2 mg l-1 de BA.
Sin embargo, si se consideran los resultados previos informados por Díaz et al. (2016), de los cuales este trabajo es continuidad, y donde las plantas se mantuvieron por ocho semanas en fase de establecimiento, se destaca que alargar el tiempo de subcultivo en el mismo medio de cultivo con 2.690 ANA y 2.22 BA eleva el número de brotes por explante hasta 32.5 y con un número promedio de raíces de 17.5. Estos indicadores son superiores a los informados en los trabajos mencionados anteriormente y evidencian que el potencial de multiplicación in vitro de la especie es elevado. Además, atendiendo a las propiedades de la especie para producir metabolitos secundarios (Vazquez et al., 2007), la biomasa obtenida mediante la propagación in vitro vía organogénesis podría convertirse en una fuente para su obtención y explotación comercial.
A la semana después de la aclimatización la supervivencia de las plantas alcanzó entre el 40% (perlita, perlita:suelo, suelo) y el 80% (perlita: turba). A la quinta semana la supervivencia disminuyó por debajo del 20% en todos los tratamientos.
La relación tallo:raíz influyó en la supervivencia de las plantas en la aclimatización ex vitro. En ese sentido, la longitud del tallo fue significativamente mayor (p <0.05) que la longitud de la raíz en las plantas que sobrevivieron tanto a la semana uno como a la semana cinco (Figura 1). Estos resultados indicaron que se requieren otros estudios que profundicen en las condiciones de aclimatización en aras de mantener los porcentajes de supervivencia y garantizar que las plantas puedan ser empleadas para la plantación en viveros o campo. Los trabajos científicos sobre la aclimatización de H. multiflora son escasos. Koroch et al. (1997) utilizaron como único sustrato en la aclimatización una mezcla de vermiculita y tierra con lo cual obtuvieron una supervivencia satisfactoria aunque no informaron datos cuantitativos.
Los resultados indicaron que el germoplasma nativo de H. multiflora puede ser propagado in vitro vía organogénesis (Figura 2). La implementación de esta vía de propagación permitirá realizar transferencias tecnológicas al sector productivo/recolector. El cambio de paradigma que implica la reducción y en lo posible, el abandono de la recolección extractiva por su uso y producción racional, generará un impacto ecológico positivo en las poblaciones silvestres, disminuirá su erosión genética y por otra parte, contribuirá al desarrollo emprendedor de pequeños productores. Además, permitirá la multiplicación de quimiotipos en programas de mejoramiento genético, conservación y domesticación de germoplasma nativo con valor agregado.

CONCLUSIONES
La propagación in vitro de germoplasma nativo de H. multiflora vía organogénesis genera un elevado número de plantas in vitro. Estas podrían emplearse para restaurar ecosistemas dañados, la conservación de germoplasma y la producción de metabolitos secundarios.
AGRADECIMIENTOS
Secretaria de Ciencia y Técnica de la Facultad de Ingeniería y Ciencias Agropecuarias, Universidad Nacional de San Luis, Argentina, PROICO 141014.
Conflicto de intereses
Los autores no declaran conflicto de intereses.
REFERENCIAS
Amorin JL (1988) Guía taxonómica con plantas de interés farmacéutico. Colegio Oficial de farmacéuticos y bioquímicos de la Capital Federal, Buenos Aires
Barboza GE, Canter JJ, Nuñez C, Ariza Espinar L (2006) Flora Medicinal de la Provincia de Córdoba. Córdoba, Argentina. Editorial Museo Botánico; ISBN: 987-98694-1-9
Botella-Rocamora P, Alacreu-García M, Martínez-Beneito MA (1998) Instalación e introducción al software estadístico R y la librería R-Commander. Estadística descriptiva. Disponible en: https://www.uv.es/~mamtnez/IRCED.pdf. Consultado 17/09/2018
Brunetti PC, Ortiz L, Palacio L, Lloret C, Goleniowski M (2007) Micropropagation of “Tomillo de las Sierras” Hedeoma multiflorum Benth. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 6(6): 391-392
Díaz MS, Figueroa AC, Palacio L, Goleniowski ME (2010) In vitro Hedeoma multiflorum Benth propagation in response to different nutritional conditions. Molecular Medicinal Chemistry 21: 17-20
Díaz MS, Leporati J, Terenti C, Ponce A, Verdes P (2016) Establecimiento in vitro de Hedeoma multiflora Benth. Dominguezia 32(2): 61
Elechosa MA (2009) Manual de recolección sustentable de plantas aromáticas nativas de la región central y noroeste de la argentina. Ediciones INTA, Buenos Aires, Argentina
Koroch AR, Juliani HR, Juliani HR, Trippi V (1997) Micropropagation and acclimatization of Hedeoma multiflorum. Plant Cell, Tissue and Organ Culture 48: 213–217
Martínez G, Planchuelo A, Fuentes E, Ojeda M (2006) A numeric index to establish conservation priorities for medicinal plants in the Paravachasca Valley, Córdoba, Argentina. Biodiversity and conservation 15: 2457-2475
Mulder-Krieger TH, Verpoorte R, Baerheim Svendren A, Sheffer JJC (1988) Production of essential oils and flavours in plant cell and tissue cultures. A review. Plant Cell Tissue and Organ Culture 13: 85–154
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco cultures. Physiology Plantarum 15: 473-497
Pence VC, Douglas Winget G, Lindsey KM, Plair BL, Charls SM (2009) In vitro propagation, cryopreservation, and genetic analysis of the endangered Hedeoma todsenii (Lamiaceae). Madroño 56(4): 221–228; doi:10.3120/0024-9637-56.4.221
Peña Z, Carlos A, d`Hiriart A (2006) Carta de Suelos de la República Argentina Hoja San Luis Provincia de San Luis Escala 1:100 000. Ediciones INTA gobierno de la provincia de San Luis Ministerio del Campo, San Luis, Argentina
Retamar JA (1986) Essential oils from aromatic species. En: Varghese J (eds). On Essential Oils, pp. 245-246. Synthite Industrial Chemicals Private Ltd, India
Schenk RU, Hildebrandt AC (1972) Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany 50(1): 199-204; doi:10.1139/b72-026
Soheil SM, Rodney BC (2003) Menthofuran regulates essential oil biosynthesis in peppermint by controlling a downstream monoterpene reductas. Plant Biology 100(24): 14481-14486; doi:10.1073/pnas.2436325100
van Baren CM, Sanguinetti S, Di Leo LP, Bandoni AL, Juárez MA, Elechosa M, Molina AM, Fernández EA, Martínez E (2010) El aceite esencial de Hedeoma multiflora Benth. (Lamiaceae) de poblaciones naturales en la provincia de San Luis, Argentina, Estudio comparativo. Dominguezia 26(1): 13-20
Vazquez AM, Goleniowski M, Brunetti P, Cantero JJ, Demmel MG, Criado S, Ferrari MC, Aimar ML (2007) Estudio comparativo de la composición química (compuestos orgánicos volátiles) por hs-spme/gc-ms de Hedeoma multiflora Benth. (Lamiaceae), micropropagadas y de poblaciones silvestres. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 6(5): 284-285
Zamora-Hierro SL, López-Escamilla AL (2013) Micropropagación de Hedeoma drummondii Benth. Estudios científicos en el estado de Hidalgo y zonas aledañas. En: Pulido-Flores G, Monks S (eds). Estudios científicos en el estado de Hidalgo y zonas aledañas, pp. 2-13. Zea Books, Lincols
Recibido: 13-01-2018
Aceptado: 14-03-2018
Copyright (c) 2018 Biotecnología Vegetal
Biotecnología Vegetal eISSN 2074-8647, RNPS: 2154. ISSN 1609-1841, RNPS: 0397 Editada por: Instituto de Biotecnología de las Plantas. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5.5, Santa Clara, Villa Clara, Cuba CP 54 830 Tel: 53 42200124, e-mail: info@ibp.co.cu

Biotecnología Vegetal está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
